التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
Posted in :
ملاحظة هامة: هذا المقال مشتق بتصرف من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
كما ان جميع الصور و الشكال من نفس الكتاب المذكور أعلاه.
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
1 – مقدمة
قد يعتقد باحث كيميائي شاب طموح بأنه قام بتحضير المركب 2-فينيل إيثانول، و لكن أنى له أن يتأكد بأن المركب الذي قام بتحضيره هو ما يريده ؟ و هذا الأمر يقودنا إلى حقيقة أن في السنوات الأولى للكيمياء العضوية كان العمل على تحديد التركيب الكيميائي للمواد الجديدة في كثير من الأحيان مهمة جبارة، فقد كانت الخطوة الأولى لتحقيق ذلك هو التحليل العنصري أي تحليل المركب لتبيان العناصر التي يتكون منها. فمعرفة النسبة المئوية لكل عنصر موجود في المركب يساعد على التنبؤ بالصيغة التجريبية و بناء عليها يمكن كتابة الصيغة الجزيئية و التي قد تكون هي نفسها للصيغة التجريبية أو مضاعفاتها. فالتحليل العنصري لا يزال معيارًا مهمًا لنقاء و جودة المركب المطلوب دراسته.
ولكن كيف يتم ترتيب الذرات في الفراغ؟ و ما هي المجموعات الوظيفية الموجودة؟ وماذا عن الهيكل البنائي لذرات الكربون؟ هل هو حلقي أو لا حلقي؟ و هل هناك تفرعات وأين توجد ؟ هل توجد حلقات بنزين ، و إن وجدت أين هو موقعها في التركيب البنائي؟ فكل هذه الأسئلة و غيرها الكثير كان لا بد من الإجابة عنها عن طريق الوسائل الكيميائية. فمثلا يمكن استخدام التفاعلات ، مثل تحلل الأوزون أو التصبن ، لتحويل الجزيئات المعقدة إلى أبسط منها و التي يمكن لتراكيبها دراستها و تحديدها بكل سهولة. و لتحديد المجموعات الوظيفية يمكن تطبيق اختبارات كيميائية مختلفة (مثل اختبارات البروم أو البرمنجنات للتفريق بين المركبات المشبعة و غير المشبعة أو اختبار مرآة الفضة (اختبار تولينز Tollens ) للتأكد من وجود مجموعة الألديهيد من عدمه.
و بمجرد معرفة المجموعة الوظيفية فإنه يمكن استخدام التفاعلات المفهومة جيدا من الناحية الكيميائية لتحويل المركب المجهول إلى مركب معروف تركيبه الكيميائي بدقة. فمثلا إذا كان المركب المشتبه به عبارة عن ألدهيد و يحتوي على المجموعة R و انه عند تأكسده سيتحول إلى حمض كربوكسيلي وإذا ما كانت الخواص الفيزيائية (درجة الانصهار ، درجة الغليان ، و طبيعة التدوير النوعي إذا كان المركب كيرالي ، وهكذا) والتفاعلات الكيميائية للحمض الناتج من الألدهيد متفقة مع تلك الخاصة بحمض معروف مسبقا ، فإنه يمكن استنتاج أن مجموعتي R في كلا المركبين (الألدهيد و الحمض) هما نفس الشيء ، وبالتالي يمكن و بسهولة تحديد بنية الألدهيد.
أما إذا لن تتوافق مجمعتي R في كلا المركبين فإنه في هذه الحالة يجب على المرء التفكير مليا في التركيب البنائي للمركب المشتبه به. إن البرهان النهائي للتركيب الكيميائي جاء نتيجة تحضير و تصنيع مواد مجهولة من مركبات تراكيبها الكيميائية معروفة بالفعل ، من خلال تفاعلات التي كانت نتائجها غير واضحة. و تدريجيا و على مر السنين ، تم بناء شبكة واسعة من المركبات مع تراكيب معروفة وفهرستها في الكتب المرجعية للرجوع إليها وقت الحاجة.
و لا تزال هذه الطرق تستخدم – والتي تتطلب بالطبع في كثير من الأحيان أسابيع أو أشهر أو حتى سنوات – في ظروف و مواقف معينة. ولكن منذ الأربعينيات من القرن الماضي ، سهلت أنواع مختلفة من التحليل الطيفي وسرعت عملية تحديد التركيب و البنبة الكيميائية إلى حد كبير. و لقد تم تطوير الأدوات الآلية التي تسمح لنا بتحديد وتسجيل الخواص الطيفية في كثير من الأحيان بجهد أكبر من الضغط على زر. وهذه الأطياف ، إذا تم تفسيرها بشكل صحيح ، تسفر عن قدر كبير من المعلومات الهيكلية. على سبيل المثال ، يمكن بسهولة تحديد البنية الكيميائية لمركب 2-فينيل إيثانول من طيف 1H NMR وحده.
و للطرق الطيفية العديد من المزايا، فهي عادة ما تتطلب فقط لعينة صغيرة جدًا من المواد ، ويمكن استعادتها بالغالب إذا لزم الأمر. كما أن الأساليب الطيفية سريعة وتتطلب أحيانًا بضع دقائق فقط. وعادة ما نحصل على معلومات التركيب و البنبة الكيميائبة أكثر تفصيلا عن طريق التحليل الطيفي من الأساليب المختبرية العادية. و في هذا الفصل ، سنصف بعض التقنيات الطيفية الأكثر أهمية المستخدمة اليوم وكيف يمكن تطبيقها على حل المسائل التي تتعلق بالتنركيب و البنية الكيميائية. ولكن أولاً ، دعونا نتفحص بعض المبادئ العامة التي تشكل أساس معظم هذه التقنيات.
2 – مبادئ المطيافية (القياس الطيفي) Principles of Spectroscopy
توضح العلاقة 12-2 العلاقة بين طاقة الضوء E (أو أي شكل آخر من أشكال الإشعاع) و التردد الخاص به ν (باليونانية نو، و تلفظ نيو)
و توضح العلاقة العلاقة المباشرة بين تردد الضوء و الطاقة الخاصة به، فكلما كان التردد عاليا كانت الطاقة عالية. أما ثابت التناسب بين التردد و اكاقة فإنه يعرف باسم ثابت بلانك h ، و بسبب كون ترد الضوء و طوله الموجي يتناسبان تناسبا عكسيا، فإنه يمكن إعادة كتابة العلاقة الستبقة لتصبح كما يأتي:
حيث λ (باليونانية لامبدا) هي الطول الموجي للضوء و c هي سرعة الضوء . و بهذا الشكل تخبرنا العلاقة أنه كلما كان الطول الموجي للضوء أقل، كلما كانا الطاقة أعلى.
و يمكن للجزئيات أن توجد عند عدة أطوال موجية مختلفة، فمثلا يمكن للروابط في جزيء ما أن تُمدّد أو تنحني أو حتى تُدوَّر، كما يمكن للإلكترونات أن تنتقل من مستوى إلى آخر و هكذا، كما أن جميع العمليات السابقة يمكن أن تكمم، أي أن الروابط يمكن لها أن تُمدد أو تنحني أو تُدوَّر ضمن ترددات معينة (أو طاقات فكلاهما يتناسبان مع بعضهما البعض) ، كما يمكن للإلكترونات أن تنتقل بين الأفلاك و التي يكون بينها فرق محدد جيدا من الطاقة. وهذه الفروقات في الطاقة (أو التردد) هي التي نقيسها بأنواع مختلفة من الأطياف.
إن الفكرة وراء معظم أشكال التحليل الطيفي بسيطة للغاية ويتم التعبير عنها بشكل تخطيطي في الشكل أعلاه. فعندما يتم تعريض جزيء للإشعاع عند مستوى طاقة معين، E1 و يمر الإشعاع عبر الجزيء إلى كاشف مباشرة دون ان يمتص الجزيء الإشعاع، فإن كمية الإشعاع المكتشفة (التي يقرؤها الكاشف) ستكون مساوية لكمية الإشعاع المنبعثة من المصدر (الجزء العلوي من الشكل). و لكن ضمن ترددات معينة حيث تتوافق مع الفارق بين المستويين E1 و E2 ، فإن الإشعاع سوف يمتص من قبل الجزيء و بالتالي لن يظهر عند الكاشف (الجزء السفلي من الشكل أعلاه).
و عليه فإن الطيف الناتج يكون قراءة أو مخططا لكمية الطاقة (الإشعاع) التي يتلقاها الكاشف حيث تتنوع طاقة الإدخال تدريجياً.
تتطلب بعض الانتقالات طاقة أكثر من غيرها ، لذلك يجب علينا استخدام إشعاع ذو تردد مناسب لتحديدها. في هذا الفصل ، سنناقش ثلاثة أنواع من التحليل الطيفي التي تعتمد على مثل هذه الانتقالات. وهي الرنين النووي المغناطيسي (NMR) ، والأشعة تحت الحمراء (IR) ، والأشعة فوق البنفسجية الطيفية (UV-vis). يلخص الجدول 12.1 مناطق الطيف الكهرومغناطيسي حيث يمكن ملاحظة الانتقالات لهذه الأنواع الثلاثة من التحليل الطيفي. سنبدأ مع التحليل الطيفي للرنين النووي المغناطيسي و انتقالات الغزل النووي ، والتي تتطلب كميات صغيرة للغاية من الطاقة.
3 – مطيافية الرنين النووي المغناطيسي
Nuclear Magnetic Resonance Spectroscopy
إن هذا النوع من التحليل الطيفي و الذي كان له التأثير الأكبر على تحديد التركيب و البنية الكيميائية للمركبات العضوية يعرف باسم التحليل الطيفي بالرنين النووي المغناطيسي (NMR). و هذه الأداة اصبحت متوفرة على النطاق التجاري في أواخر الخمسينيات ، ومنذ ذلك الحين ، أصبح التحليل الطيفي للرنين النووي المغناطيسي أداة لا غنى عنها للكيميائي العضوي. دعونا نلقي نظرة سريعة على النظرية التي تقوم عليها هذا النوع من التحليل ثم نرى ما هي المعلومات العملية التي يمكننا الحصول عليها من طيف الرنين النووي المغناطيسي.
إن بعض النوى تتصرف كما لو أنها تدور، ونظرًا لأن النوى مشحونة وأن الشحنة التي تدور تخلق مجالًا مغناطيسيًا ، فإن النوى هذه و التي تدور تتصرف مثل المغناطيس الصغير. فالنواة الأكثر أهمية لتحديد التركيب أو البنية للمركب العضوي هي 1H (الهيدروجين عادي) و 13C (نظير مستقر وغير مشع للكربون العادي). وعلى الرغم من وجود 12C و 16O في معظم المركبات العضوية ، إلا أنها لا تمتلك خاصية الدوران ولا تعطي أطياف الرنين النووي المغناطيسي.
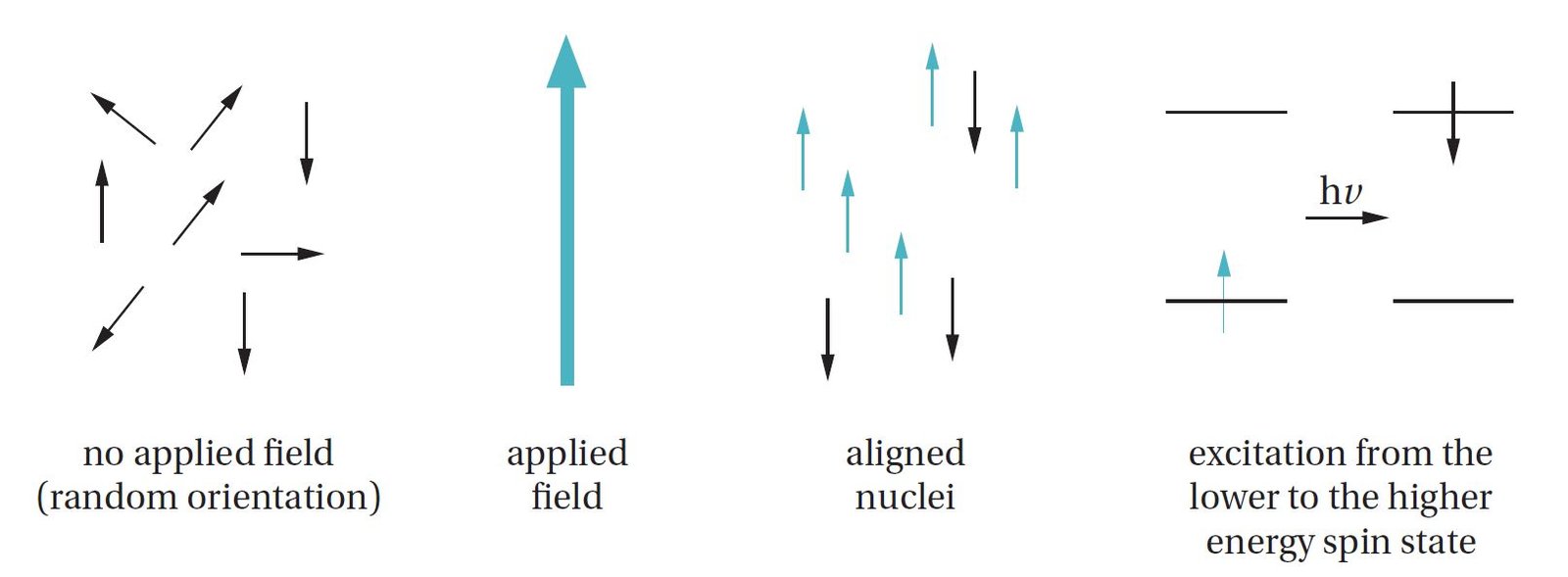
عندما توضع النوى ذات الدوران بين أقطاب المغناطيس القوي ، فإنها تقوم بتنظيم حقولها المغناطيسية مع أو ضد المجال المغناطيسي. فالنوى المحاذية للحقل المطبق تمتلك طاقة أقل قليلاً من الطاقة لتلك المعاكسة للحقل المطبق (أي أن النوي التي تدور باتجاه المجال المغناطيسي المطبق تكون ضمن مستوى أقل من تلك التي تدور عكس اتجاه المجال المغناطيسي المطبق و التي تكون ضمن مستوى طاقة أعلى) (الشكل 12.2). و من خلال تطبيق الطاقة في نطاق ترددات الراديو (rf) ،فإنه يمكن إثارة النوى في حالة دوران الطاقة المنخفضة إلى حالة دوران الطاقة الأعلى (نقول أحيانًا أن الدوران «يعكس»).
و تعتمد فجوة الطاقة بين حالتين الدوران (أي الدوران مع المحجال المغناطيسي المطبق أو عكسه) على قوة المجال المغناطيسي المطبق ؛ فكلما كان المجال المطبق أقوى ، كانت فجوة الطاقة أكبر (أي الفجوة بين مستويي الطاقة). تحتوي الرنين المغناطيسي الروتينية المستخدمة حاليًا على حقول مغناطيسية تتراوح من حوالي 1.4 إلى 14 تسلا (T) (بالمقارنة ، فإن المجال المغناطيسي للأرض لا يتجاوز 0.0007 تسلا). و عند مجالات مغناطيسية بهذه القوة، فإن فجوة الطاقة تعادل حسب تردد الراديو rf من 60 ميجاهيرتز إلى 600 ميجاهيرتز (ميجاهيرتز : 1 ميجا هيرتز= 610 هرتز أو 610 دورة في الثانية). و بترجمة تلك القيم إلى وحدات الطاقة اعتاد عليها الكيميائيون أكثر ، فإن فجوة الطاقة بين حالات الدوران هي فقط من 6-60× 10-6 كيلو كالوري / مول. وعلى الرغم من أن هذه الفجوة صغيرة للغاية ، إلا أن التكنولوجيا الحديثة تسمح باكتشافها بدقة عالية.
3-أ – قياس طيف NMR .
يمكن الحصول على طيف NMR-1H كما يأتي، حيث يتم تذويب العينة المراد دراستها (و التي يكون حجمها بضع ملي جرامات) في مذيب خامل لا يحتوي على أنوية 1H ، مثل رباعي كلوريد الكربون CCl4 أو في مذيبات تم فيها استبدال ذرات الهيدروجين بالديوتيريوم مثل ديوتيريوم الكلوروفورم CDCl3 و سداسي ديوتيريوم الأسيتون CD3C(=O)CD3 ، و أيضا كمية قليلة من مادة مرجعية سوف نتحدث عنها لاحقا. و من ثم يتم وضع العينة في أنبوب زجاجي رقيق و الذي بدوره يتم وضعه في قلب ملف انتاج ترددات الراديو و الذي يكون مواجها لقطبي مغناطيس قويين. و عند تشغيل الجهاز تصطف الأنوية بحيث جزء منها يكون باتجاه المجال المغناطيسي و الجزء الآخر يكون بعكس المجال المغناطيسي و من ثم يتم زيادة كمية الطاقة المطبقة على الأنوية من خلال التحكم بملف أنتاج موجات الراديو، و عندما تتساوي هذه الطاقة مع مقدار الطاقة الفارقة بين مستويي الدوران اتلمنخفض و العلوي، فإنها تمتص من قبل الأنوية ، و في هذه الحالة يقال بأن الأنوية تكون في حالة رنين مع مقدار طاقة الراديو المطبقة و من هنا جاء المصطلح الرنين النووي المغناطيسي.و يمكن التعبير عن مقدار الطاقة الممتصة من قبل العينة و مقدار التردد المطبق من قبل ملف تردد الراديو من خلال طيف NMR .
و عمليا هناك طريقتين يمكن من خلالهما تحديد تردد ات الرنين لأنوية 1H . فبسبب وجود علاقة تربط بين قوة المجال المغناطيسي المطبق و حجم فجوة الطاقة بين مستويا الطاقة للأنوية الدوارة التي تدور، فإنه إما ان يتم التحكم بقوة المجال المغناطيسي أو بقوة ترددات الراديو. ففي أجهزة NMR القديمة كان يتم تثبيت ترددات الراديو، بينما كان يتم التحكم بقوة المجال المغناطيسي المطبق و من هنا يتم الحصول على أنوية 1H رنينية عند قيم مختلفة من المجال المغناطيسي. أما في أجهزة مطيافية الرنين النووي المغناطيسي لانتقالات فورييه FT-NMR فإن المجال المغناطيسي هو الذي يبقى ثابتا بينما النبضات القصيرة لطاقة ترردات الراديو تتسبب لأن تؤثر على أنوية 1H بالتزامن حسب ترددات الراديو الرنينية الخاصة بها. و يستخدم كمبيوتر جهاز NMR عملية رياضية تسمى تحويل فورييه لفرز الإشارة التي يتم إنتاجها في الترددات الراديوية (rfs) لأنوية 1H المختلفة. و سواءً كان التحكم في شدة المجال المغنطيسي أو في ترددات الراديو، فإن هذا المتغير يزداد من اليسار إلى اليمين في الأطياف المسجلة. و قد تم الحصول على جميع أطياف الرنين المغناطيسي النووي 1H في هذا الكتاب ، ما لم يرد خلاف ذلك ، بواسطة تقنيات FT-NMR عند شدة مجال مغناطيسي 4.7 تسلا وتردد تشغيل قدره 200 MHz.
3- ب – الانزياح الكيميائي و مناطق القمم
ليست كل أنوية 1H تقلب (تعكس) دورانها عند ترددات الراديو نفسها بالضبط لأنها قد تختلف حسب البيئة الكيميائية المحيطة بها (وبشكل خاص ، البيئة الإلكترونية). عموما سنعود إلى هذه النقطة لاحقا ، ولكن أولاً، دعونا ندرس بعض المخططات الطيفية.
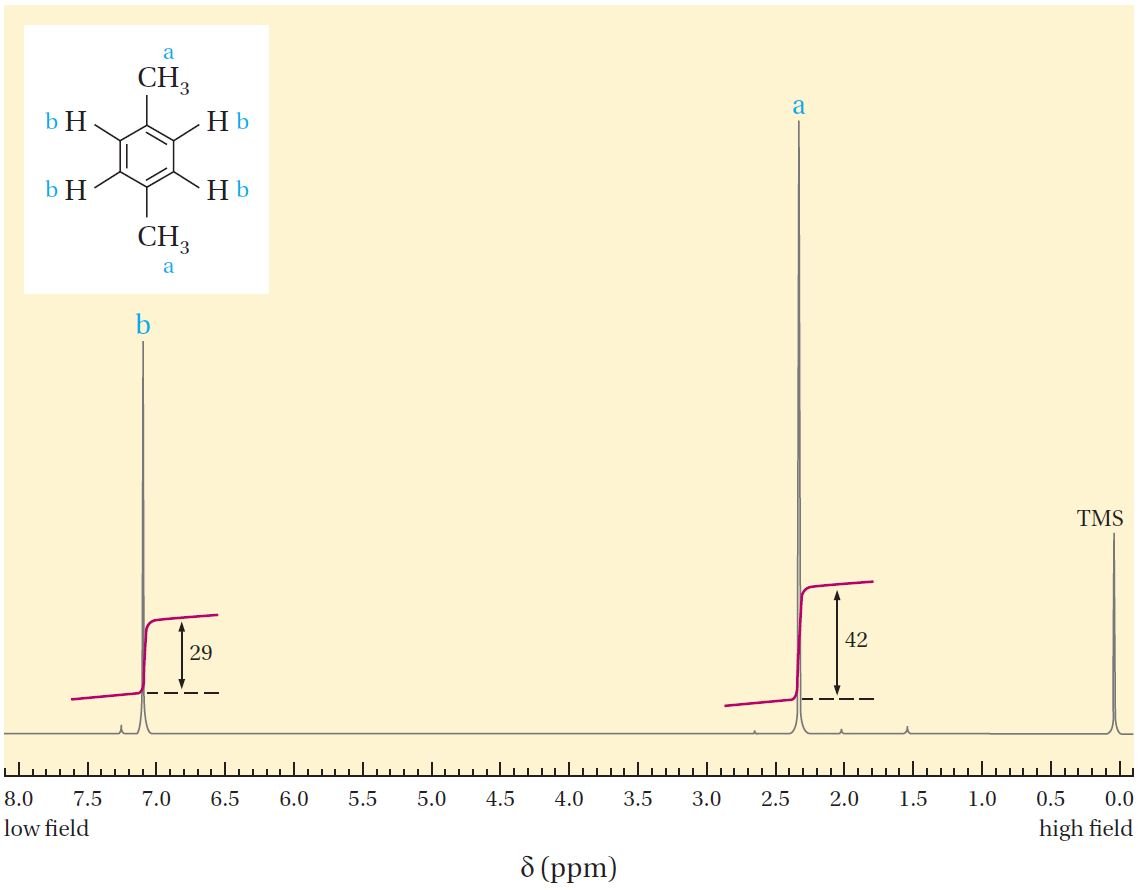
يوضح الشكل الآتي طيف الرنين النووي المغناطيسي 1HNMR لـمركب البارا-زايلين. فالطيف بسيط للغاية ويتألف من قمتين. ويتم قياس مواضع القمم بوحدات δ (دلتا) من ذروة مركب أو المادة المرجعية ، وهو رباعي ميثيل سيلان CH3)4Si) و يرمز له اختصارا TMS. و تعود أسباب اختيار TMS كمركب مرجعي هي أولا: جميع الـ ذرات الهيدروجين الإثنتي عشر متكافئة ، لذلك فهي تُظهر إشارة NMR حادة واحدة فقط ، والتي تعمل كنقطة مرجعية ؛ و ثانيا تظهر إشارات 1H الخاص بهذا المركب في مجال أعلى من معظم إشارات 1H للمركبات العضوية الأخرى ، مما يجعل من السهل تحديد ذروة TMS ؛ و ثالثا : أن مركب TMS خامل لذلك لا يتفاعل مع معظم المركبات العضوية ، و درجة غليانه منخفضة ويمكن إزالته بسهولة في نهاية القياس.
معظم المركبات العضوية لها قمم في الطرف البعيد downfield في مخطط طيف NMR مقارنة مع موقع قمة TMS وتعطى قيمًا للإنزياح الكيميائي δ موجبة. إن الإنزياح الكيميائي لنوع معين من إشارة 1H هو قيمة δ الخاصة به بالنسبة إلى TMS. و يطلق مصطلح الانزياح كيميائي لأنه يعتمد على البيئة الكيميائية للهيدروجين. كما أن الانزياح الكيميائي مستقل عن الأداة التي يتم قياسها عليها.
في طيف البارا-زايلين ، نرى قمة (إشارة) عند قيمة دلتا تساوي δ 2.30 و قمة أخرى عند δ تساوي 7.10 ، و يبدو من المعقول أن هذه القمم تنتج عن نوعين مختلفين من أنوية 1H في الجزيء: هيدروجينات الميثيل و هيدروجينات الحلقة العطرية. و لكن كيف يمكننا أن نحدد أي منهما من خلال دراسة المخطط؟
أحد الطرق المستخدمة لتحديد ذرات الهيدروجين في المخطط هو دراسة المنطقة التي يغطيها كل قمة أو إشارة، حيث تتناسب منطقة القمة بشكل مباشر مع عدد أنوية 1H التي تعمل على تشكيل كل قمة. فجميع أجهزة طيف الرنين المغناطيسي النووي التجارية مجهز بوحدات تكامل إلكترونية يمكنها طباعة خط تكاملي على القمم (الشكل 12.3). و هذا الخط يظهر نسب ذرات الهيدروجين ، فمثلا في مخطط البارا-زايلين نجد أن مناطق القمم عند δ = 2.30 و δ = 7.10 تعطي نسبة 3: 2 (أو 6: 4). و هذه القيمة تسمح لنا بتحديد أن عند δ = 2.30 يوجد ستة هيدروجينات تابعة لمجموعتي الميثيل و القمة عند δ = 7.10 هي لذرات هيدرجين الأربعة للحلقة العطرية.
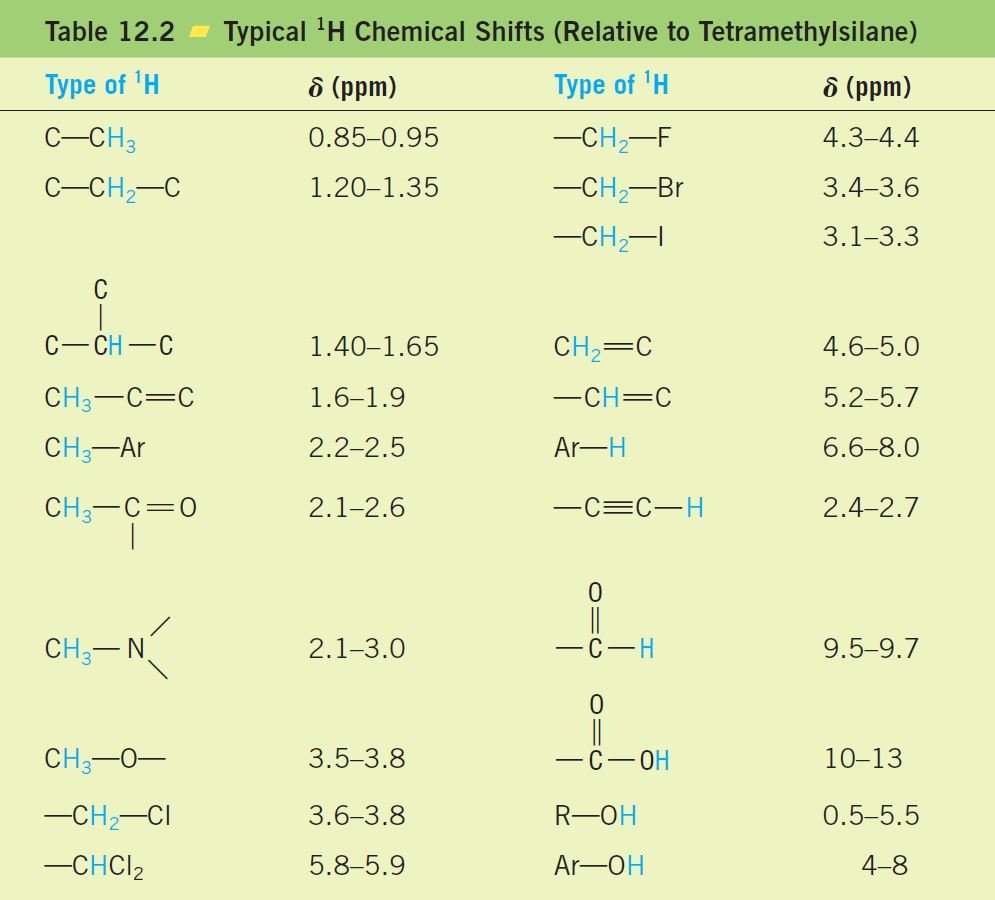
و هناك طريقة أخرى أكثر شيوعا للتعرف على القمم أو الإشارات في المخطط وهي مقارنة قيم الانزياحات الكيميائية مع أخرى معروفة مسبقا لمركب مرجعي. على سبيل المثال ، البنزين الذي يمتلك ستة ذرات هيدروجين متكافئة يظهر إشارة واحدة في طيق NMR عند قيمة δ تساوي 7.24. و كذلك الحال بالنسبة للمركبات العطرية الأخرى و التي تظهر انزياح كيميائي δ عند 7. و بالمثل تظهر قيم أغلب هيدروجينات CH3-Ar عند δ تساوي 2.2 إلى δ تساوي 2.5 . تم تعيين الانزياحات الكيميائية لأنوية 1H في بيئات كيميائية مختلفة عن طريق قياس أطياف 1HNMR لعدد كبير من المركبات ذات البنية أو التركيب الكيميائي المعروفة. يعطي الجدول 12.2 التحولات الكيميائية لعدة أنواع شائعة من نوى 1H.
دعنا الآن نعود إلى النقطة التي نوهنا عنها في بداية هذا الشرح ، ما هي العوامل التي تؤثر على الانزياحات الكيميائية؟. إن أحد أحد أهم العوامل هو الكهروسالبية للمجموعات التي تكون قريبة مباشرة من أنوية 1H، حيث تتسبب مجموعات السحب الإلكتروني عمومًا في حدوث إنزياح كيميائي للجهة البعيدة من إشارة TMS. قارن ، على سبيل المثال ، الإنزياحات الكيميائية التالية من الجدول 12.2:
في العادة ، تعمل الإلكترونات المتحركة بالقرب من نواة 1H على تكوين مجالًا مغناطيسيًا صغيرًا و التي تميل إلى حماية النواة من الحقل المغناطيسي المطبق خارجيًا. أما في حالة وجود الكلور و هو عبارة عن مجموعة تسحب الإلكترونات، فإن سحب الكثافة الإلكترونية بواسطة الكلور يعمل على «إزالة» الغلاف الإلكترني الحامي للنواة ، مما يسمح لها بقلب دورانه عند مجال خارجي مطبق أقل أو تردد أقل.و بالطبع كلما زاد عدد ذرات الكلور، كلما كان التأثير أكبر.
وهناك عامل آخر يؤثر على الإنزياح الكيميائي هو وجود إلكترونات باي. فذرات الهيدروجين المرتبطة بذرة كربون تكون جزءا من رابطة ثنائية أو ثلاثية أو حلقة عطرية بالعادة تظهر إشارات أو قمما في الجهة البعيدة من إشارة TMS .
3 – ج تقسيم splitting الإشارات (القمم)
تعطي العديد من المركبات أطيافا تظهر قممًا أكثر تعقيدًا من مجرد قمم مفردة (أحادية) لكل نوع من الهيدروجين. دعنا نتفحص بعض أطياف هذا النوع لنرى ما هي المعلومات الهيكلية الإضافية التي تفسرها.
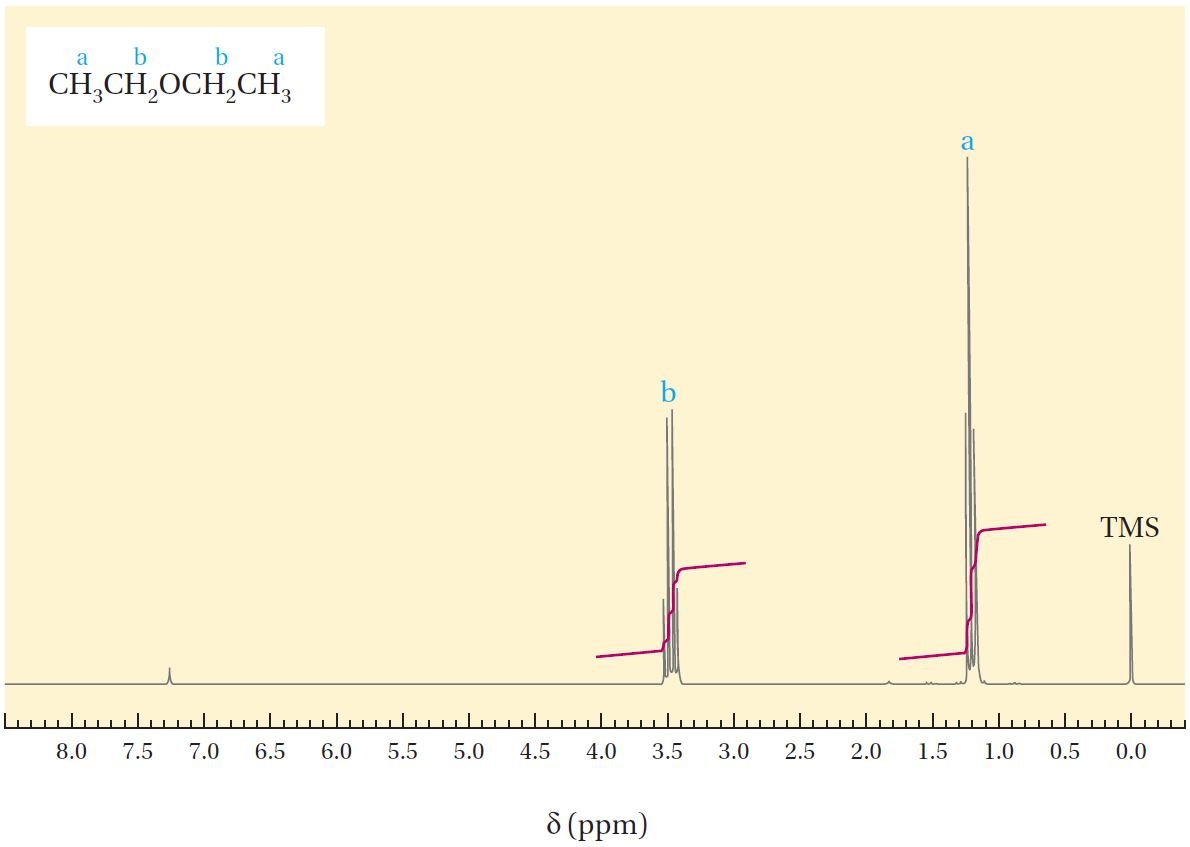
يوضح الشكل 12.4 طيف الرنين المغناطيسي النووي لمركب ثنائي إيثيل إيثر ، CH3CH2OCH2CH3. ومن المعلومات الواردة في الجدول 12.2 ، ربما كنا نتوقع أن يتكون طيف NMR لثنائي إيثيل إيثر من إشارتين: واحد في المنطقة δ تساوي 0.9 لذرات الهيدروجين الستة لمجموعتي CH3 و إشارة أخرى عند حوالي δ تساوي 3.5 لهيدروجينات مجموعتي CH2 الملاصقة لذرة الأكسجين ،حيث تغطي تلك الإشارات مساحة ما نسبته 6:4 .
في الواقع ، في الشكل أعلاه، نرى امتصاصا في كل من هذه المناطق و الذي يغطي نسبة المساحة الإجمالية المتوقعة. لكننا لا نرى إشارات مفردة ! ولكن بدلاً من ذلك ، يتم تقسيم إشارة الميثيل إلى ثلاث قمم ثلاثية triplet وتنقسم إشارة الميثيلين إلى أربعة قمم رباعية quartet ، حيث تُخبرنا هذه الانقسامات للإشارات (القمم) إلى حد ما عن التركيب الجزيئي و الذي يمكن تفسيره كما يلي:
نحن نعلم أن كل نواة هيدروجين 1H في الجزيء تعمل كمغناطيس صغير. و عندما نشغل مطياف الرنين النووي المغناطيسي فإن كل ذرة هيدروجين «لا تشعر» بالمجال المغنطيسي الكبير المطبق عليها فحسب بل أيضًا تشعر بمجال مغناطيسي صغير بسبب وجود ذرة هيدروجين أخرى المجاور لها. وعندما نثير أنوية الهيدروجين 1H التي على ذرة كربون واحد ، فإن الأنوية 1H التي تكون على ذرات الكربون المجاورة يمكن أن تكون إما في حالة الدوران الأدنى أو الأعلى للطاقة مع احتمالات بوجودها بالتساوي لذا فإن فإن الإشارة التي كان سببها المجال المغناطيسي القوي سوف تتار أيضا بالمجال المغناطيسي الناتج عن ذرات الهيدروجين المجاورة.
و يمن لنا ان نتوقع عدد انقسامات أو تشعبات الإشارة أو القمة بتطبيق قاعدة n+1 . فمثلا لوكانت هناك نواة هيدروجين 1H محاطة بعدد n من أنوية الهيدروجين المجاورة 1H فإن عدد التشعبات في إشارة نواة الهيدروجين تساوي n+1 . ففي مركب ثنائي إيثيل إيثر نلاحظ أن هدروجينات المجموعة CH3 لديها ذرتي هيدروجين مجاورة لها (التي على مجموعة CH2) لذلك نلاحظ أن الإشارة لذرات هيدروجين CH3 تتشعب و يصبح لها ثلاثة قمم (2+1 =3) ، و في نفس الوقت نلاحظ أن هيدروجينات المجموعة CH2 سوف يكون لها قمة متشعبة إلى أربعة قمم.
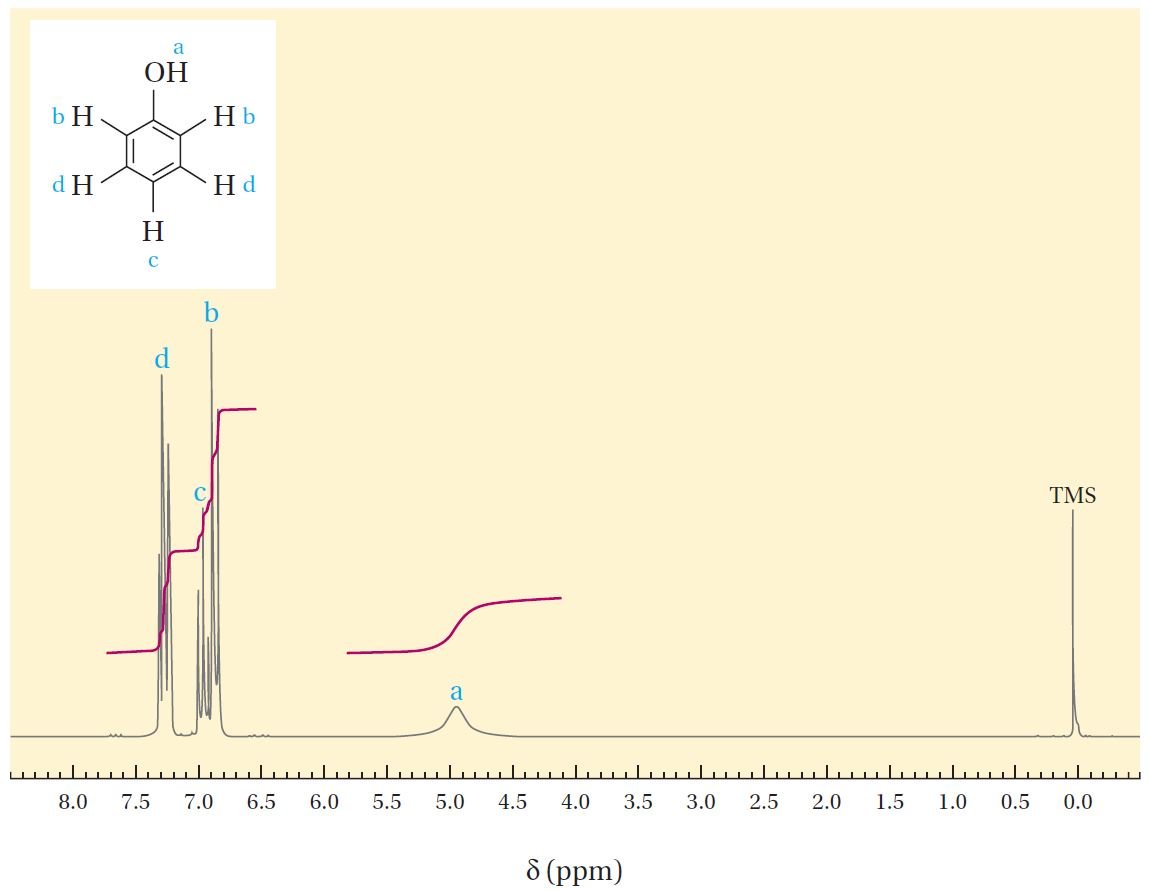
و مثال آخر على تقسيم إشارة NMR يظهر في مركب الفينول في الشكل ادناه
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
2 thoughts on “التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR”
Leave a Reply Cancel reply
This site uses Akismet to reduce spam. Learn how your comment data is processed.






لكم كل الشكر والتقدير على هذا المجهود الرائع والمتميز في الطرح ، شرح واضح جدا ومفهوم
شكرا جزيلا لكم اخي محمد … بكلماتكم الرقيقة و المشجعة تدفعني للعمل ليلا و نهارا لتحسين الموقع و دعمه بالكثير من المواضيع