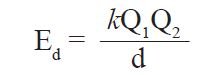مقدمة في الديناميكا الحرارية Thermodynamics
مصطلحات هامة في الديناميكا الحرارية
يعرف العلم الذي يدرس الطاقـة و تحولاتها باسم الديناميكا الحرارية ، و يعرف الفرع من الديناميكا الحرارية الذي يدرس العلاقة ما بين التفاعلات الكيميائية و تغيرات الطاقـة التي تتطلب حرارة باسم الكيمياء الحرارية.
و تعرف الطاقـة بأنها القدرة على القيام بشغل أو نقل حرارة . فالشغل هو مقدار الطاقـة المبذولة لتحريك جسم ما و له كتلة ضد القوة ، أما الحرارة فهي مقدار الطاقـة المستخدمة لرفع درجرة حرارة جيسم ما.
الطاقـة الحركية:
هي نوع من الطاقـة التي يملكها الجسم بسبب حركته. هي تُساوي الشغل وتتناسب الطاقـة الحركية لجسم ما طرديا مع كتلته ومربع سرعته .
و هناك نوعان من الطاقـة الحركية : الطاقـة الحركية الخطية والطاقـة الحركية الدورانية. فالطاقـة الحركية الخطية تتولد عندما ينتقل الجسم قاطعا مسافة وتعتمد على سرعة الجسم بينما تعتمد الطاقـة الحركية الدورانية على السرعة الزاوية للجسم وهي لا ترتبط فقط بكتلة الجسم وإنما بتوزيع هذه الكتلة أيضا وفي بعض الأحيان يمتلك الجسم طاقـة حركية خطية ودورانية في الوقت نفسه .
ويمكن للطاقـة التحول من صورة لأخرى : فراكب الدراجة، تتحول في جسمه الطاقـة الكيميائية المتولدة عن حرق المواد الغذائية التي حصل عليه بالأكل، تتحول إلى طاقـة حركة، فهو يبذل شغلا وبذلك يتحرك بعجلته. لأن الطاقـة الكيميائية تحولت إلى طاقـة حركة. ولكن الطاقـة الكيميائية لم تتحول بكاملها في هذا المثال إلى طاقـة حركة، إذ أن جزءا منها تحول إلى طاقـة حرارية في جسمه . و يعبر عن الطاقـة الحركية بالقانون التالي:
Ek = ½ mv2
حيث Ek الطاقـة الحركية ، و m كتلة الجسم ، و v سرعة الجسم.
طاقة الوضع :
تعرف طاقـة الوضع بأنها الطاقـة المخزنة بالجسم نتيجة شغل مبذول عليه ، فمثلا لو رفعنا كرة إلى أعلى فإننا بهذه الحالة نكسب الكرة طاقـة وضع و عند سقطة الكرة لأسفل فإن طاقـة الوضع للكرة تقل تدريجيا و تزداد طاقة حركة الكرة. و يمكن التعبير عن طاقة الوضع رياضيا بالعلاقة التالية:
Ep = mgh
حيث Ep طاقـة الوضع ، و m كتلة الجسم ، و h ارتفاع الجسم عن نقطة معينة بالنسبة لسطح الأرض ، و g ثابت الجاذبية الأرضية و يساوي 9.8 م/ث2.
طاقـة الوضع الكهروستاتيكية:
تعتبر أهم شكل من أشكال طاقـة الوضع في الكيمياء و التي تنشأ بسبب التجاذبات بين الدقائق المشحونة بشحنات مختلفة و هي تناسب مع كمية الشحنة الموجودة عليها و تتناسب عكسيا مع المسافة الفاصلة بينها. و عليه يمكن النعبير عن طاقـة الوضع الكعهروستاتيكية رياضيا بالعلاقة التالية
حيث Ed طاقـة الوضع الكهروستاتيكية ، و Q1 الدقيقة(الجسيم) الأول ، و Q2 الدقيقة(الجسيم) الثاني ، و d المسافة الفاصلة بين الدقيقتين أو الجُسيمين ، و k ثابت كولوم و يساوي 8.99×910 ج-م/ك2.
فإذا كان الجسيمين بشحنات متشابهة فكل واحد منها يدفع الآخر بعيدا عنه و بالتالي تكون مقدار الطاقـة الكهروستاتيكية بالموجب ، و أذا كان الجسيمين بشحنات مختلفة فكل واحد منها يجذب الآخر قريبا منه و بالتالي تكون مقدار الطاقـة الكهروستاتيكية بالسالب.
و عليه كلما كانت طاقـة النظام أقل ، كأن النظام أكثر استقرارا.
وحدات التعبير عن الطاقـة:
الوحدة الدولية للتعبير عن الطاقـة هي الجول J . فالجول الواحد يساوي:
1 J = 1 kg-m2/s2
كما أنه لازالت تستخدم وحدة قديمة للطاقـة على نطاق واسع على الرغم من أنها لا تتبع نـظام الوحدات الدولية و هي الكالوري ، حيث :
1 cal = 4.184 J
و بالأصل تم تعريف الكالوري بأنها مقدار الطاقـة اللازمة لرفع درجة حرارة جرام واحد من الماء درجة حرارة واحدة من 14.5 إلى 15.5 سيليزية. و لكن حاليا تم تعريف الكالوري بالنسبة إلى الجول.
النظام و الوسط المحيط بالنظام
لنفهم بعض المصطلحات الهامة في الديناميكا الحرارية ، ،لندرس المثال المبين في الشكل الجانبي حيث تفاعل الهيدروجين مع الأكسجين لتكون الماء. فالنـظام هو ذلك الجزء من الكون الذي نركز إهتمامنا عليه ، و هنا 
إذا حصل تغيير بحيث أن الحرارة لا يمكن نقلها عبر السطح البيني أو الحدود الفاصلة بين النـظام و الوسط المحيط به فإننا نصف ذلك بقولنا بأنها عملية أدياباتية . و عندما نحافظ على الإتصال الحراري بين نـظام ما و الوسط المحيط به فإن الحرارة تنتقل بينهما ، و عادة تنتقل الحرارة بين النـظام و الوسط المحيط من خلال طريقتين و هما الشغل أو الحرارة، و تسمى الطاقـة المذولة لنقل جسم لمسافة معينة باسم الشغل ، و يعبر عنها رياضيا بالعلاقة التالية :
w = F × d
حيث w الشغل و F القوى و d المسافة التي يقطعها الجسم نتيجة تأثير القوى عليه .
أما الحرارة فإنها ممكن أن تنتقل من الجسم الساخن إلى الجسم البارد ، و عليه فإن الحرارة صورة من صور الطاقة تنقل بين النـظام و الوسط المحيط بسب الاختلاف في درجات الحرارة بينهما.
و من الممكن أن نحفظ النـظام في درجة حرارة معينة أثناء حدوث تغييرو يسمى التغيير في هذه الحالة أيسوثيرمي . و عندما يحافظ النـظام على ضغط ثابت يقال بأنه في حالة أيسوبستية أو أيسوبارية .
أما حالة النـظام فهي مجموعة معينة من الظروف المتعلقة بالضغط و درجة الحرارة و عدد مولات كل من المكونات و الشكل الفيزيائي لكل منها ( على سبيل المثال غاز أو سائل صلب أو بلوري ) .
و تعرف كميات الضغط و الحجم و الحرارة بدالات الحالة أو متغيرات الحالة . و قد سميت بذلك لأنها تساهم في تحديد الحالة الفيزيائية لنـظام معين و هي تعتمد على الحالة الحالية للمادة و لا تعتمد على أي حالة أخرى في السابق .
أما السعة الحرارية فإنها تعرف بأنها كمية الطاقة الحرارية اللازمة لرفع درجة حرارة كمية معينة من مادة درجة مئوية واحدة . و تعرف الحرارة النوعية بإنها كمية الحرارة اللازمة لرفع درجة حرارة جرام واحد من مادة بمقدار درجة مئوية واحدة . و كذلك تعرف السعة الحرارية المولارية بأنها الحرارة اللازمة لرفع درجة حرارة مول واحد من مادة بمقدار درجة مئوية واحدة .
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :