إلكترون electron
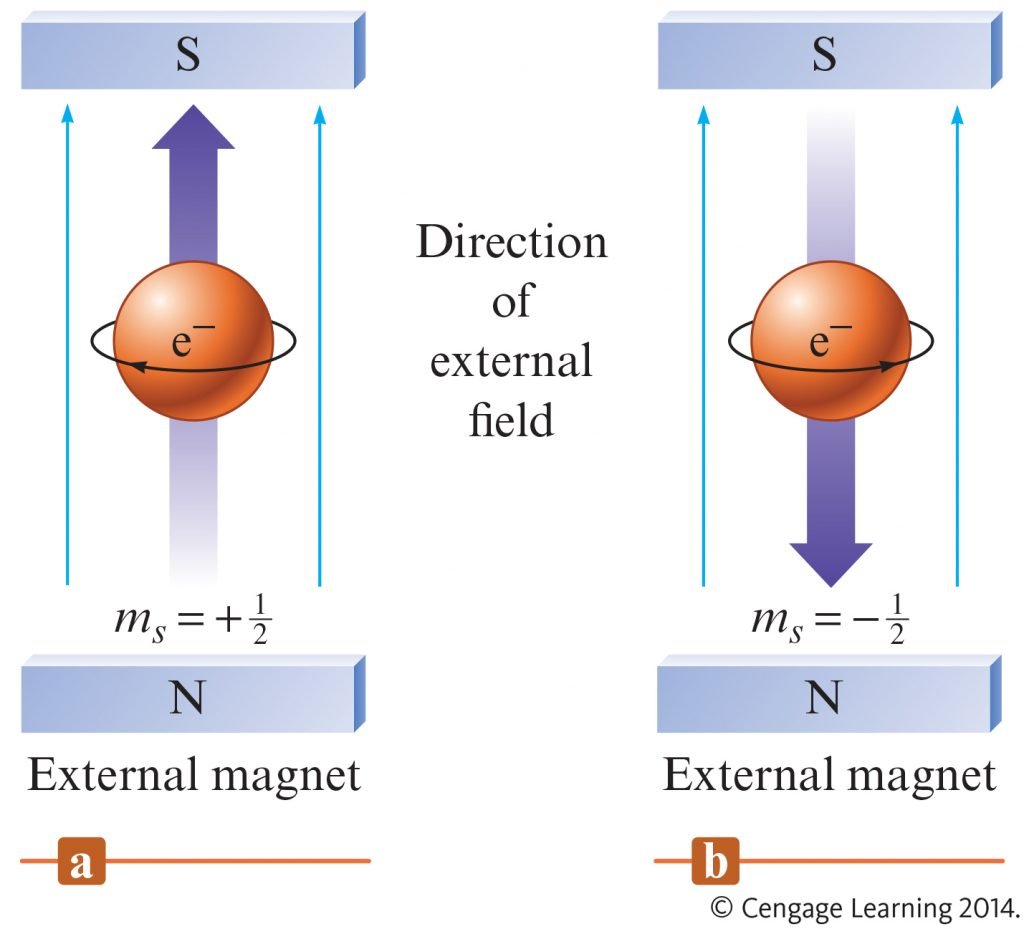
أخف جسيم دون الذرة مستقرة معروفة حتى الآن ، و هو يحمل شحنة سالبة و التي تعتبر الشحنة الاساسية للكهرباء . كتلــــة الألكتــرون 9.1×10-28 جـــرام وهــي تساوي 0.0005 من كتــلة البروتون و شحنتــه تساوي 1.602192 × 10-19 كولوم . و للإلكتـرون شريك يحمل نفس شحنته و نفس حركته المغزلية و لكنه يحمل شحنة موجبة يعرف باسم البوزترون .
البوزترونات نادرة الوجود في الارض حيت يتطلب طاقة عالية لانتاجها و هي توجد لفترات قصيرة جدا بسبب ابادتها عن طريق الالكتـرونات الموجودة في كل مكان .
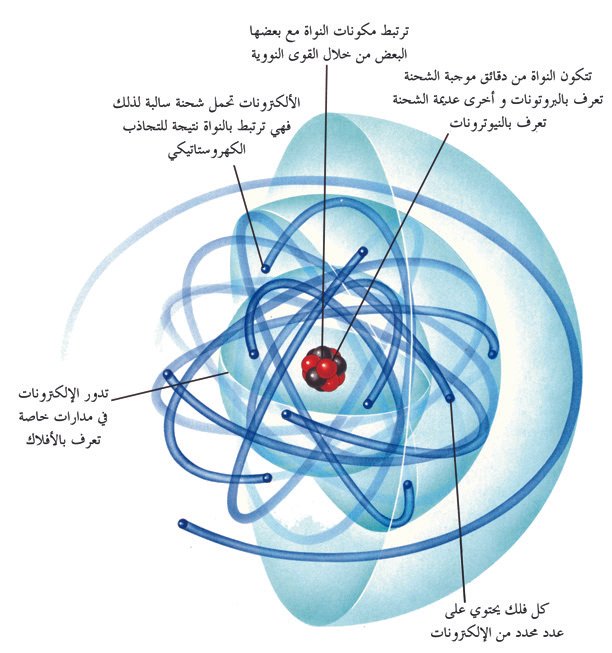
الالكتـرون من اول مكونات الذرة التي تم اكتشافها ، فقد اكتشف الإلكتـرون عام 1897 من قبل الفيزيائي البريطاني ثومسون عند دراسته لأشعة الكاثود ، و اكتشافه للإلكترون ساعد كثيرا في وضع تصور لتركيب الذرة لاحقا . تحت الظروف الطبيعية تكون الالكتـرونات مرتبطة مع نواة الذرة الموجبة نتيجة للتجاذب الناتج عن الشحنات المختلفة ، و في الذرة المتعادلة يكون عدد الالكترونات مساويا لعدد البروتونات الموجودة في نواة الذرة ، فالذرة التي يكون عدد الالكتـرونات فيها اكبر من عدد البروتونات تكون سالبة الشحنة أو ايون سالب ، أما إذا كان عدد البروتونات في الذرة اكبر من عدد الالكترونات فإن الذرة تكون موجبة الشحنة أو أيون موجب .
وتجدر الإشارة هنا بأنه ليس كل الالكتـرونات تكون مرتبطة بالذرات فهناك الكتـرونات تكون حرة جنا إلي جنب مع الايونات على شكل مادة تعرف باسم البلازما . و الإلكترونات تدور حول النواة في مدارات خاصة ، فالإلكترونات التي توجد في مدارات قريبة من النواة يكون ارتباطها بالذرة كبيرا بينما الإلكتـرونات التي تكون في مدارات بعيدة عن النواة يكون ارتباطها بالذرة ضعيفا و بالتالي يمكن ان تفقد لتكون ايونات سالبة الشحنة . و نتيجة لدوران الإلكترونات حول النواة فإنه يتشكل غيمة سالبة الشحنة تغطي اغلب حجم الذرة و انتقال الإلكترون من مدار اقل إلى مدار أعلى يعمل على إثارة الذرة و لكي تعود الذرة إلى مستواها الطبيعي فإن الإلكترون يعود إلى موضعه الطبيعي مما ينتج عن ذلك إشعاع للطاقة .
المصدر :
- الموسوعة العلمية الكيميائية للأستاذ أكرم العلي
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تجارب كيميائية سهلة و شيقة و ممتعة (10) Amazing Chemistry Experiments
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play و من بينها تطبيق ملصقات الجـدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصـر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة