الألدهيدات و الكيتونات Aldehydes and Ketones
Posted in :
ملاحظة هامة: هذا المقال عبارة عن مختصر للفصل التاسع من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
الألدهيدات و الكيتونات Aldehydes and Ketones
تتميز الألدهيدات و الكيتونات بوجود مجموعة الكربونيل.
- في الألدهيدات تتصل ذرة هيدروجين واحدة على الأقل بذرة الكربون الخاصة بمجموعة الكربونيل ، أما الطرف الآخر لمجموعة الكربونيل فمن الممكن أن تتصل بذرة هيدروجين أخرى أو أي مجموعة عضوية أليفاتية أو أروماتية.
- تسمى المجموعة المميزة للألدهيدات –CH=O– بمجموعة الفورميل.
- أما في الكيتونات فإن ذرة الكربون في مجموعة الكربونيل تكون متصلة بذرتي كربون أخرتين.
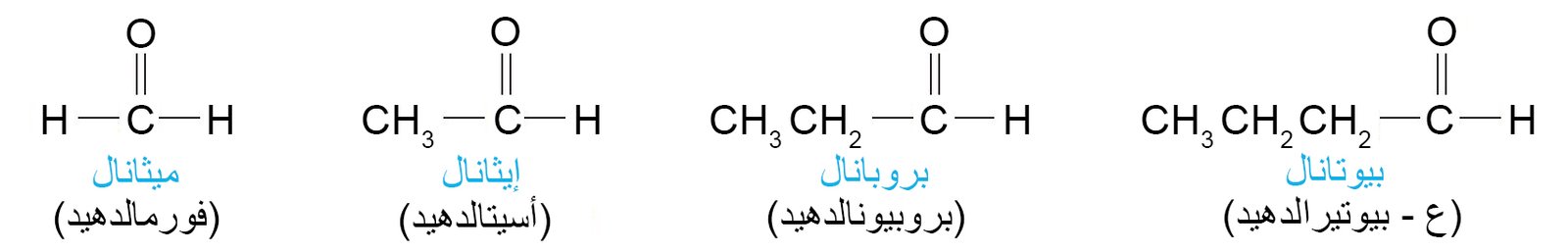
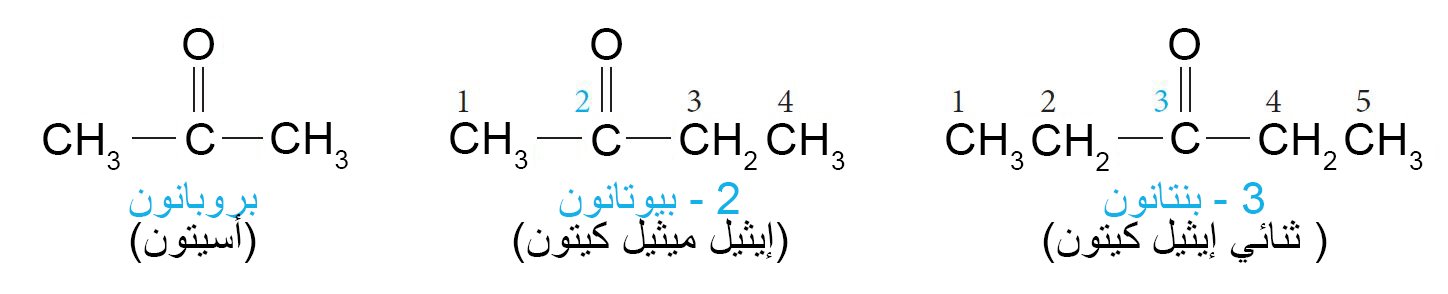
1 – تسمية الألدهيدات و الكيتونات Nomenclature of Aldehydes and Ketones
- حسب نظام الأيوباك تنتهي أسماء الألدهيدات باللاحقة -ال.
- حسب نظام الأيوباك تنتهي أسماء الكيتونات باللاحقة -ون.
2 – بعض الألدهيدات و الكيتونات الشائعة Some Common Aldehydes and Ketones.
- الفورمالدهيد (HCH=O) و يعتبر أبسط الألدهيدات و يحضر عن طريق أكسدة الميثانول.
- الأسيتون (CH3)2C=O)) و يعتبر أبسط كيتون و يحضر عن طري أكسدة البروبين ثم أكسدة الكحول الأيسوبروبيلي و يتبع ذلك أكسدة أيسوبروبيل البنزين.
- يمكن استخدام الأسيتون لصناعة المركبات الأخرى مثل بيسفينول-A لصناعة راتنجات الإيبوكسي.
- تشكل الكينونات فئة فريدة من مركبات الكربونيل ، فهي عبارة عن ثنائيات الكيتون متصلة مع بعضها البعض على شكل حلقة.
3 – تحضير الألدهيدات و الكيتونات Synthesis of Aldehydes and Ketones
- إن أكثر الطرق شيوعات لتحضير الألدهيدات و الكيتونات هي أكسدة الكحولات.
- ينتج عن أكسدة الكحولات الأولية الألدهيدات و ينتج عن أكسدة الكحولات الثانوية الكيتونات.
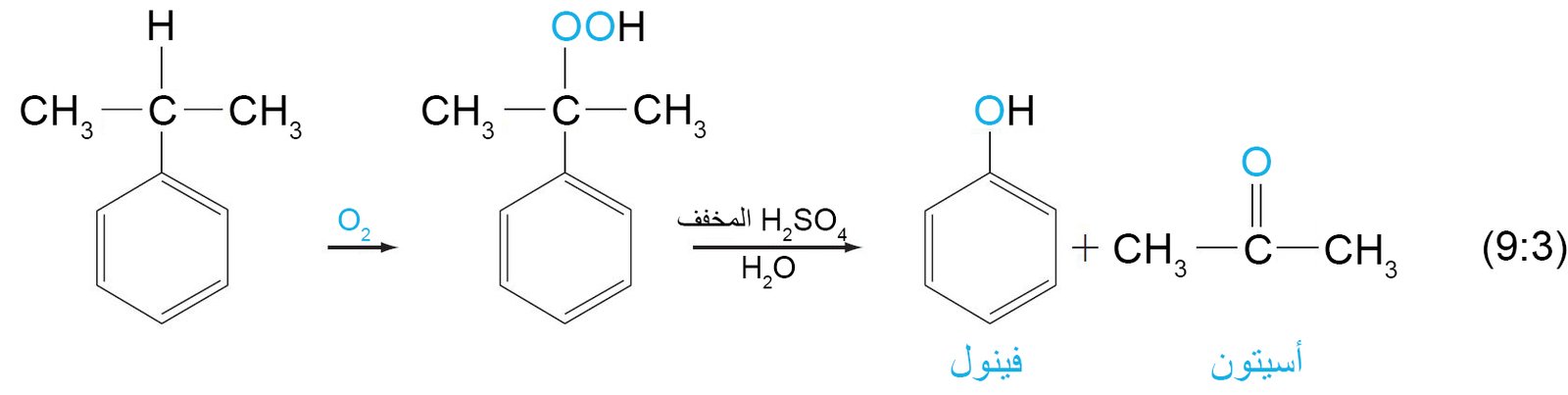
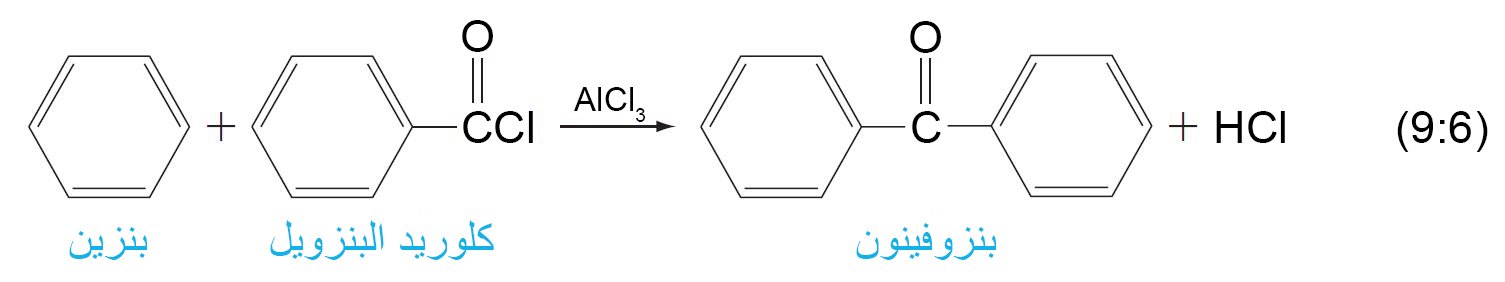
- يمكن تحضير الكيتونات العطرية عن طريق أسيلة فريدل-كرافت للحلقة العطرية.
- يمكن تحضير الكيتونات الميثيلية عن طريق تميؤ الألكاينات الطرفية (ألكياينات تكون فيها الرابطة الثلاثية متصلة بذرة الكربون الطرفية) بوجود حمض و أيون الزئبق كمواد حفازة.
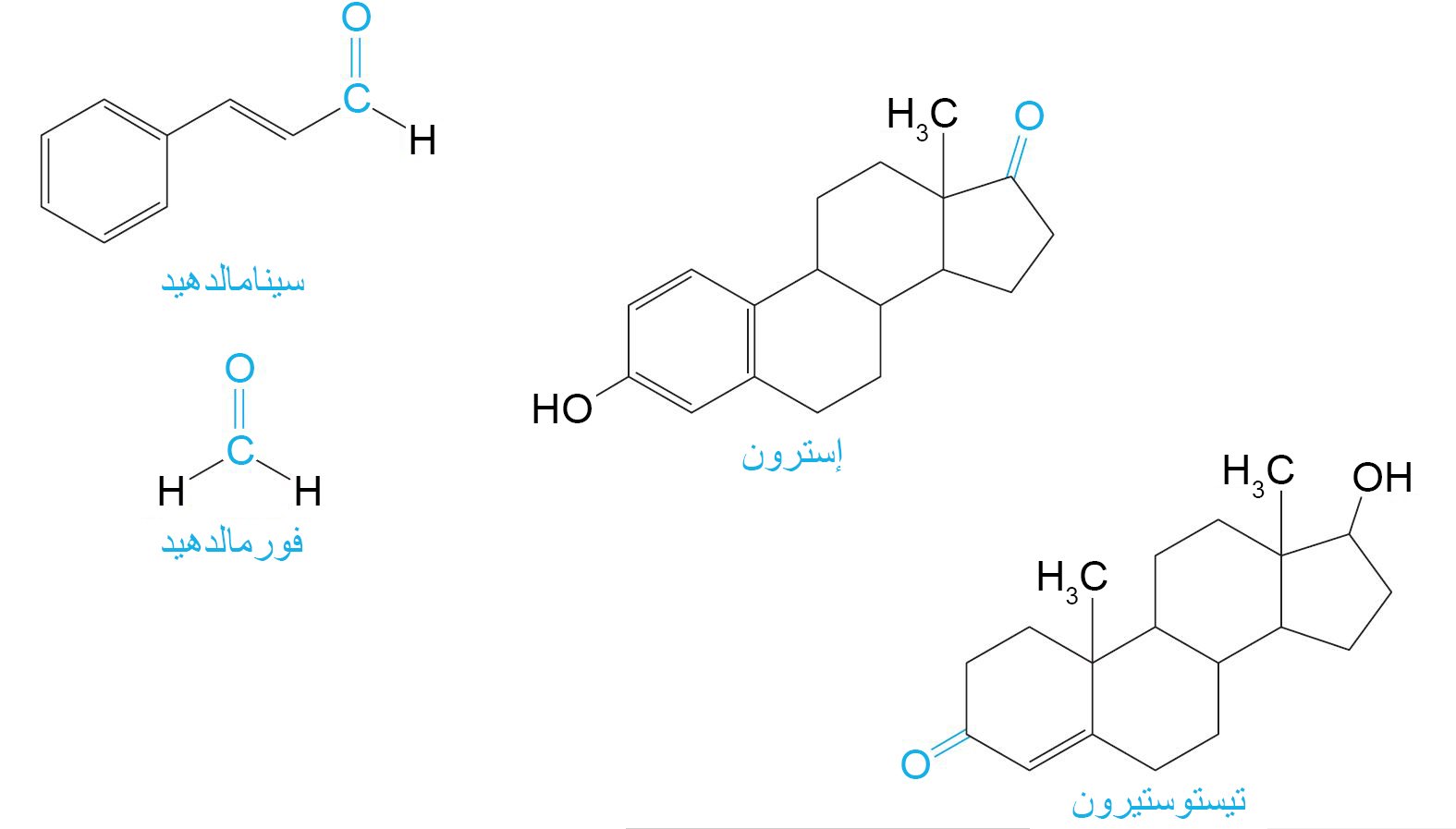
4 – الألدهيدات و الكيتونات في الطبيعة Aldehydes and Ketones in Nature
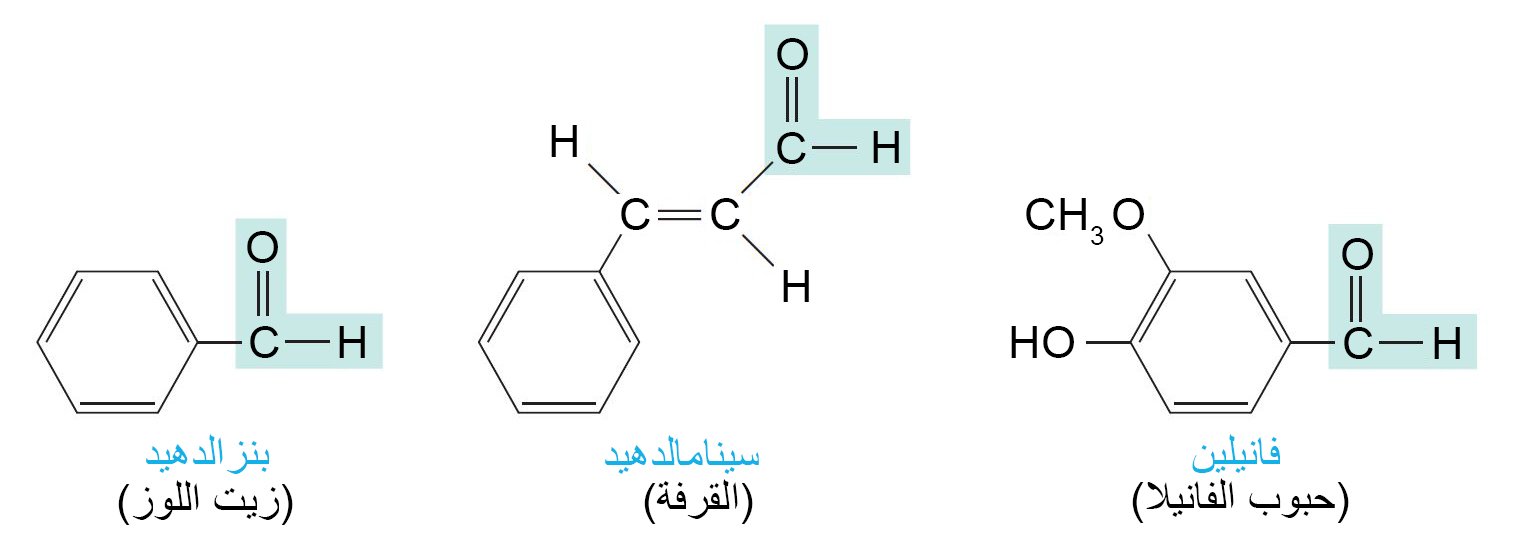
- توجد الألدهيدات والكيتونات على نطاق واسع جدا في الطبيعة.
- العديد من الألدهيدات والكيتونات لها روائح ونكهات لطيفة و بسبب هذه الخصائص فهي تستخدم في صناعة العطور والمنتجات الاستهلاكية الأخرى.
5 – مجموعة الكربونيل The Carbonyl Group
- تتكون الرابطة الثنائية بين الكربون – الأكسجين من رابطة سيجما و رابطة باي.
- التهجين الحاصل في ذرة الكربون من نوع sp2 . و عليه تكون الذرات الثلاث المتصلة بذرة الكربون الكربونيلية ضمن مستوى واحد و الزاوية بينها تكون 120 درجة.
- إن طول الرابطة C=O أقصر من طول الرابطة C-O الموجودة في الكحولات و الإيثرات.
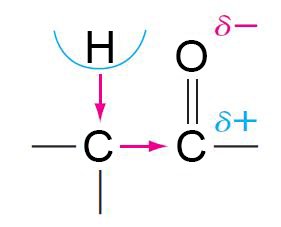
إن الأكسجين أكثر كهروسالبية من الكربون لذلك تكون الإلكترونات في الرابطة C=O منجذبو أكثر نحو ذرة الأكسجين و هذا يولد رابطة قطبيتها عالية.
- و كنتيجة لهذا الاستقطاب فإن أغلب تفاعلات اكربونيل تتطلب هجوم نيوكليوفيلي على ذرة الكربون الكربونيلية.
- تغلي مركبات الكربونيل عند درجات حرارة أعلى من تلك للهيدروكربونات المقابلة لها بالوزن الجزيئي لأن لمركبات الكربونيل رابطة قطبية C=O دائمة و التي تتسبب بحدوث تجاذبات ثنائي القطبية حيث الأقطاب المختلفة تجذب بعضها البعض بين الجزيئات القطبية.
- تغلي المركبات الكربونيلية عند درجات حرارة أدنى من تلك للكحولات المقابلة لها بالوزن الجزيئي لأن مركبات الكربونيل لا يمكن لها أن تكون روابط هيدروجينية بين بعضها البعض كما هو الحال مع الكحولات.
- مركبات الكربونيل ذات الوزن الجزيئي المنخفض قابلة للذوبان في الماء لأنه يمكنها أن تكون روابط هيدروجينية بين مركبات O-H و N-H .
6 – الإضافة النيوكليوفيلية إلى مجموعات الكربونيل: نظرة عامة
Nucleophilic Addition to Carbonyl Groups: An Overview
- تهاجم النيوكليوفيلات ذرة الكربون في رابطة الأكسجين-الكربون المزدوجة لأن ذرة الكربون تلك لها شحنة موجبة جزئية.
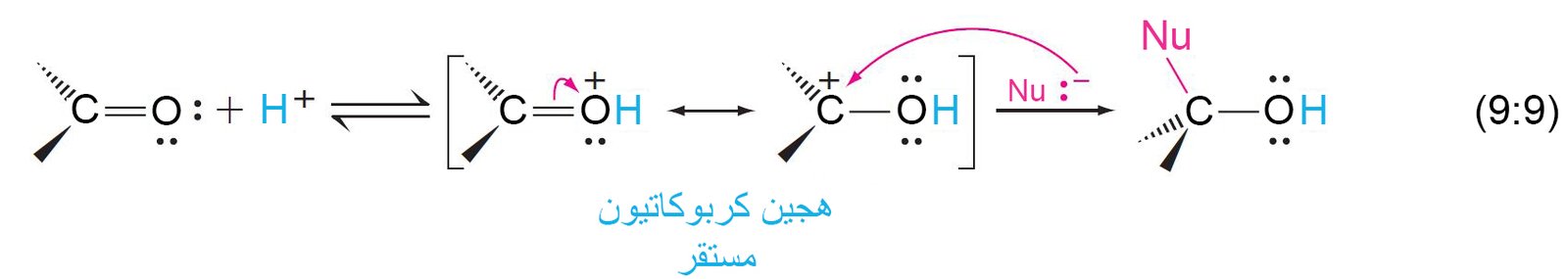
- مركبات الكربونيل هي قواعد لويس ضعيفة و بالتالي يمكن إضافة أيون الهيدروجين إليها بسهولة.
- يمكن للحموض أن تحفز من إضافة النيوكليوفيلات الضعيفة إلى المركبات الكروبنيلية عن طريق إضافة أيون الهيدروجين (البروتون) إلى ذرة الأكسجين في مجموعة الكربونيل.
- يمكن تصنيف النيوكليوفيلات حسب مسار الإضافة إلى مجموعة الكربونيل إلى نوعين عكوسة و لا عكوسة.
- النيوكلوفيلات التي تضافة بمسار عكوس تُعد مجموعات مغادرة جيدة و تعتبر أيضا قواعد مرافقة للحموض القوية نسبيا.
- أما النيوكليوفيلات التي تكون غير عكوسة فهي مجموعات مغادرة ضعيفة و هي قواعد مرافقة للحموض الضعيفة.
- عموما الكيتونات إلى حد ما أقل نشاطا من الألدهيدات بالنسبو للنيوكليوفيلات، و هذا الاختلاف في النشاط يرجع إلى سببين رئيسين و هما فراغي (شكل ترتيب الذرات في الفراغ) و إلكتروني.
7 – إضافة الكحولات: تكوين أنصاف الأسيتالات و الأسيتالات.
Addition of Alcohols: Formation of Hemiacetals and Acetals
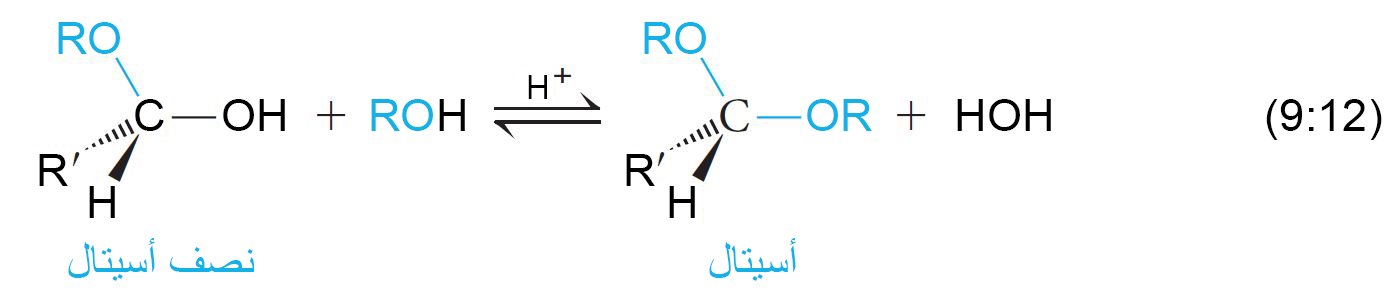
- الكحولات هي نيوكلوفيلات أكسجينية ضعيفة، فهي تضاف إلى الرابطة C=O بحيث ترتبط مجموعة OR بذرة الكربون و يرتبط البروتون (+H) بذرة الأكسجين الخاصة بمجموعة الكربونيل.
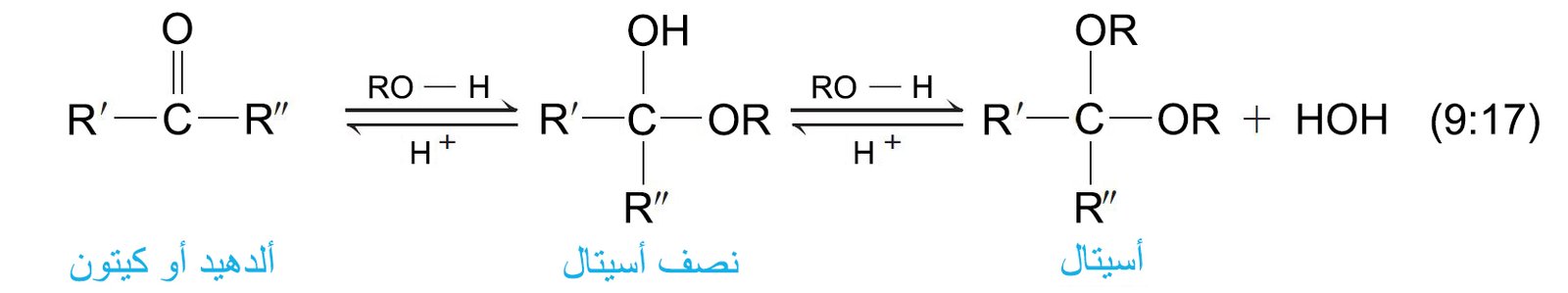
- لاتمام هذا التفاعل يتطلب الأمر إلى محفز ، و يكون الناتج نصف أسيتال ، و هو مركب يحتوي على مجموعة الكحول و مجموعة الإيثر متصلتان على نفس ذرة الكربون، كما أن تفاعل الاضافة أيضا يكون عكوس.
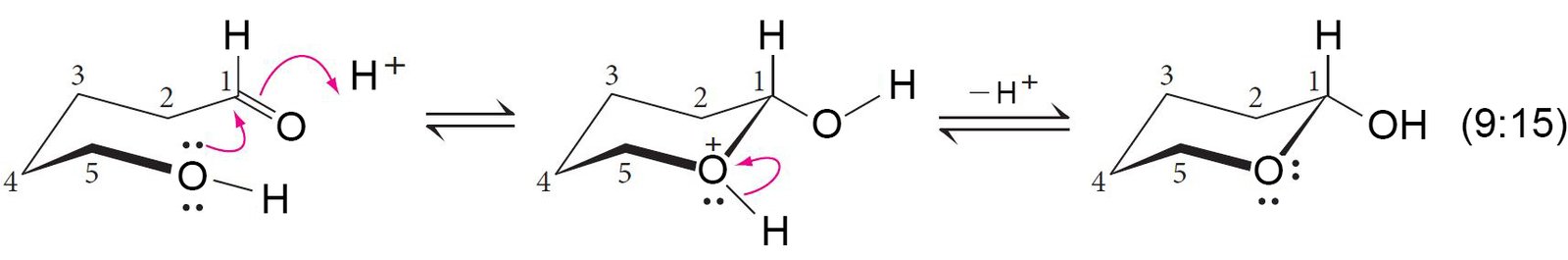
- تشمل ميكانيكية تكوين نصف الأسيتال ثلاث خطوات : الاولة إضافة أيون الهيدروجين (البرتنة) لأكسجين مجموعة الكربونيل بمساعدة محفز حمضي، و الخطوة الثانية مهاجمة أكسجين الكحول لذرة الكربون في مجموعة الكربونيل و الثالثة و الخطوة الأخيرة أزالة ذرة الهيدروجين المتصلة بذرة الأكسجين الموجبة.
- في وجود فائض من الكحول ، تتفاعل أنصاف الأسيتال أكثر و أكثر إلى أن ينتج عنها تشكل الأسيتالات.
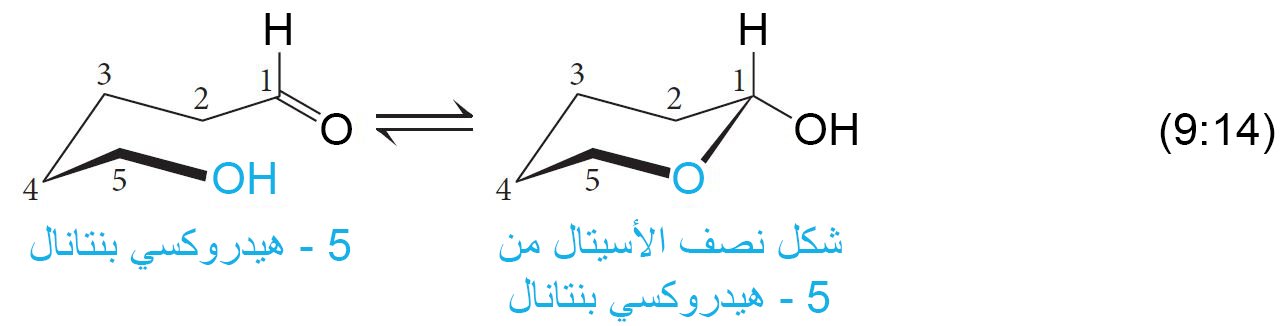
- إن المركبات التي يكون فيها مجموعة الهيدروكسيل بعيدة عن مجموعة الألدهيد بمقدار أربع إلى خمس ذرات كربون تميل إلى تكوين أنصاف الأسيتالات الحلقية أو الأسيتالات الحلقية عن طريق إضاقة نيوكليوفيلية ضمن الجزيء نفسه.
- تتشكل الحلقة عن طريق الميكانيكية التالية.
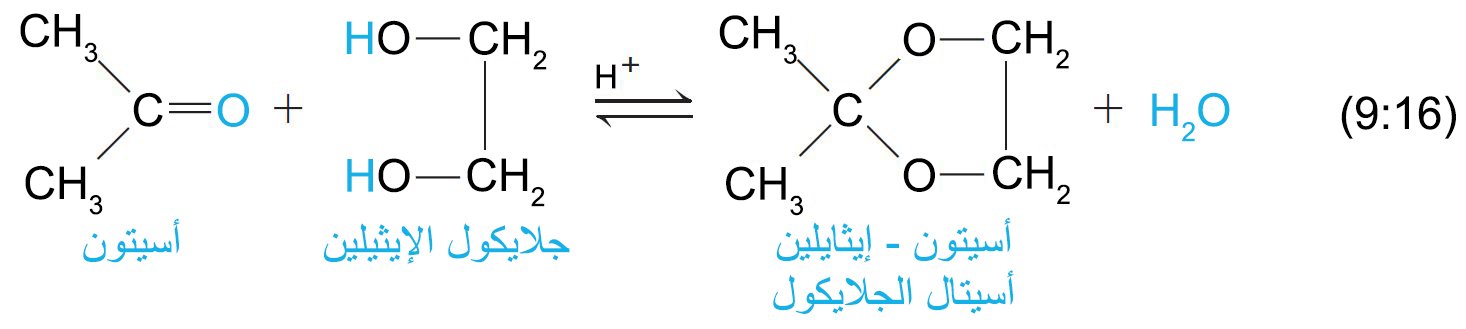
- يمكن للكيتونات أن تشكل الأسيتالات ، فإذا و كما هو الحال في المثال التالي تم استخدام الجلايكول ككحول، فإن الناتج سوف يكون حلقيا.
- تتفاعل الألدهيدات والكيتونات مع الكحولات لتشكل أولاً أنصاف الأسيتالات ثم إذا كان الكحول فائضا تتشكل الأسيتالات
- إن عملية تكوين الأسيتال عملية عكوسة.
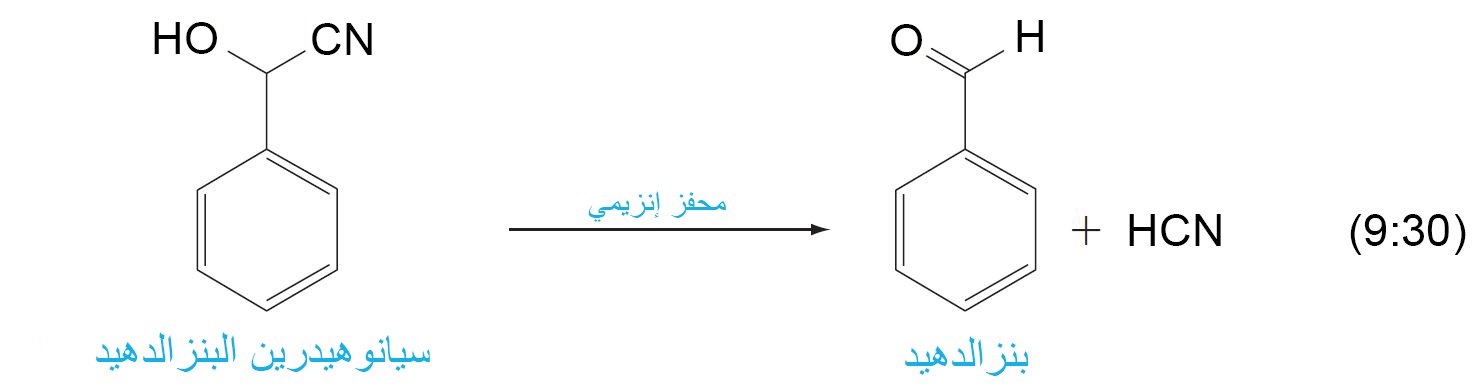
- تعرف العملية العكوسة لتكوين الأسيتال باسم حلمهة الأسيتال (تفاعل الأسيتال مع الماء لتكوين مركبات جديدة) ، و هذه العملية لا يمكن أن تتم إلا عن طريق وجود الماء.
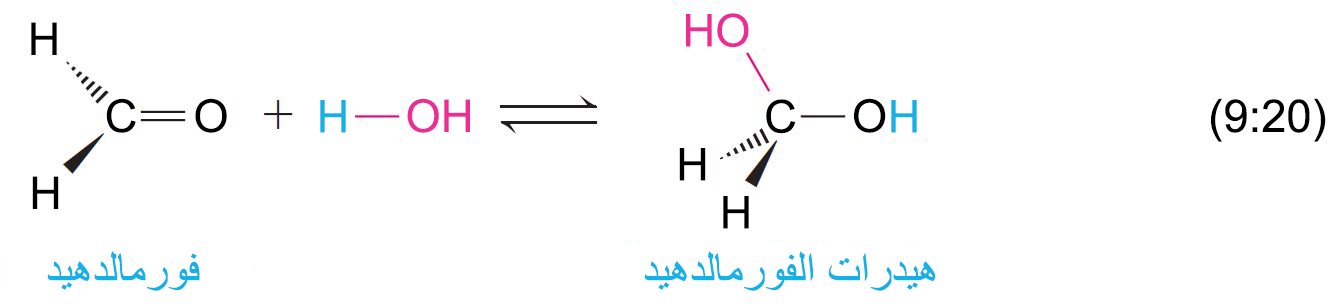
8 – إضافة الماء؛ تميه الألدهيدات والكيتونات Addition of Water; Hydration of Aldehydes and Ketones
- الماء هو نيوكليوفيل أكسجيني و يمكن إضافته إلى الألدهيدات و الكيتونات.
- لا يمكن استخلاص الهيدريدات (الماءات) لأنه يمكن أن تفقد ماءها بسهولة لإعادة تشكيل المركب الكربونيلي، و الحالة الشاذة عن ذلك هو مركب ثلاثي كلوريد الأسيتالدهيد (الكلورال) حيث يشكل مركب بلوري هيدراتي مستقر و هو هيدرات الكلورال CCl3CH(OH)2 .
9 – إضافة كاشف جرينيارد و الأسيتيليدات Addition of Grignard Reagents and Acetylides
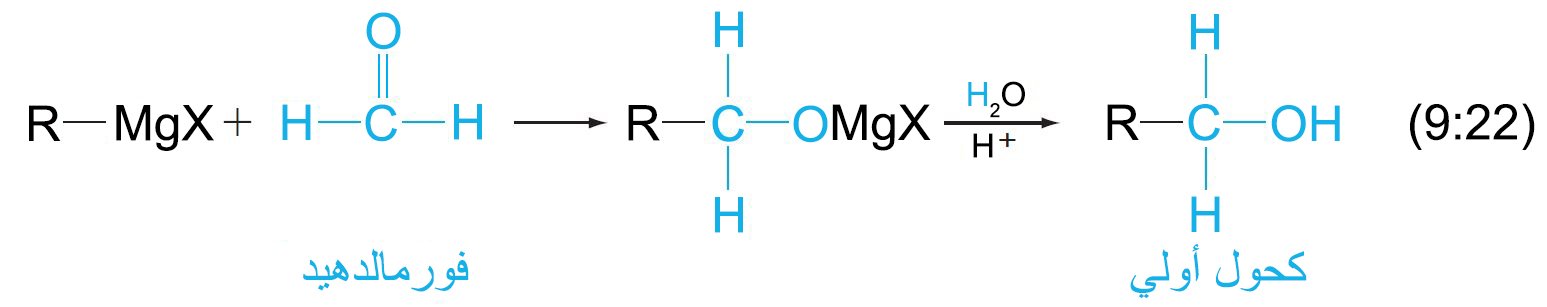
- يعمل كاشف جرينيارد كنيوكليوفيل كربوني بالنسبة إلى مركبات الكربونيل.
تتم إضافة مجموعة R الخاصة بكاشف جرينيارد إلى ذرة الكربون الكربونيلية ناتجا عن ذلك تكون رابطة كربون-كربون جديدة.
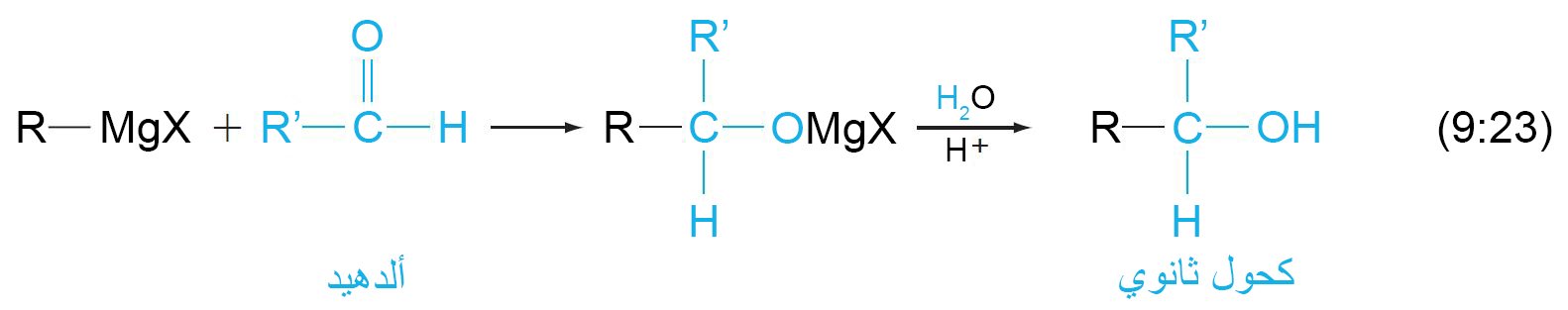
- إن تفاعل كاشف جرينيارد مع مركب الكربونيل ينتج عنه كحولا.
- يتم تحديد نوع الكحول حسب نوع المركب الكربونيلي الذي تم التفاعل معه.
- ينتج عن تفاعل الفورمالدهيد مع كاشف جرينيارد كحولا أوليا.
- الألدهيدات الأخرى ينتج عن تفاعلها مع كاشف جرينيارد الكحةلات الثانوية
- ينتج عن تفاعل الكيتونات مع كواشف جرينيارد الكحولات الثالثية.
- ممكن أيضا للكواشف العضوية الفلزية مثل المركبات العضوية الليثيومية و الأستيليدات أن تتفاعل مع مركبات الكربونيل بنفس الطريقة التي تتفاعل بها كواشف جرينيارد. فمثلا.
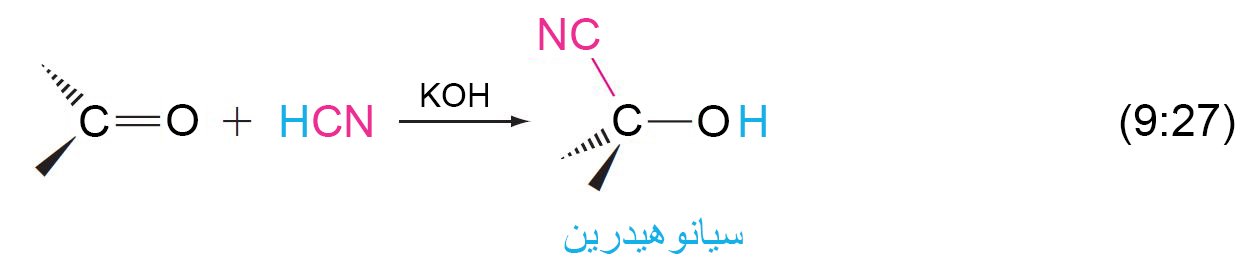
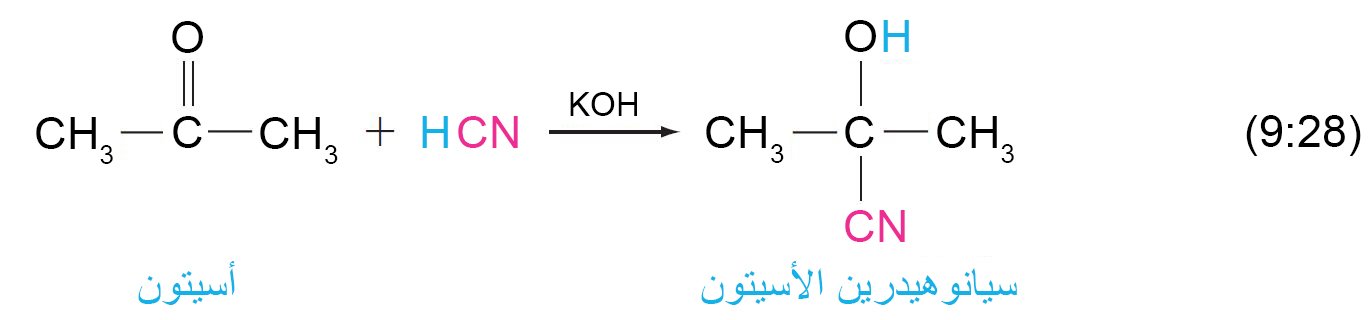
10 – إضافة الهيدروجين إلى السيانيد؛ السيانوهيدرينات Addition of Hydrogen Cyanide; Cyanohydrins
- عندما يتم إضافة سيانيد الهيدروجين إلى مجموعة الكربونيل في الألدهيدات أو الكيتونات فإنه يتشكل السيانوهيدرينات و هي مركبات تحتوي على مجموعة الهيدروكسيل و مجموعة السيانو متصلتين بنفس ذرة الكربون.
- لا يمتلك سيانيد الهيدروجين إلكترونات غير مشتركة على ذرة الكربون الخاصة به و بالتالي لا يمكن أن يكون نيوكليوفيل كربوني. و تعمل القاعدة على تحويل بعض سيانيد الهيدروجين إلى أيون السيانيد (–NC) و هذا الأخير بالتالي يعمل كنيوكليوفيل كربوني.
11 – إضافة النيوكليوفيلات النيتروجينية Addition of Nitrogen Nucleophiles
- بعض المركبات التي تمتلك إلكترونات غير رابطة على ذرة النيتروجين و تعمل كنيوكليوفيل نيتروجيني نحو ذرة الكربون الكربونيلية.
- عندما تتفاعل مركبات الكربونيل مع الأمينات الأولية ، فإن النواتج التي تنتج عن ذلك التفاعل تسمى إيمينات. و الإيمينات تشبه مركبات الكربونيل بخلاف أن ذرة الأكسجين قد تم استبداها بمجموعة NR .
12 – اختزال مركبات الكربونيل Reduction of Carbonyl
Compounds
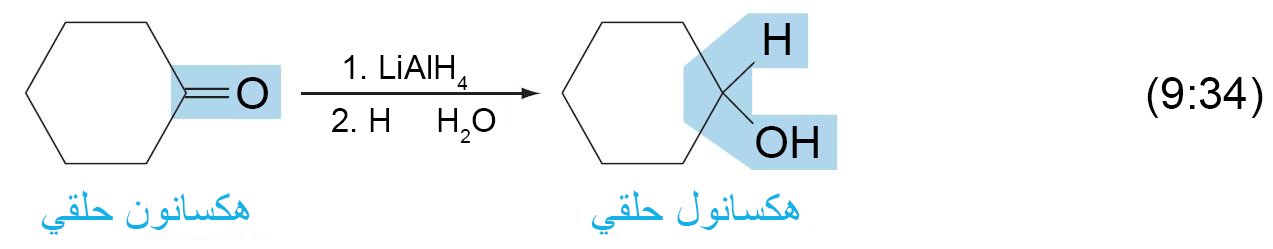
- يمكن بسهولة اختزال الألدهيدات إلى كحولات أولية.
- يمكن بسهولة اختزال الكيتونات إلى كحولات ثانوية.
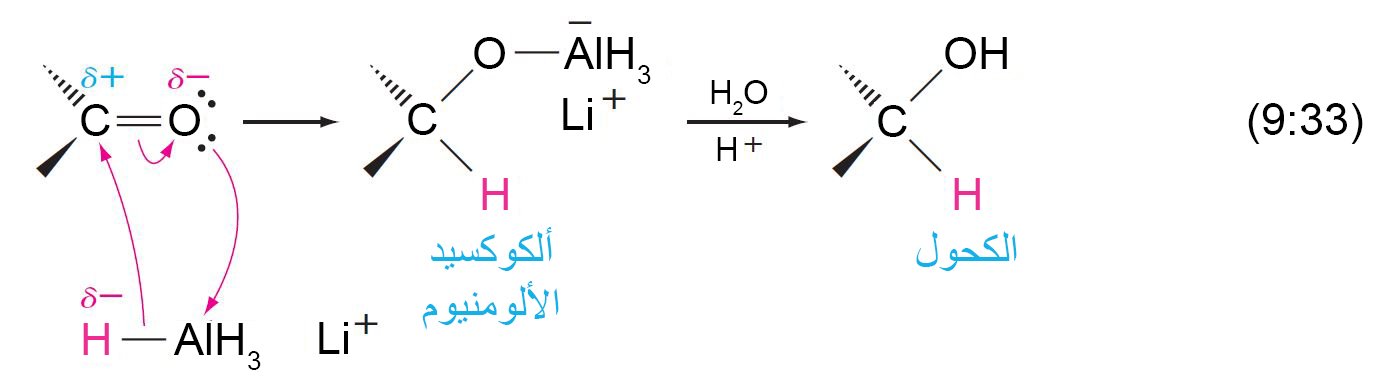
- أكثر الطرق شيوعا لإتمام الاختزال هو باستخدام هيدريدات الفلز.
- أكثر هيدريدات الفلزات شيوعا لأن تستخدم لغابات الإختزال هي هيدريد الليثيوم الألومنيوم (LiAlH4) و بوبوهيدريد الصوديوم (NaBH4) .
- يمكن استخدام هيدريدات الفلز لاختزال الرابطة الثنائية الكربون-الأكسجين الى الكحول المقابل دون اختزال الرابطة الثنائية الكربون-الكربون الموجودة في نفس المركب.
13 – أكسدة مركبات الكربونيل Oxidation of Carbonyl
Compounds
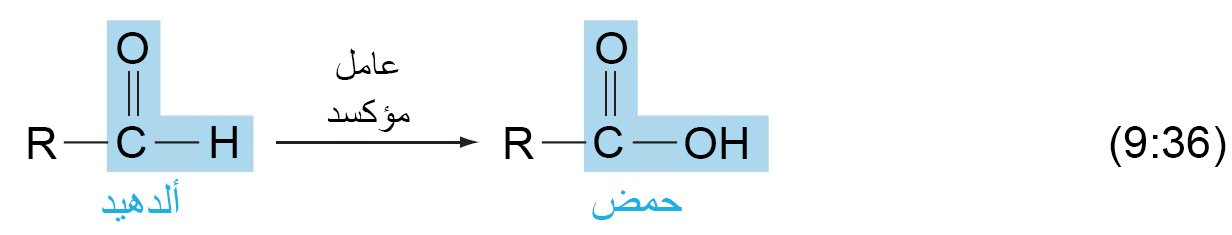
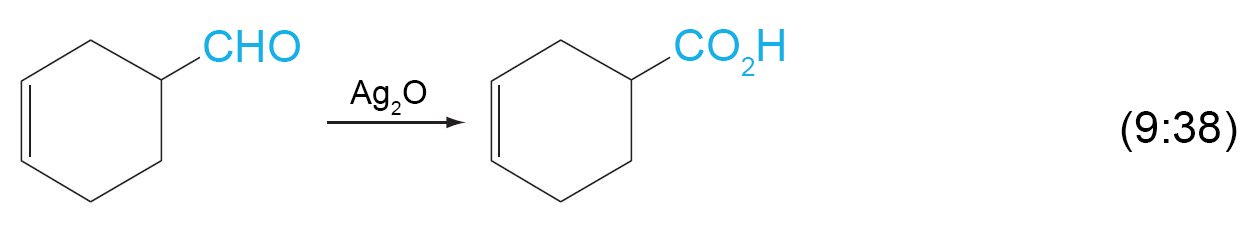
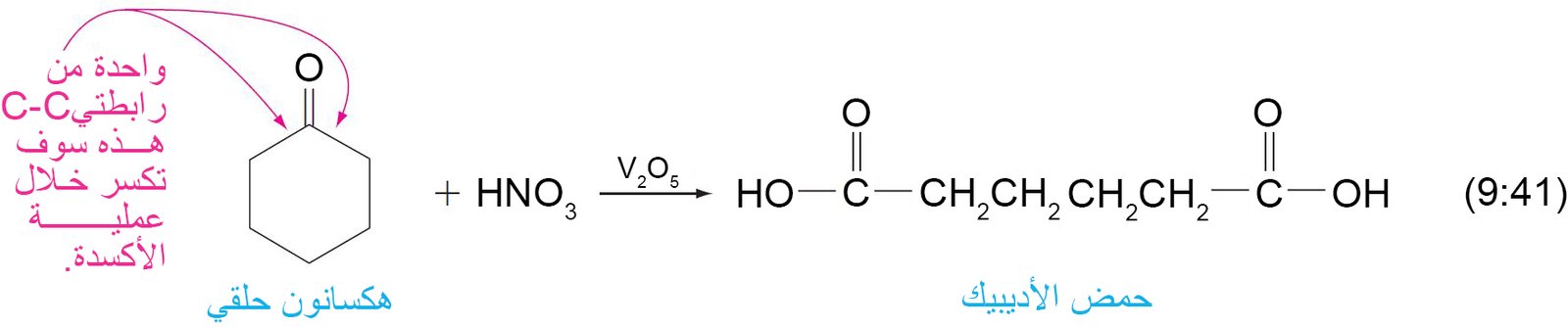
- تتأكسد الألدهيدات بسهولة اكثر من الكيتونات في وجود عوامل مختزلة مثل KMnO4 و CrO3 و Ag2O و فوق الحموض .
- ينتج عن أكسدة الألدهيد حمض كربوكسيلي يكون فيه عدد ذرات الكربون مساويا للألدهيد.
- في اختبار تولين Tollens حيث اختبار مرآة الفضة ، فإن أيون الفضة-الأمونيا المعقد يعمل على اختوال الألدهيدات (ولكن ليس الكيتونات) إلى فلز الفضة.
- يمكن للألدهيدات أن تتاكسد بسهولة إلى الحموض المقابلة لها.
- يمكن للكيتونات أن تتأكسد بسهولة و لكنها تحتاج إلى ظروف تأكسد خاصة.
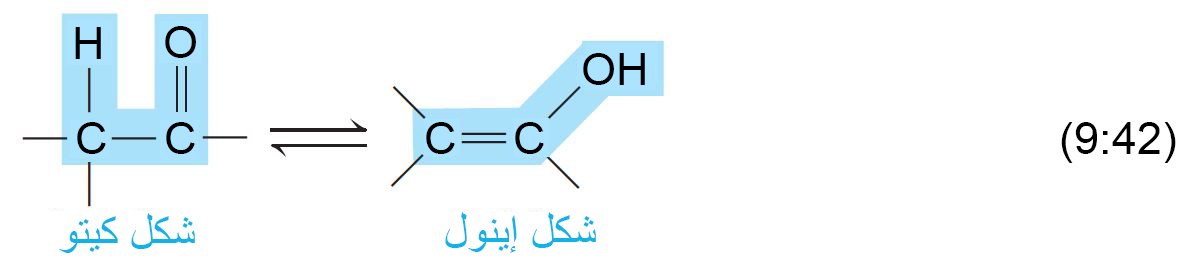
14 – توتوميرية الكيتو – الإينول Keto–Enol Tautomerism
- يمكن للألدهيدات أو الكيتونات أن تتواجد على شكل خليط متزن مكون من شكلين يعرفان باسم الشكل كيتو و الشكل إينول.
- هذا التصاوغ البنائي يسمى الصنوية أو التوتوميرية (من الكلمة اليونانية tauto و تعني مثل أو شبيه و meros و تعني قسم أو شطر) و يسمى الشكلين للألدهيد و الكيتون باسم التوتوميريات.
- إن التوتوميرات هي متصاوغات بنائية تكون في حالة اتزان و يمكن الإشارة إلى تلك الحالة من خلال استخدام رمز الاتزان ⇋ بين كلا التركيبين أو الشكلين.
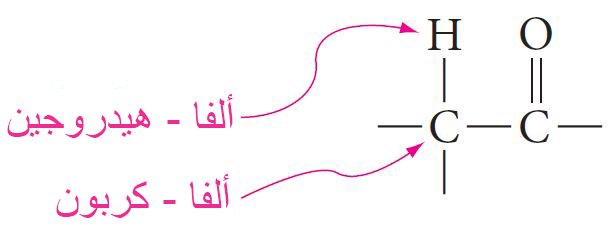
- و لكي يمكن تحقيق الشكل إينول ، يجب أن يكون المركب يحتوي على ذرة هيدروجين متصلة بذرة كربون مجاوره تماما لمجموعة الكربونيل. و تسمى ذرة الهيدروجين باسم ألفا-هيدروجين و تسمى ذرة الكربون المصلة بها ذرة الهيدروجين باسم ألفا-كربون.
- أغلب الألدهيدات و الكيتونات البسيطة توجد على الأغلب بالشكل كيتو. فمثلا يوجد الأسيتون بنسبة 99.9997 % بالشكل كيتو و يوجد فقط بنسبة 0.0003 % بالشكل إينول.
- بينما توجد الفينولات بصورة أساسية على شكل إينول.
- المركبات الكربونيلية التي لا تمتلك ألفا-هيدروجين لا يمكن لها أن تشكل الإينولات و توجد فقط على شكل كيتو.
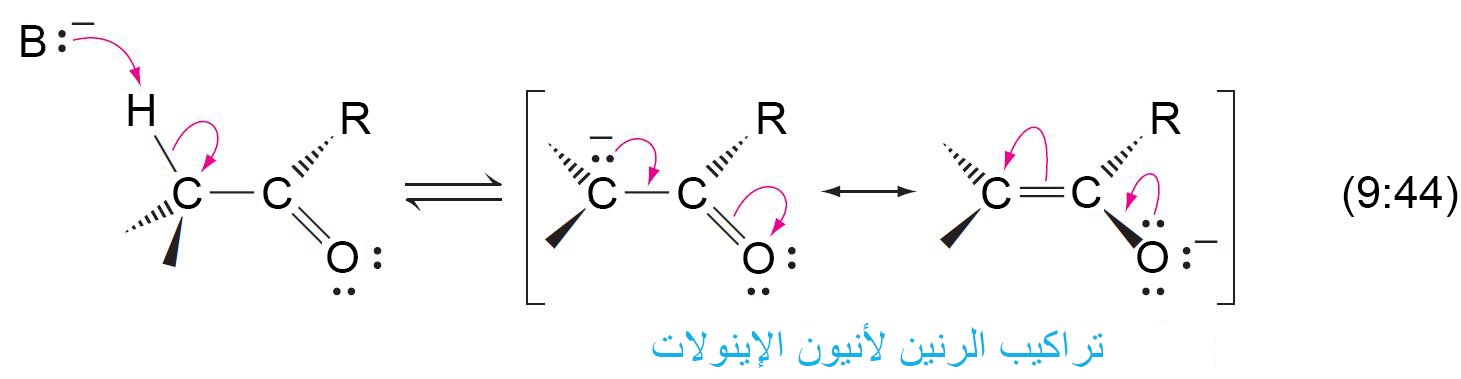
15 – حمضية ألفا – هيدروجين؛ أنيون الإينولات Acidity of α-Hydrogens; the Enolate Anion
- إن ألفا- هيدروجين في المركب الكربونيلي أكثر حمضية من ذرة الهيدروجين العادية المتصلة بذرة الكربون و هذا يعود لسبيبن: الاول أن ذرة الكربون الكربونيلية تحمل شحنة جزئية موجبة و هذا يعمل على جذب الإلكترونات نحوها وبعيدا عن ذرة ألفا-هيدروجين و بالتالي يسهل الأمر لإزالتها.
- أما السبب الثاني أن الأنيون الناتج عن إزالة ألفا-هيدروجين يكون في حالة اتزان بسبب الرنين.
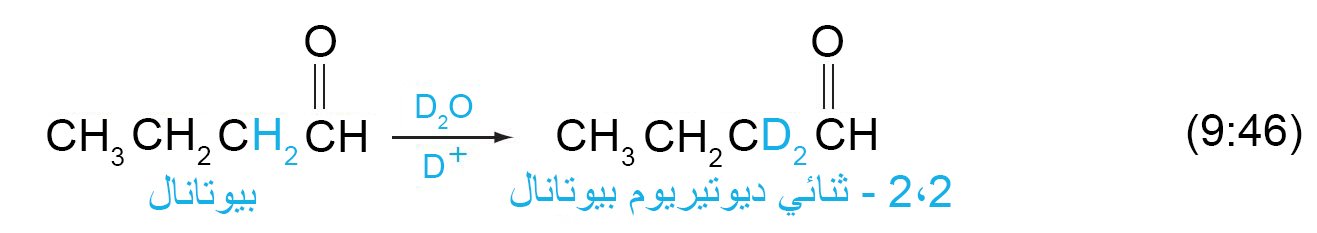
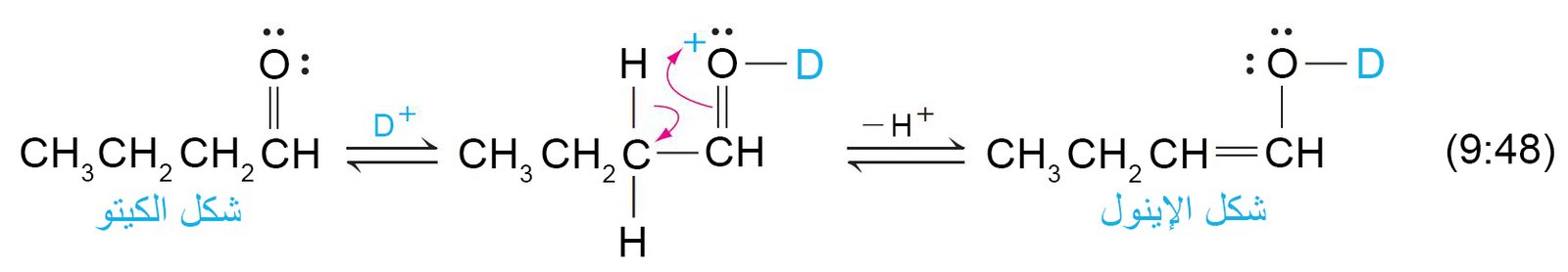
16 – استبدال الديوتيريوم في مركبات الكربونيل Deuterium Exchange in
Carbonyl Compounds
- إن وجود شكل الإينول في الألدهيدات و الكيتونات العادية منخفضا جدا فإن ذلك الأمر يمكن أن يتم إثباته عمليا.
- و تتطلب ميكانيكية التبادل المحفز لألفا-هيدروجين خطوتين:
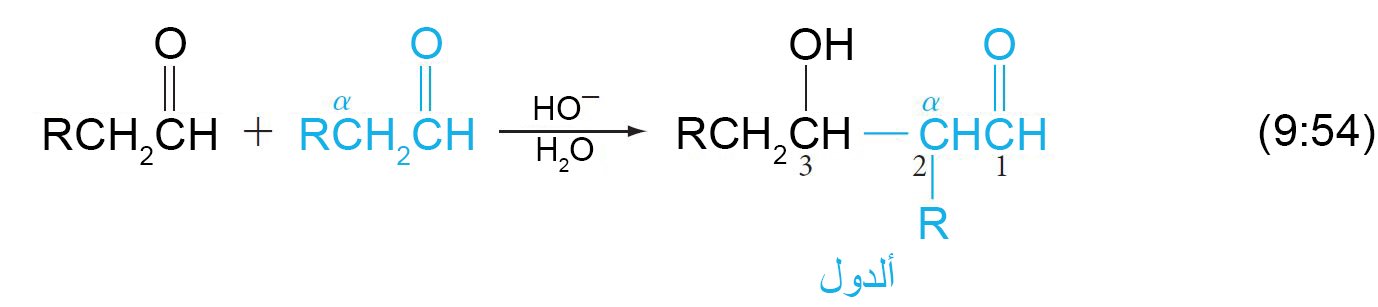
17 – تكثيف الألدول The Aldol Condensation
- يمكن إضافة أنيون الإينولات إلى مجموعة الكربونيل للألدهيد أوة الكيتن في تفاعل يعرف باسم تكثيف ألدول، و يسمى الناتج ألدول .
- و يمكن توضيح ميكانيكية تكثيف ألدول للأسيتالدهيد كما يلي:
- في تكثيف ألدول، ترتبط ذرة ألفا-كربون من أحد الألدهيدين مع ذرة الكربون الكربونيلية في الألدهيد الثاني.
- الألدول هو 3 – هيدروكسي ألدهيد أو 3 – هيدروكسي كيتون.
18 – تكثيف خليط ألدول The Mixed Aldol Condensation
- يمكن أنيون الإينولات لمركب كربونيل أن يضاف إلى كربون كربونيلي لمركب آخر مختلف شريطة أن تكون هناك عناية عند اختيار طرفي التفاعل، و بالتالي يحدث تفاعل يطلق عليه اسم تكثيف ألدول المخلوط.
19 – التحضير التجاري عن طريق تكثيف ألدول Commercial Syntheses via the Aldol Condensation
- عن طريق تكثف ألدول يمكن صناعة العديد من المركبات.
- إن البيوتانال هو المادة الأولية لتحضير طارد البعوض “12-6” (2 -إيثيل هكسان -3،1-ديول). فالخطوة الأولى هي تكثيف ألدول ، والخطوة الثانية هي اختزال مجموعة الألدهيد إلى كحول أولي.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
2 thoughts on “الألدهيدات و الكيتونات Aldehydes and Ketones”
Leave a Reply Cancel reply
This site uses Akismet to reduce spam. Learn how your comment data is processed.




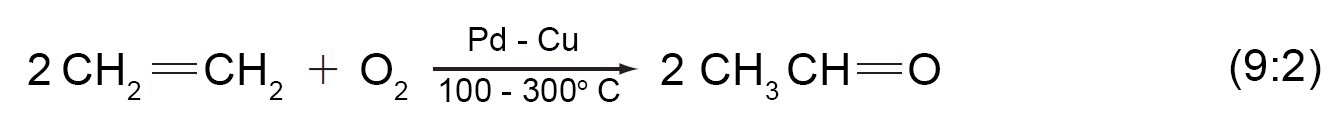





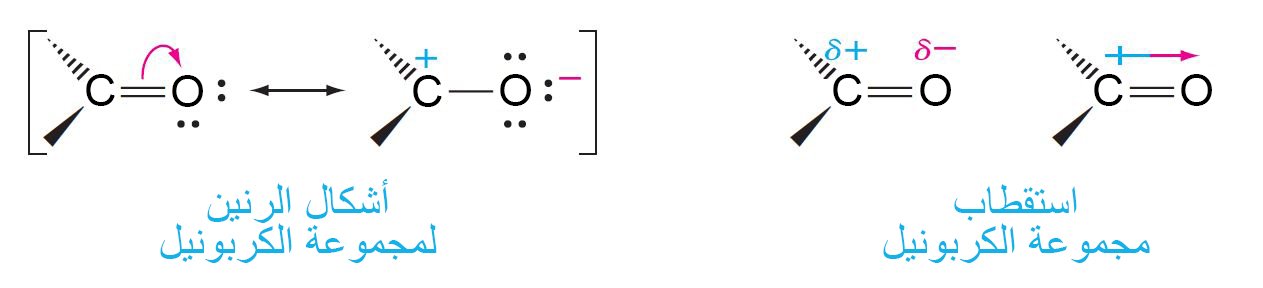

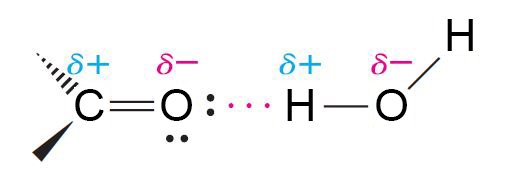


















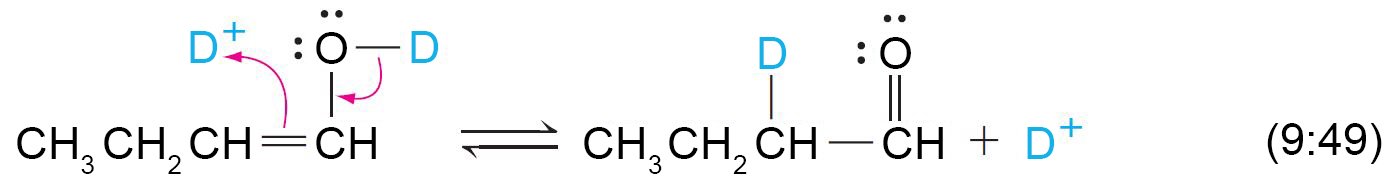






السلام عليكم
بلكشف عن الكيتونات والالديهايدات ليش من نفاعل الاستل دهايد ويه لكروميك ينطينا محلول اخضر فدوه الي يعرف يجاوب ❤️
عدد التأكسد للكروم في حمض الكروميك هو +6 ، و عند تفاعل حمض الكروميك مع الألدهيد فإن الكروم يختزل و يصبح عدد تأكسده +3 و بالتالي يتحول المحلول إلى اللون الأخضر المزرق .