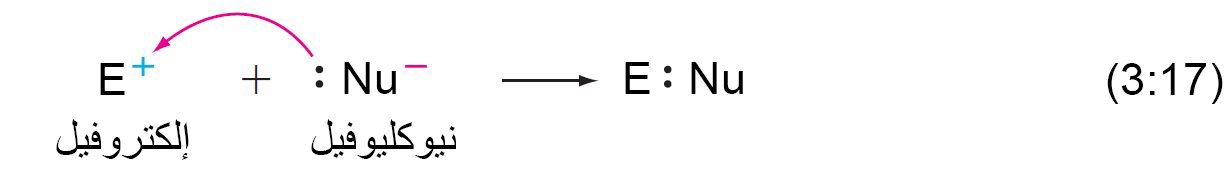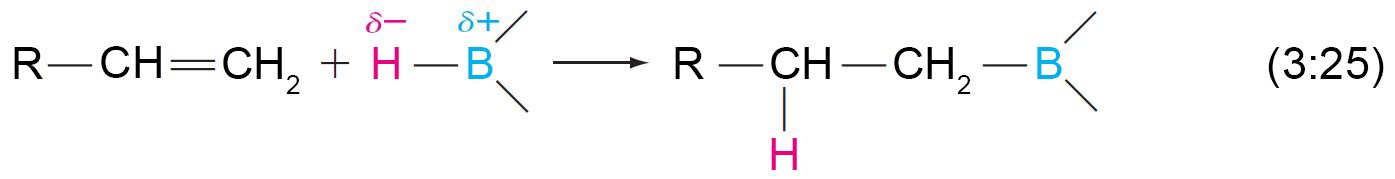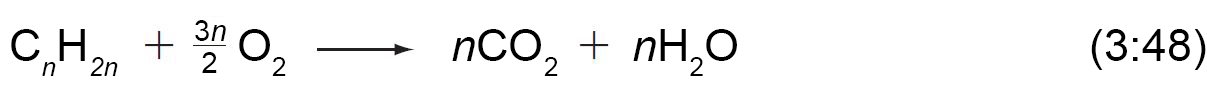الألكينات و الألكاينات Alkenes and Alkynes : ملاحظة هامة: هذا المقال عبارة عن مختصر للفصل الثالث من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
1 – التعريف و التصنيف Definition and Classification
- تعرف الهيدروكربونات التي تحتوي على رابطة كربون-كربون ثنائية باسم الألكينات.
- تعرف الهيدروكربونات التي تحتوي على رابطة كربون-كربون ثلاثية باسم الألكاينات.
- الصيغة العامة للألكينات و الألكاينات هي:
- كلا النوعين السابقين يعتبران هيدروكربونات غير مشبعة.
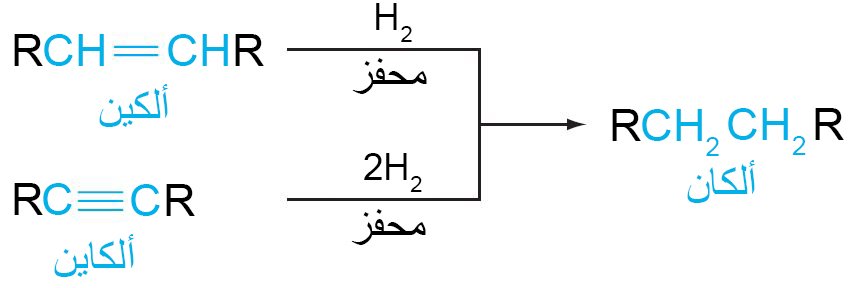
- يمكن الحصول على الألكانات من الألكينات و الألكاينات بإضافة مول أو مولين من الهيدروجين.
- هناك مركبات تحتوي على أكثر من رابطة ثنائية أو ثلاثية في نفس المركب.
- إذا وجدت رابطتين ثنائيتين في نفس المركب فإن تلك المركبات تعرف باسم ألكادايينات أو بصورة شائعة تعرف باسم الدايينات. و يعرف أيضا مركبات الترايينات و التترايينات و حتى البولينات.
- كما تعرف أيضا المركبات التي تحتوي على أكثر من رابطة ثلاثية.
- يقال على الروابط الثنائية بأنها متراكمة عندما تكون بجوار بعضها البعض.
- عندما تتناوب الروابط المتعددة مع روابط لأحادية ، يطلق عليها مصطلح مترافقة.
- عندما يوجد أكثر من رابط أحادية بين الروابط المتعددة ، فأنه يطلق عليها اسم معزولة أو غير مترافقة.
2 – تسمية الألكينات و الألكاينات Nomenclature of alkenes and alkynes
- تشبه قواعد الأيوباك IUPAC لتسمية الألكينات والألكاينات تلك المتعلقة بالألكانات ، ولكن يجب إضافة بعض القواعد الخاصة لتسمية الروابط المتعددة وتحديد موقعها.
- يتم استخدام اللاحقة -ين لتحديد رابطة الكربون – الكربون الثنائية. عندما يكون هناك أكثر من رابطة ثنائية ، تكون اللاحقة هي -دايين diene-أو -ترايين triene- ، وهكذا.
- يتم استخدام اللاحقة -اين لتحديد الرابطة الثلاثية (-دياين لرابطتين ثلاثيتين و هكذا).
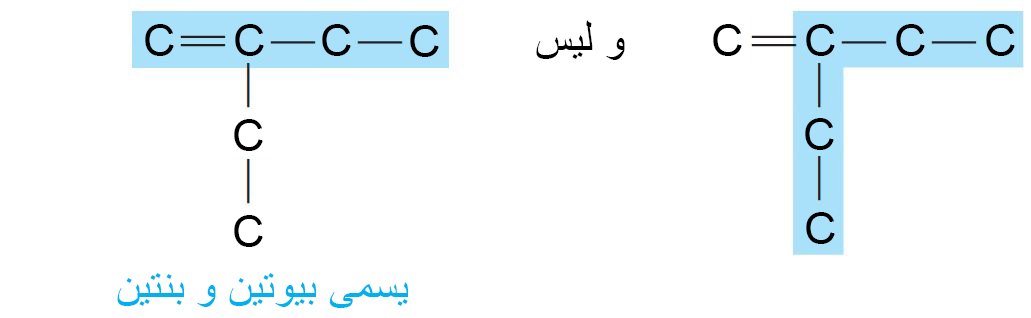
المركبات ذات الروابط الثنائية و ثلاثية هي -إناينات. - حدد أطول سلسلة تتضمن كربون الرابطة الثنائية أو الثلاثية. فمثلا،
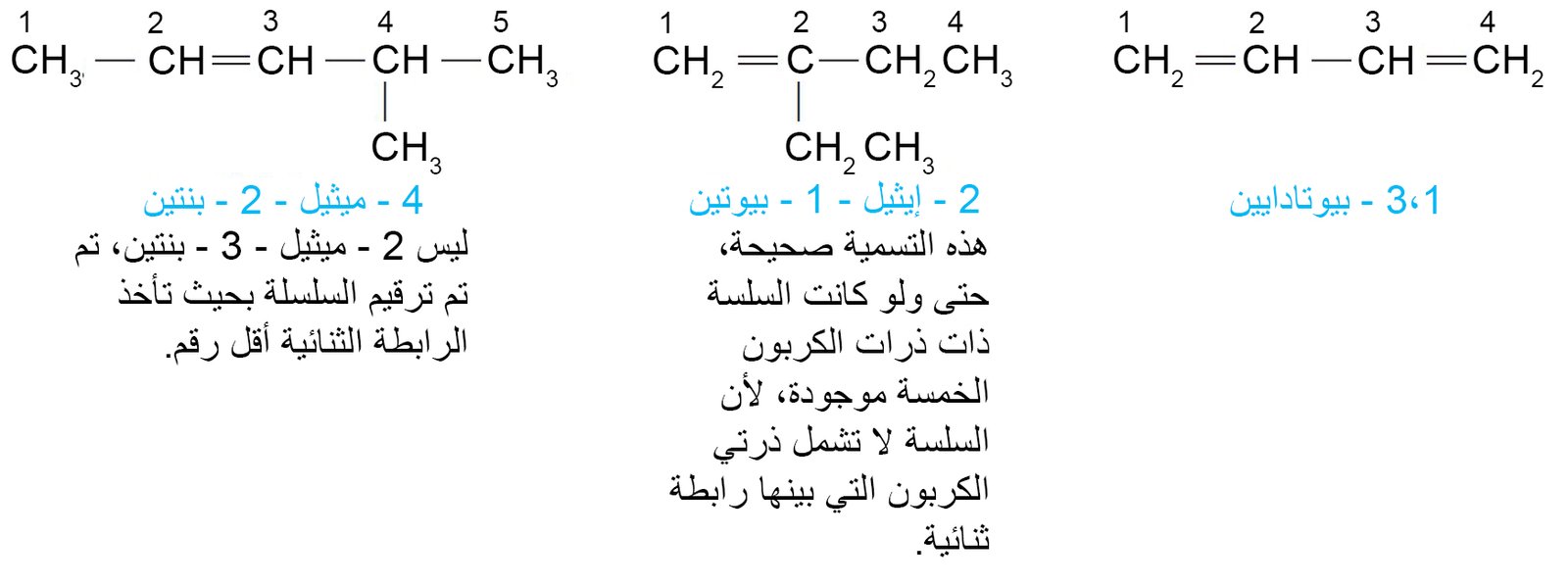
- قم بترقيم السلسلة من النهاية الأقرب إلى الرابطة المتعددة بحيث يتم ترقيم ذرات الكربون في تلك الرابطة لأن تكون أقل عدد ممكن من الأرقام.
- إذا كانت ترقيم الرابطة المتعددة متساو من طرفي السلسلة، قم بترقيم السلسلة من النهاية الأقرب لأول نقطة تفرع.
- أشر إلى موضع الرابطة المتعددة باستخدام ذرة الكربون التي تحمل أقل ترقيم من تلك الرابطة. فمثلا،
- في حالة وجود أكثر من رابطة متعددة ، قم بترقيم السلسلة من النهاية الأقرب إلى الرابطة المتعددة الأولى.
- إذا كانت الرابطة الثنائية والثلاثية متساوية من نهاية السلسلة ، فإن الرابطة الثنائية تحمل أقل رقم. فمثلا،
- أمثلة على تسمية الألكينات و الألكاينات
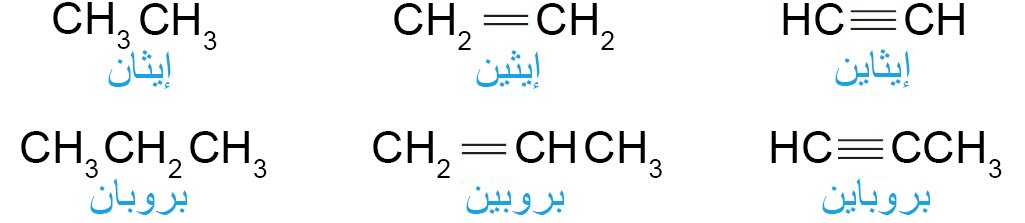
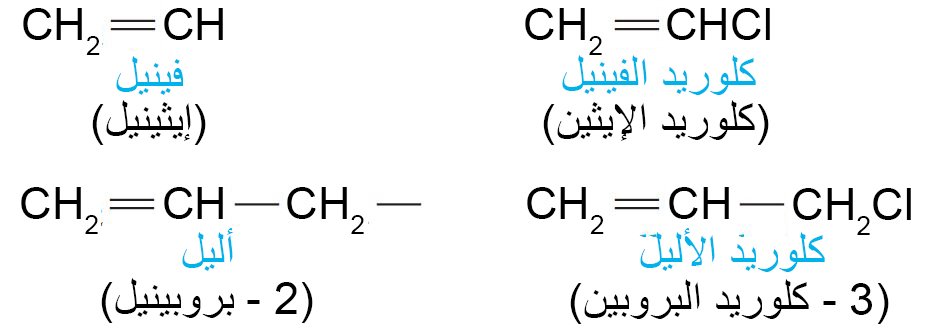
- الأسماء الشائعة لبعض مركبات الألكينات و الألكاينات البسيطة.
- الأسماء الشائعة لمجموعتين هامتين: مجموعة الفينيل ومجموعة الأليل.
3 – بعض الحقائق حول الروابط الثنائية Some Facts about Double Bonds
- بعض الميزات الخاصة للروابط الكربون-الكربون الثنائية:
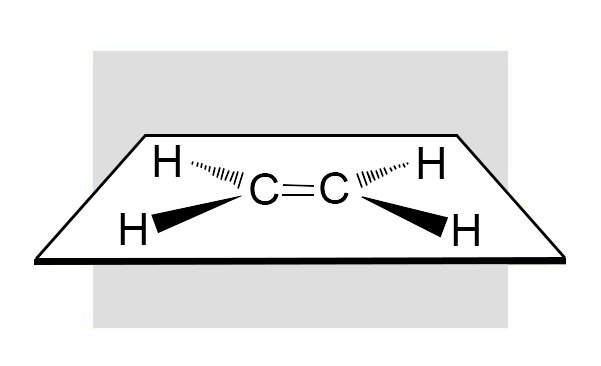
- أ. كل ذرة كربون من الرابطة الثنائية تكون متصلة بثلاث ذرات أخرى فقط.
- ب. ذرات الكربون الإثنتين من الرابطة الثنائية والذرات الأربعة التي ترتبط بهما تكمن في مستوى واحدة. و قياس الزاويتين H‒C‒H و H‒C=C في الإيثيلين تبلغ حوالي 120 درجة.
- ج. الدوران حول الروابط الثنائية تكون مقيدة.
د. روابط الكربون – الكربون الثنائية أقصر من روابط الكربون-الكربون الفردية.
4 – النظرية الفلكية للرابطة الثنائية، الرابطة باي.
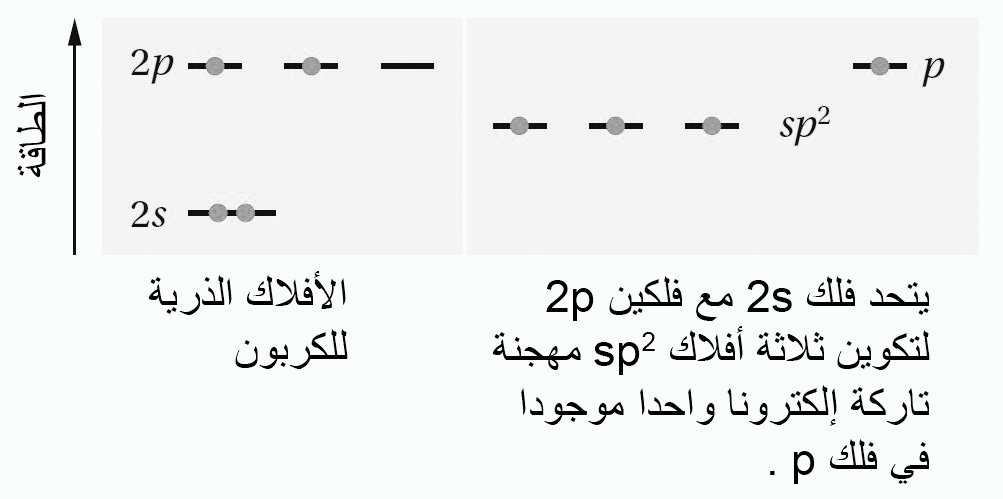
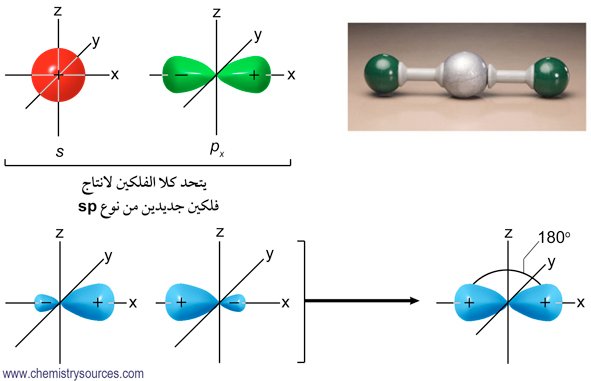
- في جزيء الإيثيلين كل ذرة كربون تكون مرتبطة مع ثلاث ذرات أخرى (ذرتي هيدروجين و ذرة كربون)، و بالتالي فنحن بحاجة إلى نوع آخر من التهجين لكل ذرة كربون موجودة في جزيء الإثيلين.
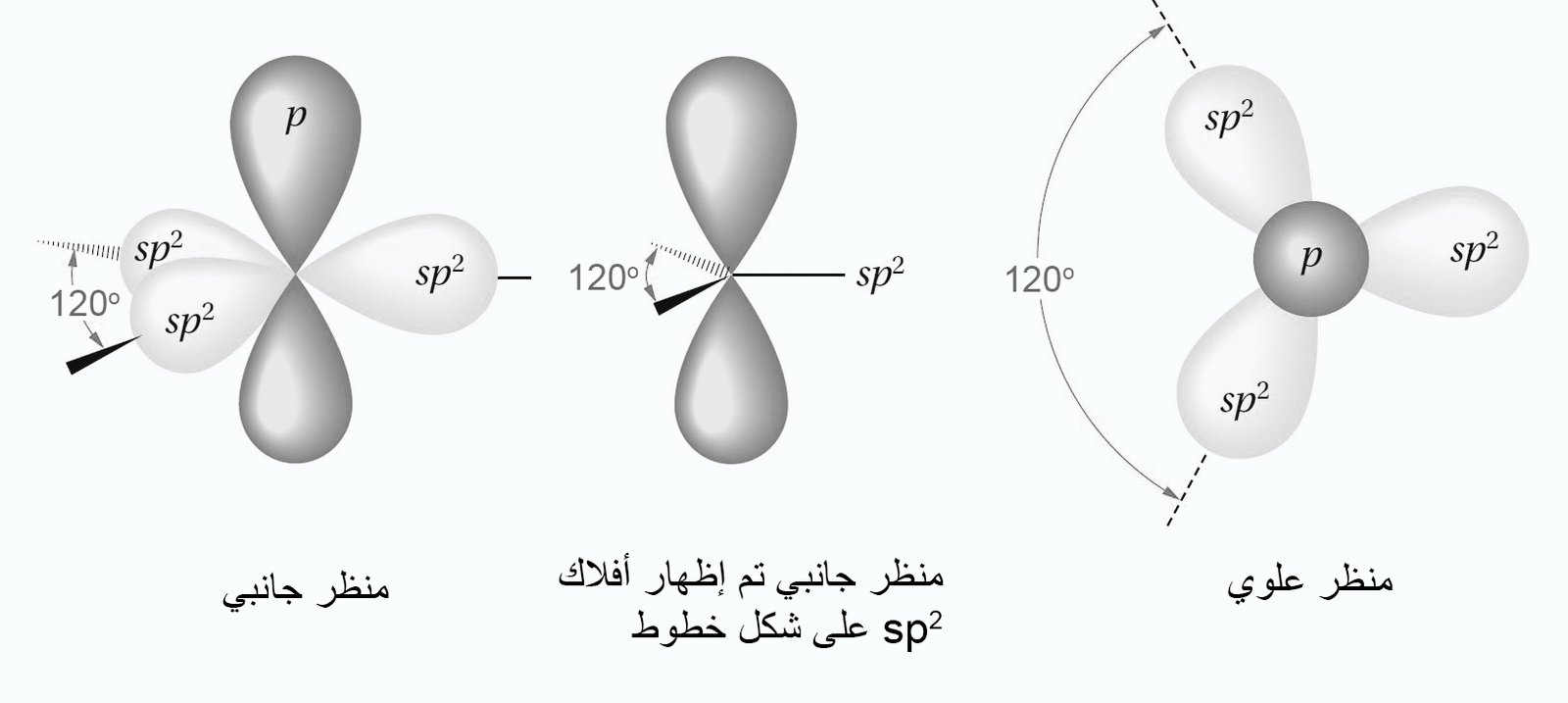
- في هذه الحالة نحن بحاجة إلى ثلاثة أفلاك مهجنة من نوع sp2 حول كل ذرة كربون( سميت sp2 لأنها مكونة من فلك s و فلكي p) بالإضافة إلى فلك غير مهجن من نوع p .
- تكون الزاوية بين الأفلاك المهجنة 120 درجة , بالتالي يكون الشكل الهندسي لها مثلت مسطح.
- توجد إلكترونات التكافؤ الثلاثة في أفلاك sp2، و هناك إلكترون تكافؤ رابع يوجد في فلك 2p ، و الذي يكون عموديا على مستوى أفلاك sp2 المهجنة.
- سترتبط ذرتي الهيدروجين مع كل ذرة كربون بواسطة رابطة سيجما (σ) ، وستربط ذرة الكربون مع ذرة الكربون الأخرى تشكل رابطة سيجما كربون-كربون.
- في جزيء الإيثيلين لدينا خمس روابط سيجما (σ) .
- يمكن للأفلاك p غير المهجنة أن تتداخل جنبًا إلى جنب لتشكل نوعًا جديدًا من الترابط و الذي يعرف باسم الرابطة الرابطة باي (π).
- سيؤدي وجود رابطة π إلى منع التدوير الحر ، وبالتالي لا نحصل على هيئات مختلفة لجزيء الإيثيلين.
- الرابطة المزدوجة بين ذرات الكربون تتكون من رابطة π ورابطة σ .
- الرابطة الثنائية أقصر من الرابطة الفردية.
- الإلكترونان الموجودان في رابطة سيجما يقعان على طول المحور النووي ؛ و يقع الإلكترونان الموجودان في رابطة باي في منطقة من الفراغ أعلى وأسفل المستوى التي يتكون منها الكربونان والذرات الأربعة المرتبطة بهما.تتعرض الإلكترونات باي أكثر من الإلكترونات ويمكن أن تتعرض للهجوم من قبل مختلف الكواشف التي تسعى للإلكترون.
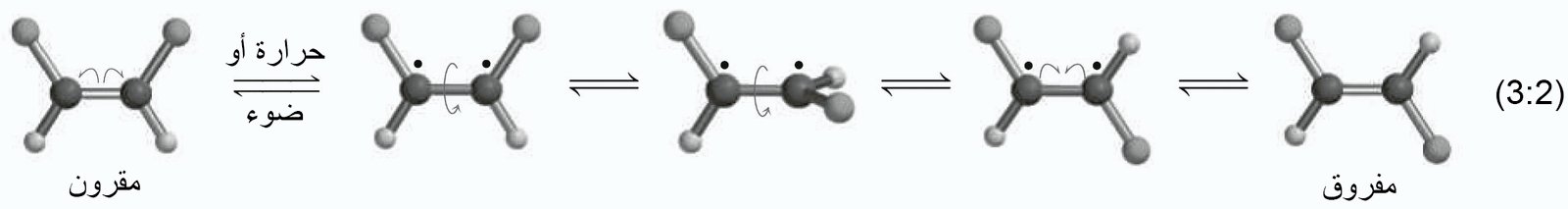
5 – التصاوغ المقرون-المفروق في الألكينات Cis-Trans Isomerism in
Alkenes
- بسبب كون الدوران حول رابطة الكربون-الكربون الثنائية مقيدة، فإن التصاوغ المقرون-المفروق (التصاوغ الهندسي أو البنائي) ممكن في الألكينات القابلة لأن يحدث فيها الاستبدال بطريقة مناسبة.
- إن المتصاوغات الفراغية هذه هي مصاوغات بنائية (تكوينية) ويمكن فصلها عن بعضها البعض عن طريق التقطير ، بسبب الاختلاف في درجة الغليان.
- إذا تم توفير طاقة كافية لكسر رابطة باي والسماح بالدوران حول رابطة سيجما ، فإنه يمكن الحصول على مصاوغات هندسية للألكينات.
6 – مقارنة بين تفاعلات الإضافة والاستبدال Addition and Substitution
Reactions Compared
- مع الألكينات فإن أكثر التفاعلات شيوعا هي تفاعلات الإضافة.
- في هذا التفاعل ، يتم كسر رابطة باي للألكين ، كما يتم كسر رابطة سيجما للكاشف و من ثم يتم تشكيل رابطتين سيغما جديدتين.
7 – تفاعلات الإضافة القطبية Polar Addition Reactions
- يتم اضافة العديد من الكواشف إلى الرابطة الثنائية من خلال تفاعلات الإضافة القطبية المكونة ممن خطوتين.
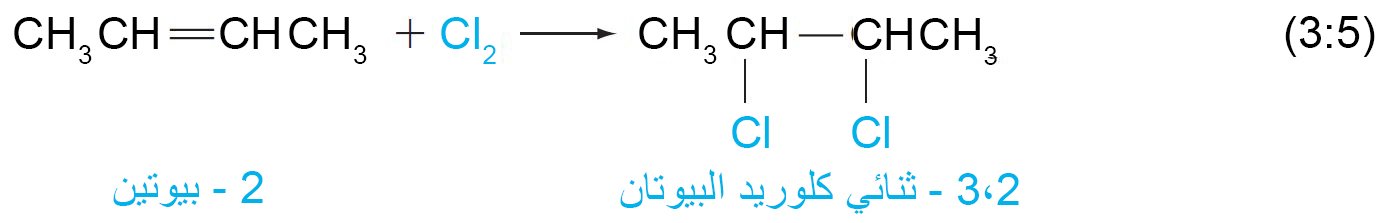
7. أ إضافة الهالوجينات
- من السهل جدا إضافة الكلور أو البروم إلى الألكينات.
- يذوب الهالوجين في بعض المذيبات الخاملة مثل ثلاثي أو رباعي كلوريد الميثان ، ثم يضاف هذا المحلول قطرة إلى الألكين
- يمكن استخدام تفاعل البروم كاختبار كيميائي للتفريق بين المركبات المشبعة و المركبات غير المشبعة
- عندما يضاف محلول البروم إلى المركب غير المشبع، فإن لون البروم يختفي. و إذا كان المركب الذي يتم اختباره مشبعًا ، فلن يتفاعل مع البروم في ظل هذه الظروف ، و يبقى لون البروم على حاله.
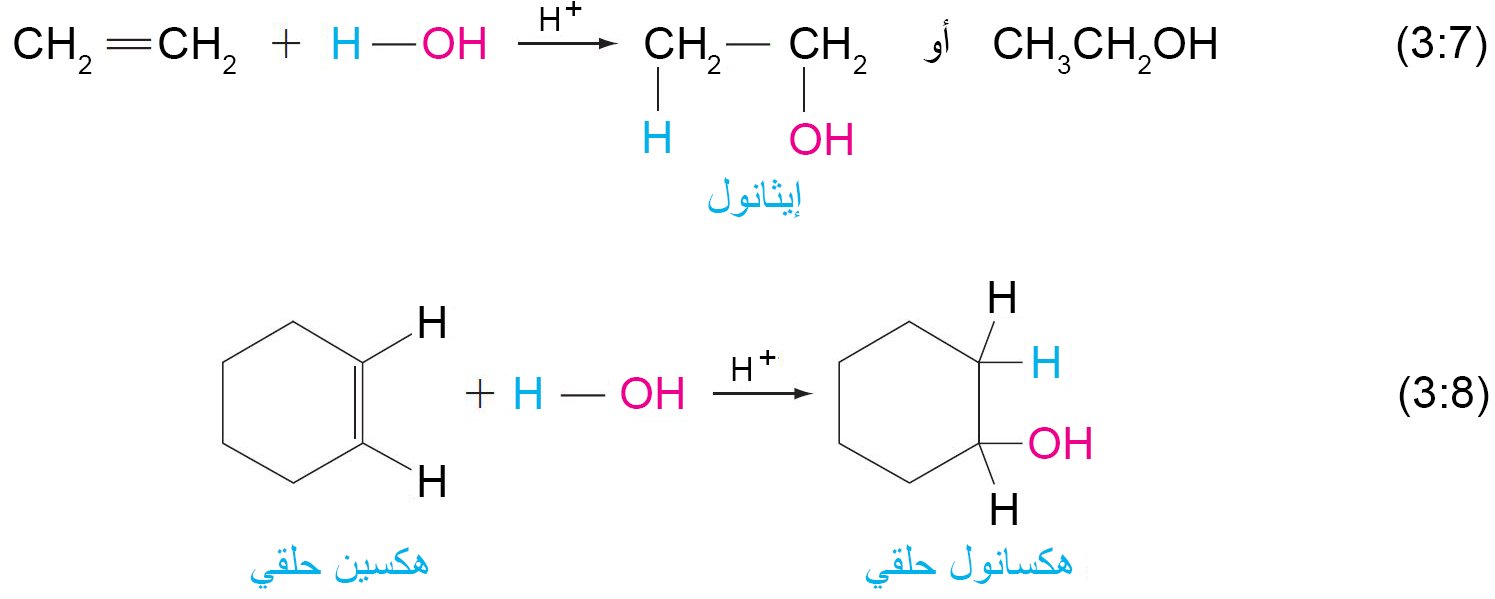
7. ب إضافة الماء (التميؤ)
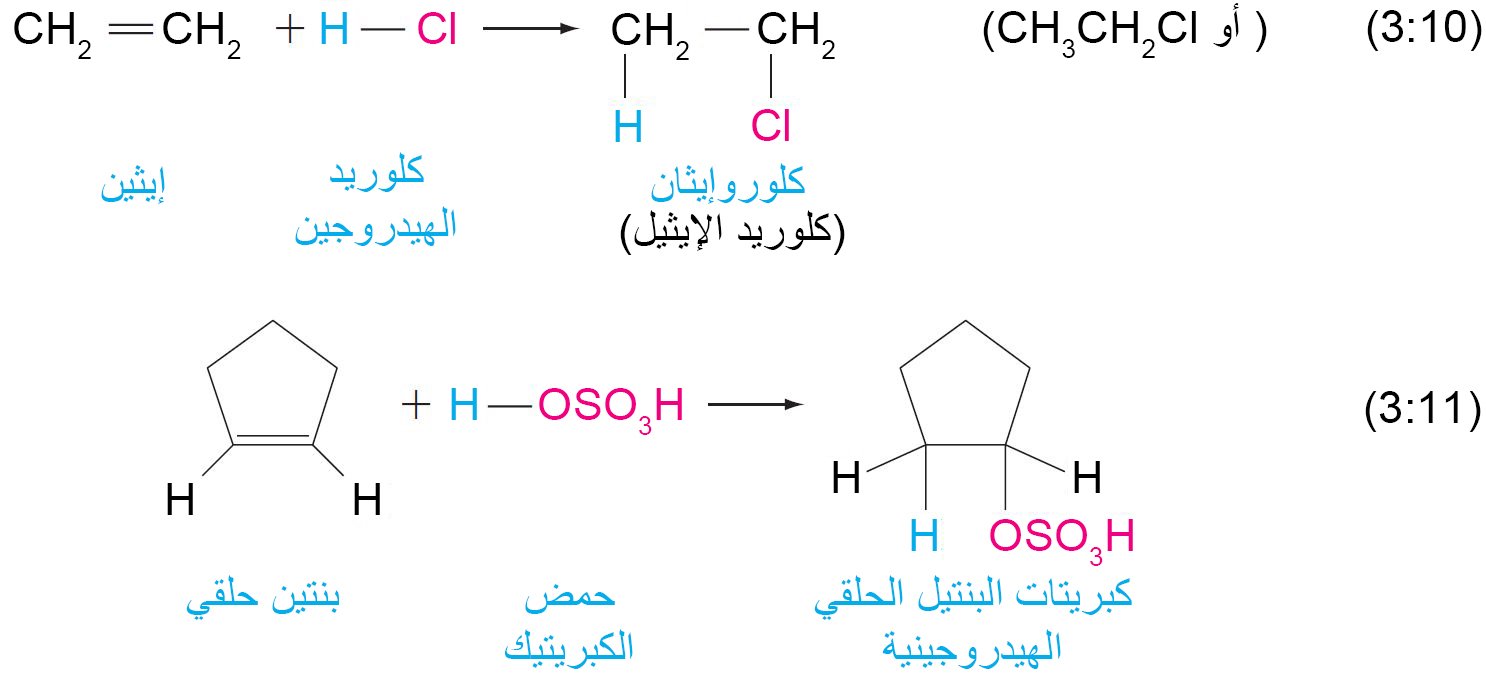
- عند إضافة الماء إلى الألكينات بوجود حمض كعامل مساعد، فإن النواتج تكون كحولات.
7. ج إضافة الماء (التميؤ)
- عند إضافة حمض إلى الألكينات ، فإن أيون الهيدروجين (أو البروتون) يضاف إلى أحد ذرتي كربون الرابطة الثنائية ، و يضاف باقي الحمض إلى الكربون الآخر.
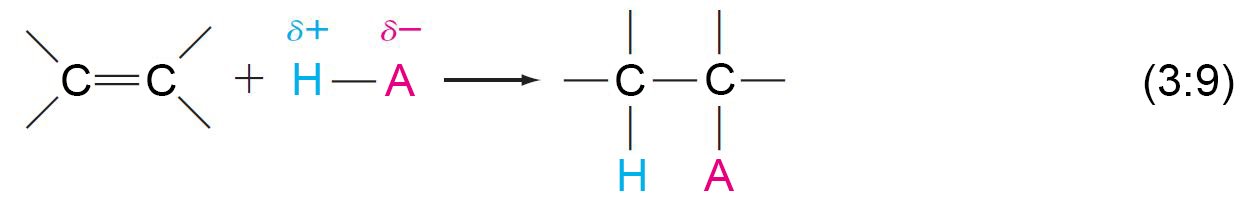
8 – إضافة الكواشف غير المتماثلة مع الألكينات غير المتماثلة، قاعدة ماركوفنيكوف
Addition of Unsymmetric Reagents to Unsymmetric
Alkenes; Markovnikov’s Rule
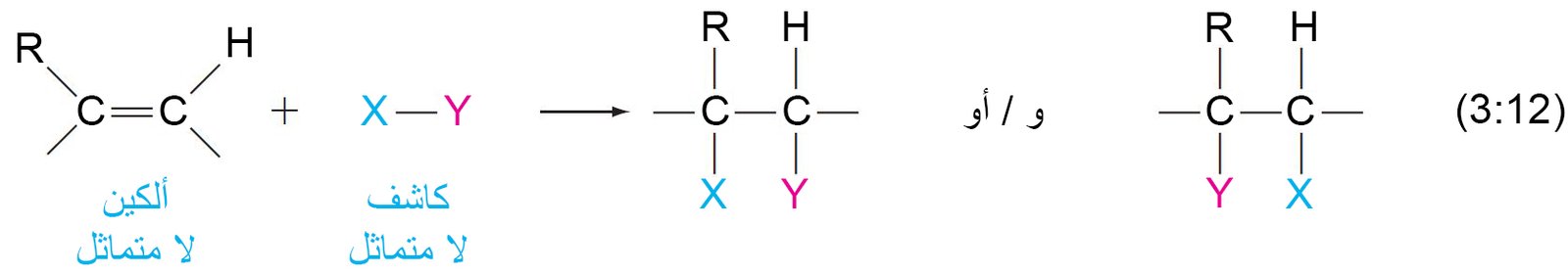
- يمكن تصنيف الكواشف والألكينات على أنها إما متماثلة أو غير متماثلة فيما يتعلق بتفاعلات الإضافة. (الجدول في الصفحة الآتية).
- إذا كان الكاشف و / أو الألكين متماثلين ، يكون ناتج الإضافة المحتمل منتج واحد فقط.
- إذا كان كل من الكاشف والألكين غير متماثلين ، يكون هناك ناتجان محتملان من حيث المبدأ.
- إذا اختلف عدد ذرات الهيدروجين المتصلة بذرتي كربون الرابطة الثنائية ، فإنه في هذه الحالة يتم تطبيق قاعدة ماركوفنيكوف و التي تنص على « عند إضافة كاشف غير متماثل إلى مركب ألكيني غير متماثل فإن الطرف الموجب من الكاشف يضاف إلى ذرة كربون الرابطة الثنائية المرتبطة بالعدد الأكبر من ذرات الهيدروجين.
9 – ميكانيكية الإضافة الإلكتروفيلية للألكينات Mechanism of Electrophilic Addition to Alkenes
- إن إلكترونات pi للرابطة الثنائية أكثر عرضة للهجوم من قبل الكواشف ، وبالتالي فإن إلكترونات pi هي التي تشارك في تفاعلات الإضافة إلى الألكينات.
- يمكن تصنيف المواد المتفاعلة القطبية إلى إما إلكتروفيلية أو نيوكليوفيلية.
- الإلكتروفيلات (محبات الإلكترون) هي كواشف فقيرة الإلكترون. وفي تفاعلاتها مع جزيئات أخرى فإنها تبحثن عن الإلكترونات.
- غالبًا ما تكون الإلكتروفيلات أيونات موجبة (الكاتيونات) أو جزيئات تنقصها الإلكترونات.
- النيوكليوفيلات (محبات النواة) غنية بالإلكترون، و يمكنها أن تشكل الروابط عن طريق التبرع بالإلكترونات إلى الإلكتروفيلات.
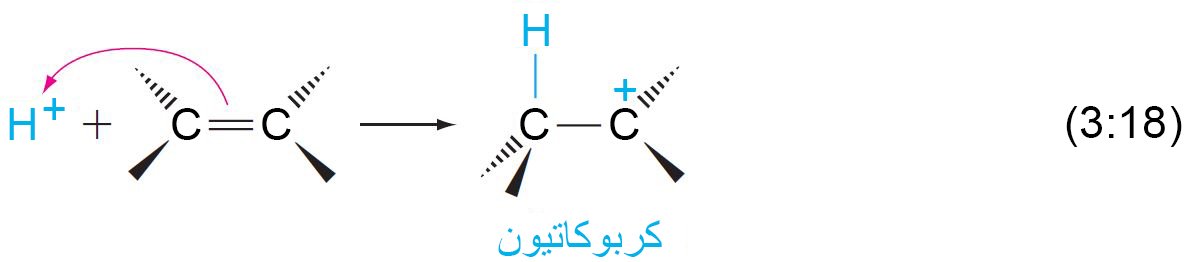
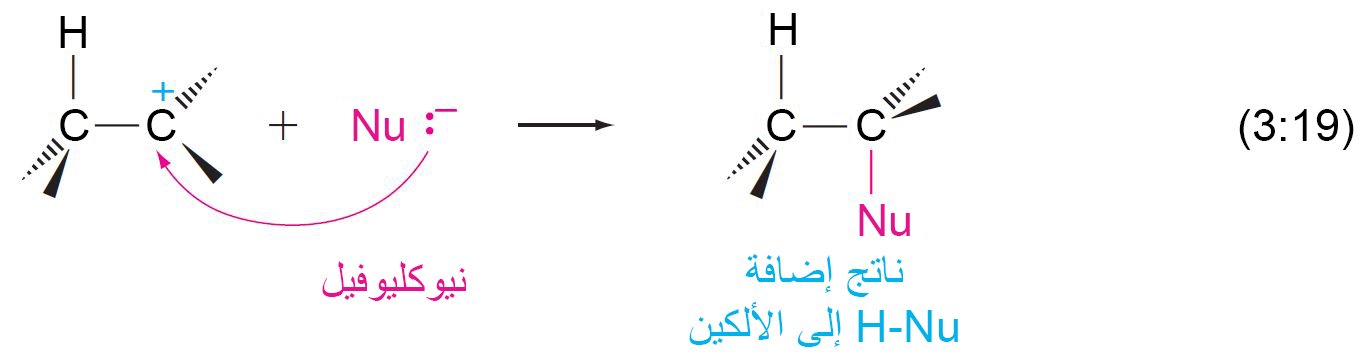
- عند إضافة حمض إلى الألكينات ، فإن البروتون (+H) يهاجم الإلكتروفيل (أي: رابطة الكربون -الكربون الثنائية بسبب وجود إلكترونات باي).
- مع اقتراب البروتون من رابطة باي ، يشكل إلكترونا باي رابطة سيجما بين البروتون (+H) و ذرة واحدة من ذرات الكربون. و لأن هذه الرابطة تستخدم كلا إلكترونات باي، فإن الكربون الآخر يكتسب شحنة موجبة ، مما يُكون كربوكاتيون(كاتيون كربوني).
- الكربوكاتيونات نشطة للغاية لأنها عبارة عن ذرات كربون تحمل شحنة موجبة و محاطة بستة إلكترونات.
- تعمل الكربوكاتيون و فورا على الارتباط مع النيوكليوفيل.
- في التفاعلات أعلاه، يتم أولا إضافة الإلكتروفيل +H إلى الألكين لإنتاج الكربوكاتيون و من ثم يتحد الكربوكاتيون مع النيوكيوفيل.
- بالنسبة لمعظم الألكينات ، فإن الخطوة الأولى في هذه العملية – تشكيل الكربوكاتيون – هي الخطوة الأبطأ من بين الخطوتين اليسابقتين.
- عادةً ما يكون الكربوكاتيون الناتج نشطا جدا لدرجة أن الاتحاد مع النيوكليوفيل يكون سريعا للغاية. و نظرًا لأن الخطوة الأولى في هذه الإضافات هي الهجوم بواسطة الإلكتروفيل ، فإن هذه العملية برمتها تسمى تفاعل إضافة الإلكتروفيل.
10 – شرح قاعدة ماركوفنيكوف Markovnikov’s Rule Explained
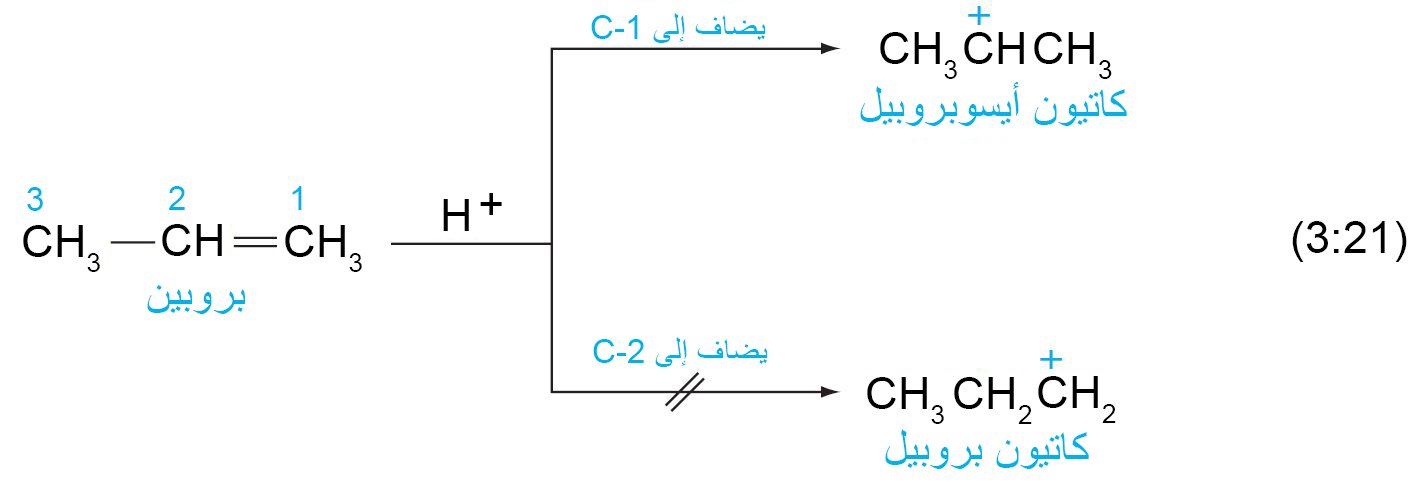
- في المثال الآتي نلاحظ أن البروتون (+H) قد تم إضافته إلى الكرون رقم 1 و ذلك طبقا لقاعدة ماركوفنيكوف.
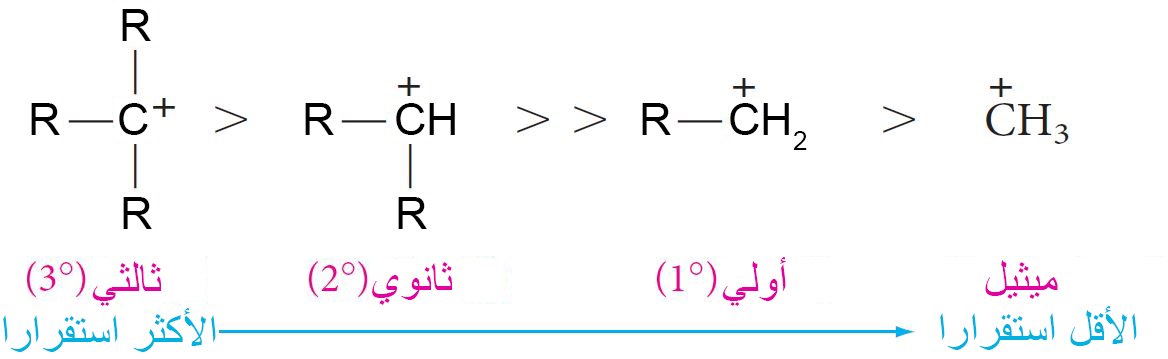
- يمكن أن تصنف الكربوكاتيونات إلى ثالثية و ثانوية و أولية و ذلك اعتمادا ما إذا كان متصل بذرة الكربون الموجبة ثلاث مجموعات أو مجموعتين أو مجموعة . و طبقا للعديد من الدراسات فقد تم تصنيف استقرارية الكربوكاتيونات تنازليا حسب تالترتيب الآتي:
- ممكن إعادة صياغة قاعدة ماركوفنيكوف بصيغة أحدث: عند إضافة كاشف غير متماثل إلى مركب غير متماثل يحتوي على رابطة ثنائية فإن الإضافة تتم بحيث تحقق أكثر استقرارا للكربوكاتيون.
11 – إتزان التفاعل: ما الذي يجعل التفاعل يتفاعل؟ Reaction Equilibrium:What Makes a Reaction Go?
- يمكن أن يسير التفاعل الكيميائية في اتجاهين ، إتجاه أمامي و إتجاه عكسي.
- يمكن كتابة الإتزان الكيميائي للتفاعل السابق حسب المعادلة الآتية:
يمكن كتابة الإتزان الكيميائي للتفاعل السابق حسب المعادلة الآتية:
- Keq ، هو ثابت الإتزان و الاحرف الصغيرة a و b و c و d هي عدد مولات المتفاعلت و النواتج في المعادلة الكيميائية الموزونة.
- إذا كان Keq أكبر من 1 ، فإن الاتجاه المفضل للتفاعل سيكون من اليسار إلى اليمين. أي تشكيل النواتج C و D.
- إذا كان Keq أقل من 1 ، فإن الاتجاه المفضل للتفاعل سيكون من اليمين إلى اليسار ، أي تشكيل المتفاعلات A و B.
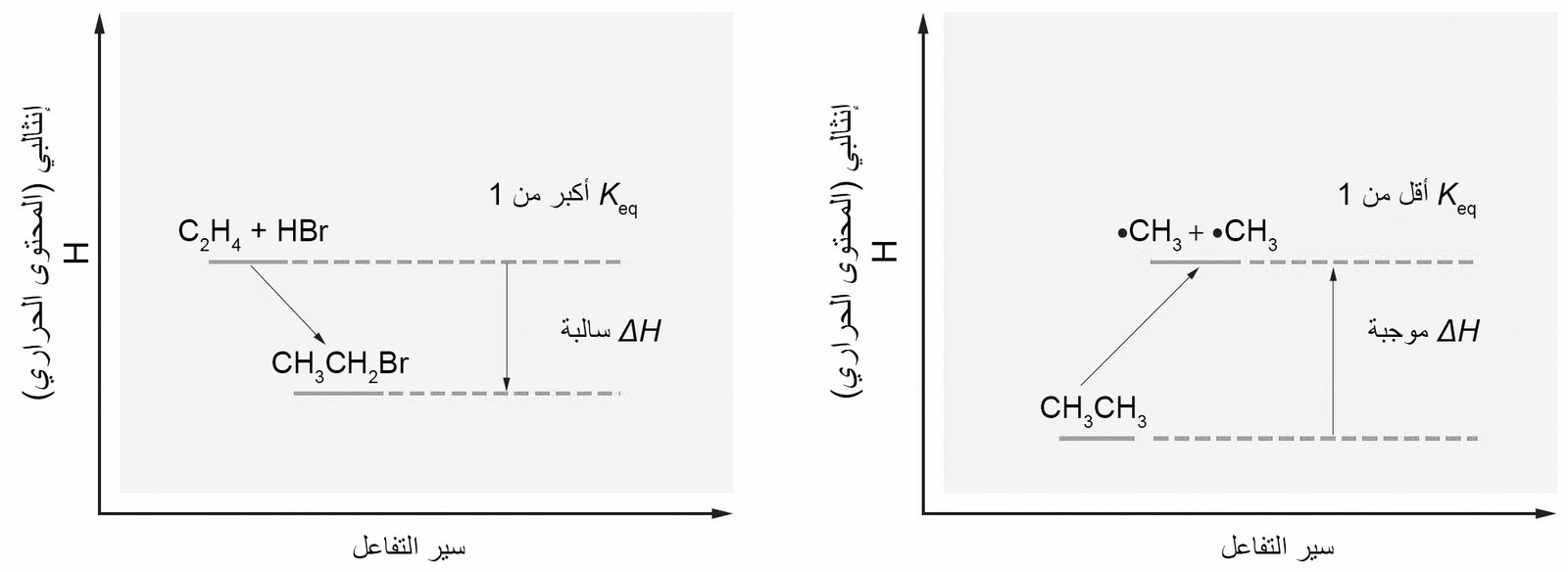
- إن التفاعل سيحدث عندما تكون للمواد الناتجة طاقة أقل (أكثر ثباتًا) من المواد المتفاعلة.
- في التفاعل الذي يكون فيه للمواد الناتجة طاقة أعلى من من المواد المتفاعلة فإنه سوف يسير نحو اليسار ، أي: نحو المواد المتفاعلة.
و عندما تكون للمواد الناتجة طاقة أقل من المواد المتفاعلة، فإنه يتم تحرير (إطلاق) حرارة أثناء التفاعل ، و بالتالي يكون هذا التفاعل طاردًا للحرارة. - إذا كان يجب إضافة حرارة إلى المواد المتفاعلة لإنتاج المواد الناتجة ، فإن التفاعل في هذه الحالة يكون تفاعلا ماصا للحرارة (يأخذ الحرارة).
- المصطلح المستخدم للطاقة الحرارية هو المحتوى الحراري (الإنثالبيا) ويتم الغشارة إليه بواسطة الرمز H.
- يتم تعيين الفرق في المحتوى الحراري بين النواتج والمتفاعلات بواسطة الرمز ΔH (تُقرأ بـ «دلتا H»).
- للتفاعل الطارد للحرارة فإن ΔH تكون سالبة و تكون قيمة Keq أكبر بكثير من 1. مثال: تفاعل الإيثين (C2H4) مع برويميد الهيدروجين (HBr) لإنتاج بروميد الإيثان (CH3CH2Br).
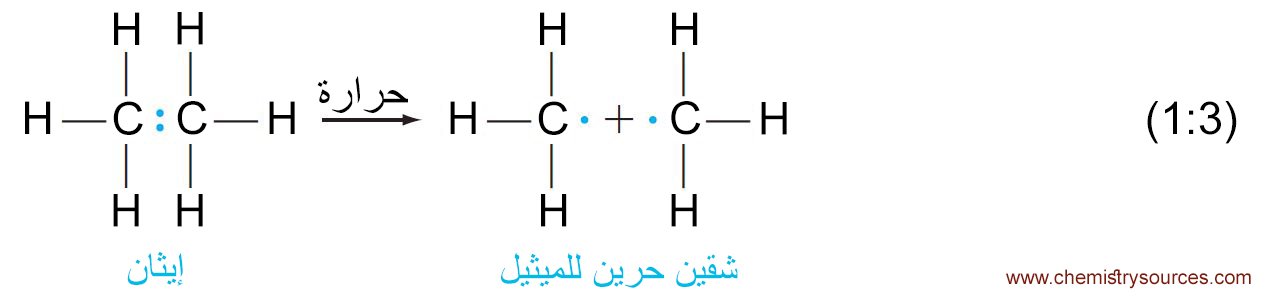
- للتفاعل الماص للحرارة فإن ΔH تكون موجبة و تكون قيمة Keq أقل بكثير من 1. مثال: انتاج شقي الميثيل من الإيثان .
12 – معدل سرعة التفاعل: ما مدى سرعة سير التفاعل؟
- إن ثابت الإتزان لا يخبرنا أي شيء عن معدل سرعة التفاعل. فمثلا ، يكون معدل إضافة HBr إلى الإيثين بطيئًا للغاية ، على الرغم من أن التفاعل طارد للحرارة.
- من أجل حدوث تفاعل:
- أ. يجب أن تصطدم الجزيئات مع بعضها البعض مع ما يكفي من الطاقة.
- ب. يجب أن تصطدم الجزيئات بالاتجاه الصحيح بحيث يمكن أن يحدث تكسير الروابط و تكوين روابط جديدة.
- فالطاقة اللازمة لهذه العملية تشكل حاجزًا للتفاعل ، وكلما زاد حاجز الطاقة ، كان التفاعل أبطأ.
- يستخدم الكيميائيون مخططات طاقة التفاعل لإظهار التغيرات في الطاقة و التي تحدث أثناء التفاعل.
- يوضح مخطط طاقة التفاعل التغيرات في الطاقة التي تحدث أثناء التفاعل. أما الحالة الانتقالية فهي بُنية ذات طاقة أقصى ما يمكن لخطوة معينة من التفاعل. و طاقة التنشيط ، Ea ، هي الفرق في الطاقة بين المواد المتفاعلة و الحالة الانتقالية ، و تحدد طاقة تنشيط معدل سرعة التفاعل.
- فمثلا يوضح الشكل المبين في الصفحة المقابلة الرسم التخطيطي لطاقة تفاعل إضافة حمض HBr إلى الإيثين.
- يحدث هذا التفاعل في خطوتين.
- أ. الخطوة الأولى: عندما يضاف البروتون (+H) إلى الرابطة الثنائية ، يتم كسر رابطة باي للألكين و تتشكل رابطة سيجما C ‒ H، فينتج مادة كربوكاتيون كمادة وسطية. و أثناء كسر الرابطة باي و تكوين رابطة سيجما جديدة فإنه يتم تشكيل تركيب لديه أعلى حد من الطاقة و تسمى هذه المرحلة بالمرحة الانتقالية للخطوة الأولى. و بالطبع لا يمكن استخلاص هذة البنية ويستمر في التقلب حتى يتم تشكيل منتج الكربوكاتيون بصورته النهائية أثناء الخطوة الأولى.
- يُطلق على الفرق في الطاقة بين الحالة الانتقالية و المواد المتفاعلة باسم طاقة التنشيط ، Ea. و هذه الطاقة هي من تحدد معدل سرعة التفاعل.
- إذا كانت قيمة Ea كبيرة ، فسيكون التفاعل بطيئًا. وإذا كانت قيمة Ea صغيرة فإن التفاعل يتم بسرعة.
ب. الخطوة الثانية: يتم تكوين رابطة سيجما جديدة بين البروم و الكربون. مرة أخرى يتم تشكيل تركيب انتقالي غير مستقر له طاقة عالية و تسمى هذه المرحلة باسم الحالة الانتقالية للخطوة الثانية. و يسمى الفرق في الطاقة بين الكربوكاتيون و الحالة الانتقالية هذه باسم طاقة التنشيط Ea للخطوة الثانية.
و بالطبع لا يمكن استخلاص هذه البنية ويستمر في التغير حتى يتم تكوين الرابطة سيجما بالكامل ، مما يؤدي بالنهاية إلى تكوين المنتج النهائي
- يتم تحديد معدل سرعة التفاعل من خلال أعلى حاجز طاقة ، Ea1. أما طاقة التنشيط الثانية ، Ea2 ، منخفضة جدًا مقارنة بالطاقة التنشيط للخطوة الأولى.
- الخطوة الأولى هي أبطأ الخطوتين ، ويتم تحديد معدل سرعة التفاعل بمعدل هذه الخطوة الأولى.
- إن الكاتيونات الاكثر استقرارا لها طاقة أقل من الكاتيونات الاقل استقرارا ويترتب على ذلك أن طاقة التنشيط Ea لتشكيل الكاتيونات الأكثر استقرارا أقل أيضًا.
فثلا ، عند إضافة H-Cl إلى البروبين، فإن كاتيون الأيسوبروبيل يكون أكثر استقرارا (أي أقل طاقة) من كاتيون البروبيل. - إن تشكيل كاتيون الأيسوبروبيل يتطلب طاقة تنشيط Ea منخفضة وبالتالي يتم تشكيل كربوكاتيون الأيسوبروبيل بسرعة أكبر من كاتيون البروبيل. ومن ثم ، فإن الانتقائية المكانية للإضافات الإلكتروفيلية هي نتيجة للخطوات الأولى التنافسية ، والتي يتشكل فيها الكربوكاتيون الأكثر ثباتًا بمعدل أسرع.العوامل الأخرى التي تؤثر على معدلات سرعة التفاعل هي درجة الحرارة والعوامل المحفزة. إن تسخين التفاعل بشكل عام يزيد من معدل التفاعل من خلال تزويد جزيئات المواد المتفاعلة مزيدا من الطاقة للتغلب على حواجز طاقة التنشيط.
- كما تعمل المحفزات على تسريع التفاعل من خلال توفير مسار أو آلية بديلة للتفاعل ، حيث تكون طاقة التنشيط أقل. و تلعب الأنزيمات هذا الدور في التفاعلات الكيميائية الحيوية.
13 – هيدروبرونة الألكينات Hydroboration of Alkenes
- الهيدروبرونة هي إضافة رابطة الهيدروجين-البورون H-B إلى الألكين.
- إن الرابطة الهيدروجين-البورون H-B مستقطبة حيث تحمل ذرة الهيدروجين −δ و تحمل ذرة البروم+δ .
- عندما تحدث عملية الإضافة فإن البورون (الإلكتروفيل) يتم إضافته إلى الكربون التي يتصل بها أكبر عدد ممكن من ذرات الهيدروجين .
- يشبه هذا التفاعل ، تفاعل الإضافة الإلكتروفيلية إلى الالكينات مع تطبيق قاعدة ماركوفنيكوف يحدث في خطوة واحدة ، أي أن جميع عمليات تكسير الروابط وصنع الروابط تحدث في خطوة واحدة.
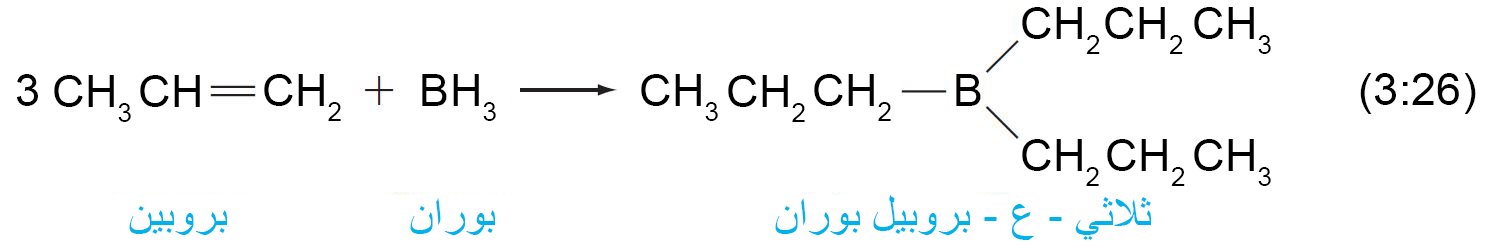
- و لكون الجزيء الواحد من BH3 يمتلك ثلاثة روابط B-H فإنه يمكنه أن يتفاعل مع ثلاثة جزيئات من الألكين و ينتج عن ذلك البورانات ثلاثية الألكيل.
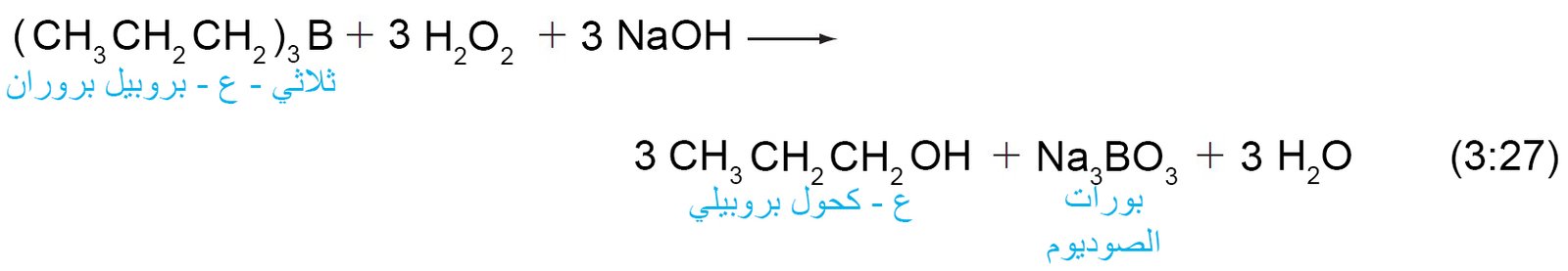
- يتم معالجة البورانات ثلاثية الألكيل مع بعض الكواشف الأخرى للحصول على المنتج النهائي المطلوب. على سبيل المثال ، يمكن أكسدة البورانات ثلاثية الألكيل بواسطة فوق أكسيد الهيدروجين وقاعدة لإنتاج الكحولات.
- إن ميزة هذا تسلسل حيث الهيدروبرونة – أكسدة هو أنه يوفر طريقة جديدة لإنتاج الكحول.
- من خلال هذا التفاعل ، يتم إضافة الماء إلى رابطة الكربون – الكربون الثنائية بطريقة عكس ما هو مطبق حسب قاعدة ماركوفنيكوف.
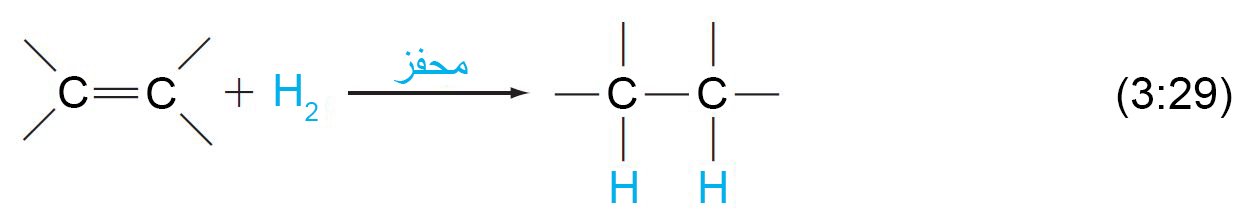
14 – إضافة الهيدروجين Addition of Hydrogen
- يُضاف الهيدروجين إلى الألكينات في وجود محفز مناسب. وتسمى هذه العملية الهدرجة.
- عادة ما تكون المادة المحفزة عبارة عن معدن مطحون جيدا ، مثل النيكل أو البلاتين أو البلاديوم.
تعمل هذه المعادن على امتصاص غاز الهيدروجين على أسطحها وتنشيط رابطة الهيدروجين – الهيدروجين.
تضاف ذرتي الهيدروجين عادة من سطح المادة المحفزة إلى الرابطة الثنائية .
- يتم استخدام الهدرجة تجاريًا لتحويل الزيوت النباتية إلى السمن النباتي وغيرها من الدهون.
15 – الإضافة إلى الأنظمة المترافقة
Addition to Conjugated
Systems
15. أ الإضافات الإلكتروفيلية إلى الدايينات المترافقة
- في الإضافة من نوع إضافة – 2،1 فإن الكاشف يضاف إلى الكربونات رقم 1 و 2، أما الإضافة من نوع إضافة – 4،1 فإن الكاشف يضاف إلى الكربونات رقم 1 و 4 .
- في البداية يتم إضافة البروتون إلى ذرة الكربون الطرفية طبقا لقاعدة ماركوفنيكوف.
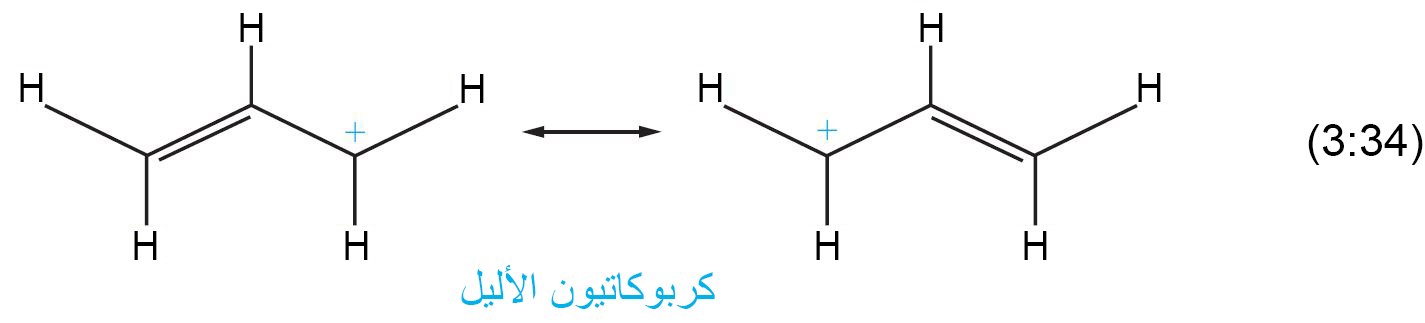
- يمكن جعل الكربوكاتيون أكثر استقرارا من خلال عملية الرنين.
- عندما يتفاعل الكربوكاتيون مع أيون البروميد ، فإن إيون البروميد يمكنه أن يتفاعل مع ذرة الكربون رقم 2 لإنتاج الإضافة من نوع إضافة – 2،1 أو أنه يتفاهعل مع ذرة الكرلبون رقم 4 لإنتاج الإضافة من نوع إضافة – 4،1 .
- إن الكاتيون الذي يكون فيه أيون الكربون الموجب الشحنة ملاصق للرابطة الثنائية بين الكربون-الكربون يطلق عليه اسم الأيون الأليلي.
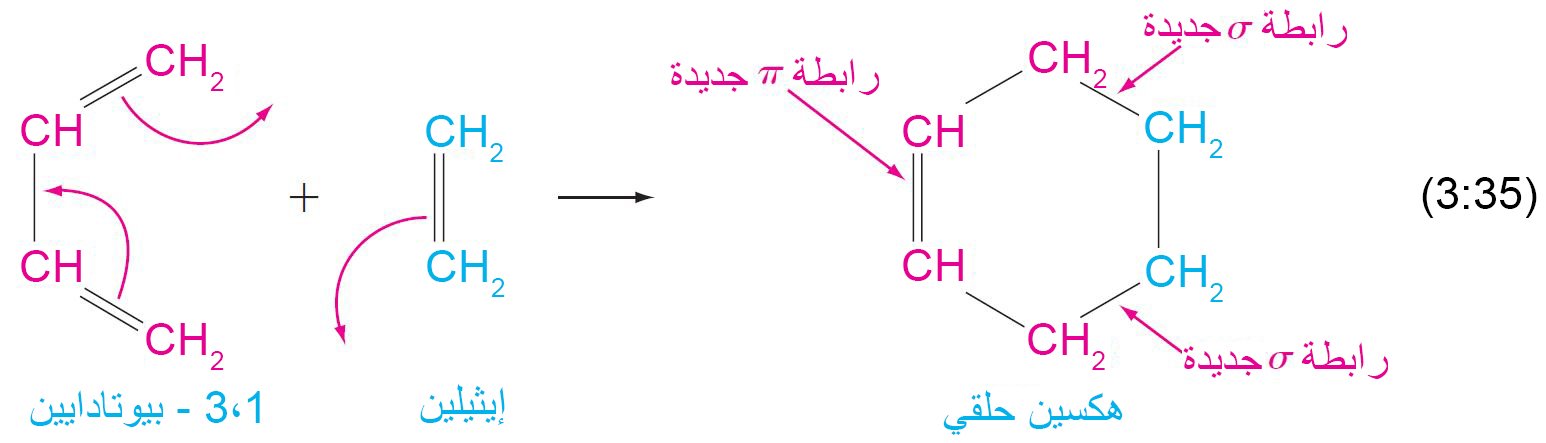
15. ب الإضافة الحلقي إلى الدايينات المترافقة: تفاعل دييلز- ألدير
- تفاعل الإضافة الحلقي هو تفاعل إضافة ينتج عنه تكون مركب حلقي.
- يسمى هذا النوع من الإضافة الحلقية باسم تفاعل دييلز-ألدر، بحيث في هذا التفاعل يتم تحويل ثلاثة روابط باي إلى رابطتي سيجما و رابطة باي جديدة.
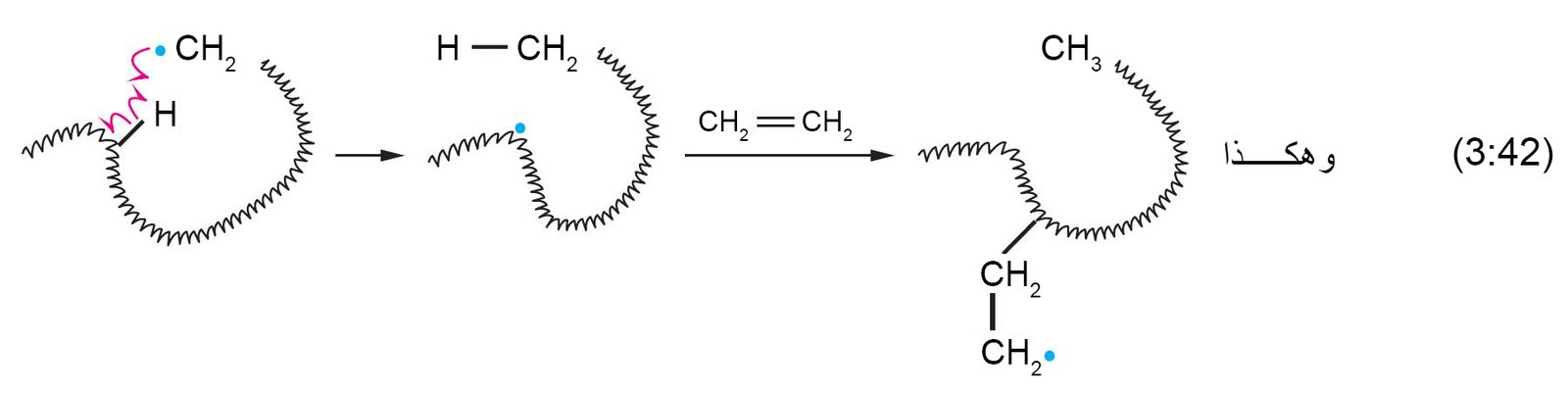
16 – إضافات الشقوق الحرة؛
متعدد الإيثيلين (البولي إثيلين) Free-Radical Additions;
Polyethylen
- يمكن إضافة بعض الكواشق إلى الألكينات من خلال ميكانيكية الشقوق الحرة بدلا من ميكانيكية الأيون.
- يمكن استخدام إضافة الشقوق الحرة لإنتاج المبلمرات (بوليمرات).
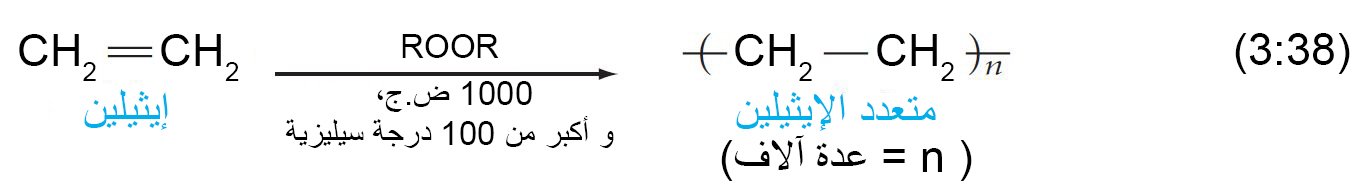
و المبلمر هو جزيء كبير الحجم يحتوي على وحدات مكررة مشتقة من جزيئات صغير تسمة المونوميرات. وتسمى عملية تكوين المبلمر باسم البلمرة. - ينتج عن بلمرة الشقوق الحرة للإيثيلين متعدد الإيثيلين (بولي إيثيلين) و تتم عملية البلمرة من خلال تسخين الإيثيلين تحت الضغط و بوجود عامل مساعد.
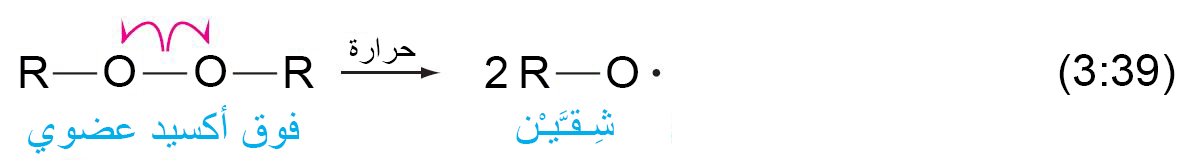
- العامل المساعد في البلمرة هو فوق أكسيد عضوي.
- عند تسخين العامل المحفز فإن الرابطة O-O تكسر و ينتقل إلكترون واحد إلى كل ذرة أكسجين.
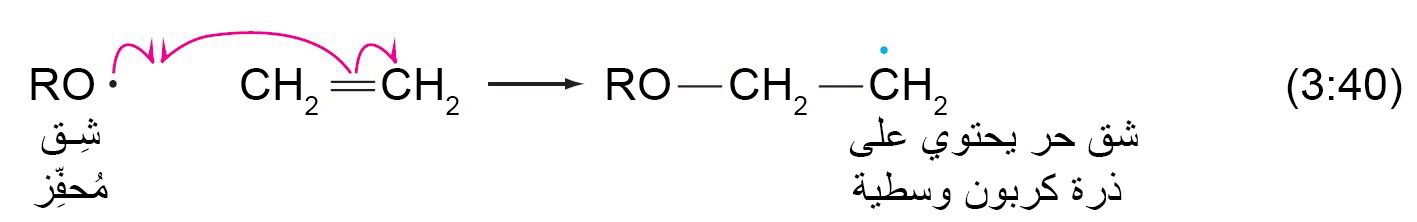
- و من ثم يتم إضافة الشق المحفز إلى الرابطة الكربون-الكربون الثنائية مكونا شق متمركز الكربون حر .
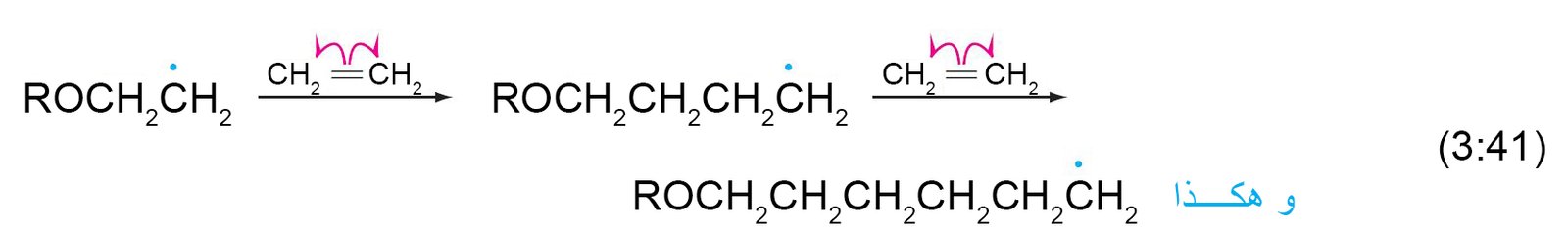
- يمكن إضافة شق متمركز الكربون الحر إلى جزيء إيثيلين آخر و آخر و هكذا.
- يمكن لسلسلة المبلمر المتنامية أن تستخلص ذرة هيدروجين من الطرف مما يحدث تفرع للسلسة.
17 – أكسدة الألكينات Oxidation of Alkenes
- الألكينات تتأكسد بسهولة أكثر من الألكانات من خلال العوامل المؤكسدة الكيميائية.
- تعمل تلك العوامل على مهاجمة إلكترونات باي في الرابطة الثنائية ، و يمكن استغلال هذا التفاعل للتأكد من وجود الرابطة الثنائية من عدمها أو لغايات التحضيرات العضوية.
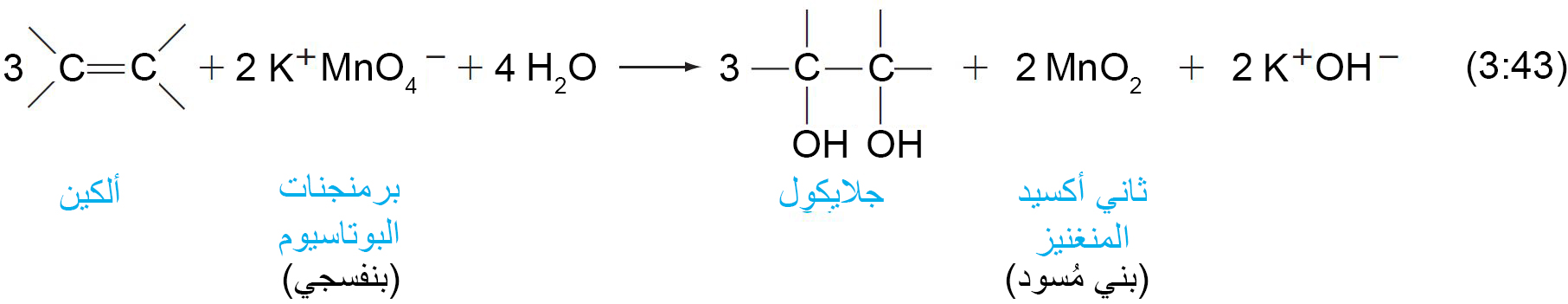
17. أ الأكسدة بالبرمنجنات، اختبار كيميائي.
- يمكن للألكينات أن تتفاعل مع محلول برمنجنات البوتاسيوم القاعدي و ينتج عن ذلك تكوُّن الجلايكولات (مركبات تحتوي على مجموعتي هيدروكسيل متجاورتين).
- يمكن استخدام هذا الاختبار الكيميائي لتمييز الألكينات (راسب بني مسود) عن الألكانات التي لا تتفاعل عادة مع برمنجنات البوتاسيوم.
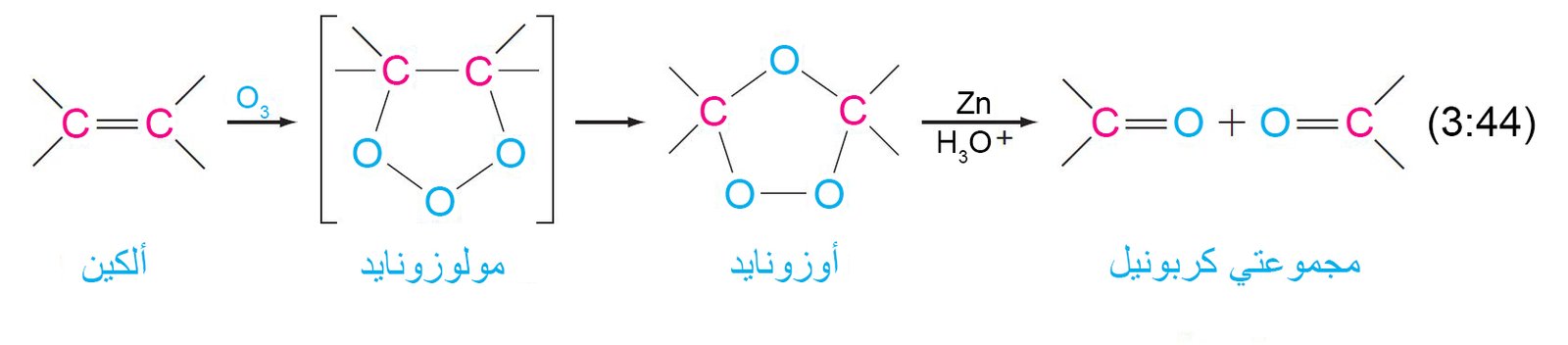
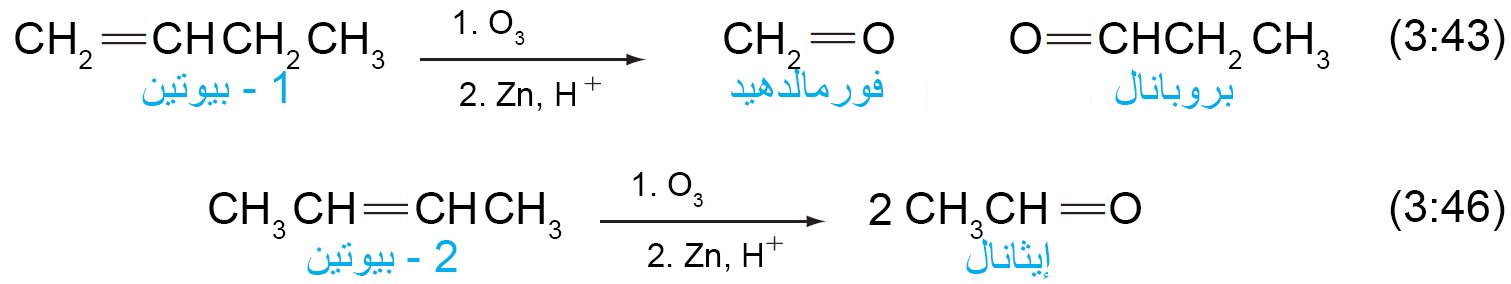
17. ب التحلل الأوزوني للأكينات.
تتفاعل الألكينات كميا و بسرعة مع الأوزون ، O3.
بعد ذلك ، يتم ضخ غاز الأوزون عند درجة حرارة منخفضة إلى محلول الألكين بوجود مذيب خامل ، مثل ثنائي كلوريد الميثان.
- في البداية ، يتشكل المولوزونايد عن طريق الإضافة الحلقية للأكسجين من كل طرف من جزيء الأوزون إلى الرابطة الثنائية للكربون والكربون والتي يُعاد ترتيبها لاحقًا وبسرعة إلى أوزونايد.
- إن مولوزونايد وأوزونايد مادتين متفجرتين إذا تم عزلهما، وبالتالي يتم معالجتهما مباشرة بعامل مختزل ، عادةً ما يكون الخارصين وحمض مائي ، لإنتاج مركبات الكربونيل كمنتجات يمكن استخلاصها.
- والنتيجة النهائية لهذا التفاعل هي كسر الرابطة الثنائية للألكين وتشكيل رابطين ثنائيتين من الكربون والأكسجين (مجموعات الكربونيل) ، كل واحدة مع كل ذرةالكربون من الرابطة الثنائية الأصلية. و تسمى العملية بالمجمل باسم التحلل الأوزوني.
17. ج أنواع أكسدة أخرى للأكينات.
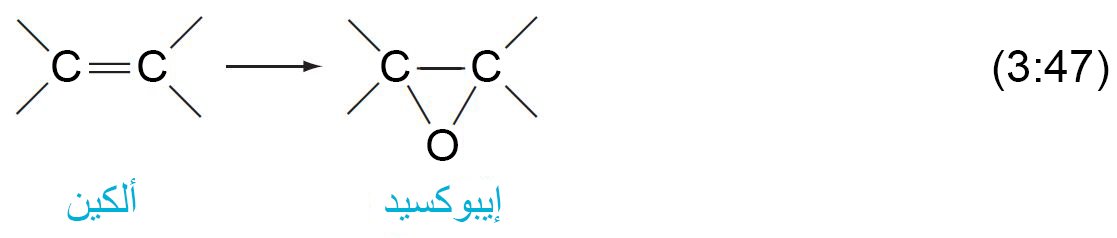
- يمكن للعديد من الكواشف أن تحول الألكينات إلى إبوكسيدات.
- يمكن أن تستخدم الألكينات كوقود. فالاحتراق الكامل للألكينات ينتج ثاني أكسيد الكربون و الماء.
18 – بعض الحقائق حول الرابطة الثلاثية Some Facts About Triple Bonds
- إن ذرة الكربون التي تشكل جزءًا من الرابطة ثلاثية تكون متصلة مباشرة بذرتين أخريين فقط ،و تكون زاوية الرابطة 180 درجة، كما هو الحال في جزيء الأسيتيلين C2H2.
- تبلغ مسافة الرابطة الثلاثية للكربون-الكربون حوالي 1.21 أنجستروم ، أي أقل بكثير من المسافة في معظم الروابط الثنائية (1.34 أنجستروم) أو الأحادية (1.54 أنجستروم).
- بسبب البنية الخطية ، لا يوجد تصاوغ مقرون-مفروق ممكن للألكينات.
19 – النموذج الفلكي للرابطة الثلاثية The Orbital Model of a Triple Bond
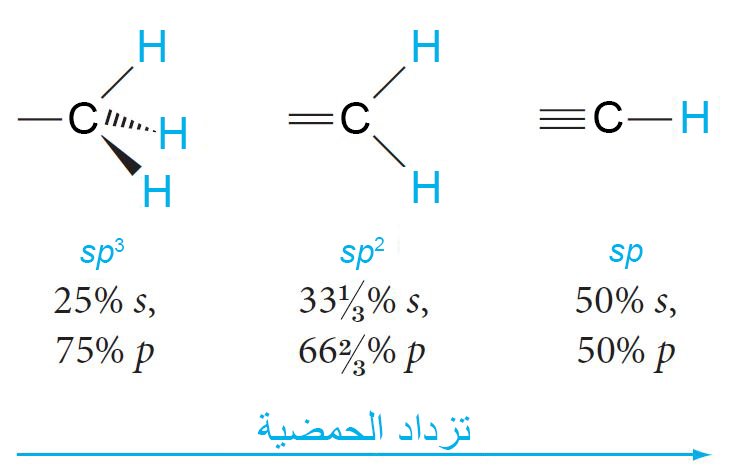
- في الأسيتيلين يكون التهجين الحاصل في ذرات الكربون من نوع sp.
- سوف يتحد فلك 2s مع فلك واحد من نوع 2p لتكوين فلكين مهجنين من نوع sp. وبالتالي سيكون لكل ذرة كربون فلكين مهجنين و فلكين غير مهجنين.
- ستشكل الأفلاك المهجنة رابطة سيجما وستشكل الأفلاك غير المهجنة رابطة باي.
- في الأسيتيلين يوجد ثلاثة روابط سيجما و رابطتي باي.
- تتشكل رابطة سيجما واحدة بين ذرتي الكربون عن طريق تداخل رأسي للأفلاك المهجنة sp-sp ، و يتم تشكيل رابطتي سيجما بين الفلك المهجن sp الهجين للكربون و الفلك s للهيدروجين بتداخل رأسي.
- إن الفلكين غير المهجنين py و pz يكونان عموديان على المستوى الجزيء ، أيضا يكونان عموديان على مستوى المحور x.
- يتداخل جانبيا الفلك غير المهجن py لأحد ذرتي الكربون مع الفلك غير المهجن py في ذرة الكربون المجاورة لتشكيل رابطة باي. و بالمثل يتداخل جانبيا الفلك غير المهجن pz لأحد ذرتي الكربون مع الفلك غير المهجن pz في ذرة الكربون المجاورة لتشكيل رابطة باي أخرى.
- إن التهجين الحاصل في كلا ذرتي الكربون هو من نوع sp بحيث يكون لكل منهما بنية خطية وبالتالي يكون للجزيء بنية خطية.
20 – تفاعلات الإضافة للألكاينات Addition Reactions of Alkynes
- إن العديد من تفاعلات الإضافة التي تم وصفها للأكينات يمكن أن تحدث أيضا مع الألكاينات و لكن عادة ببطء إلى حد ما. فمثلا يمكن للبروم أن تتم إضافته كما يلي:
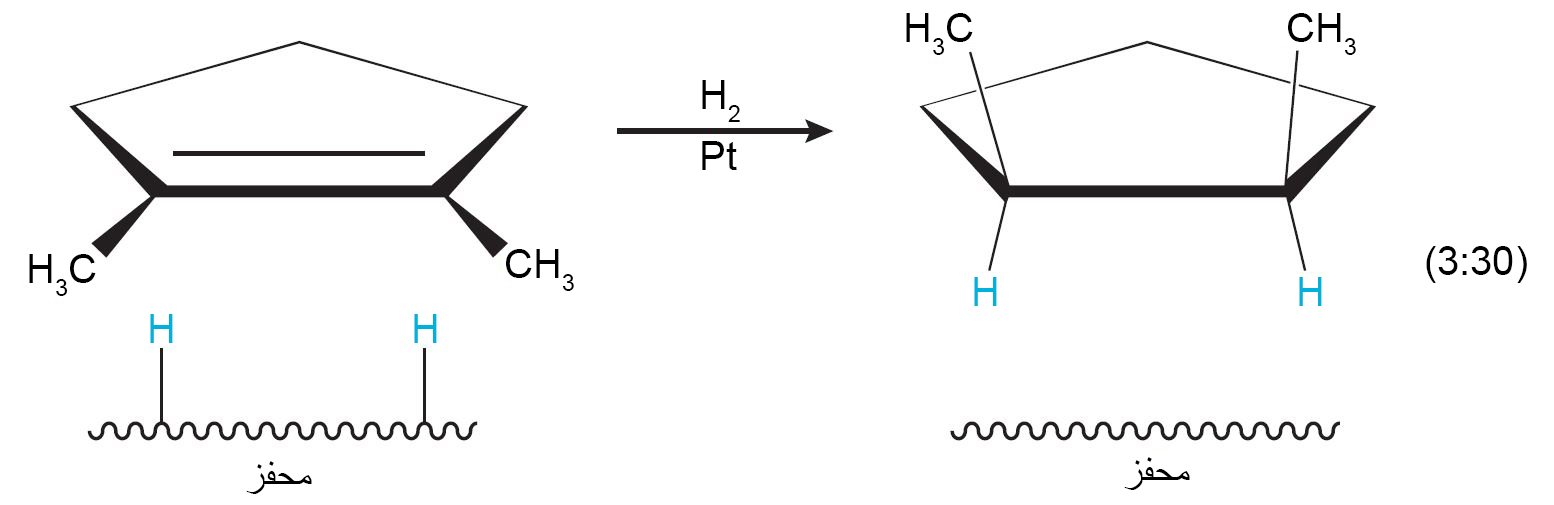
- مع محفز النيكل أو البلاتين العادي ، تتم هدرجة الألكينات بنفس طريقة الألكانات.
- مع وجود محفز خاص للبلاديوم (يُسمى محفز ليندلار) ، فقط تتم إضافة مول واحد من الهيدروجين و بالتالي يكون الألكين الناتج هو ألكين مقرون.
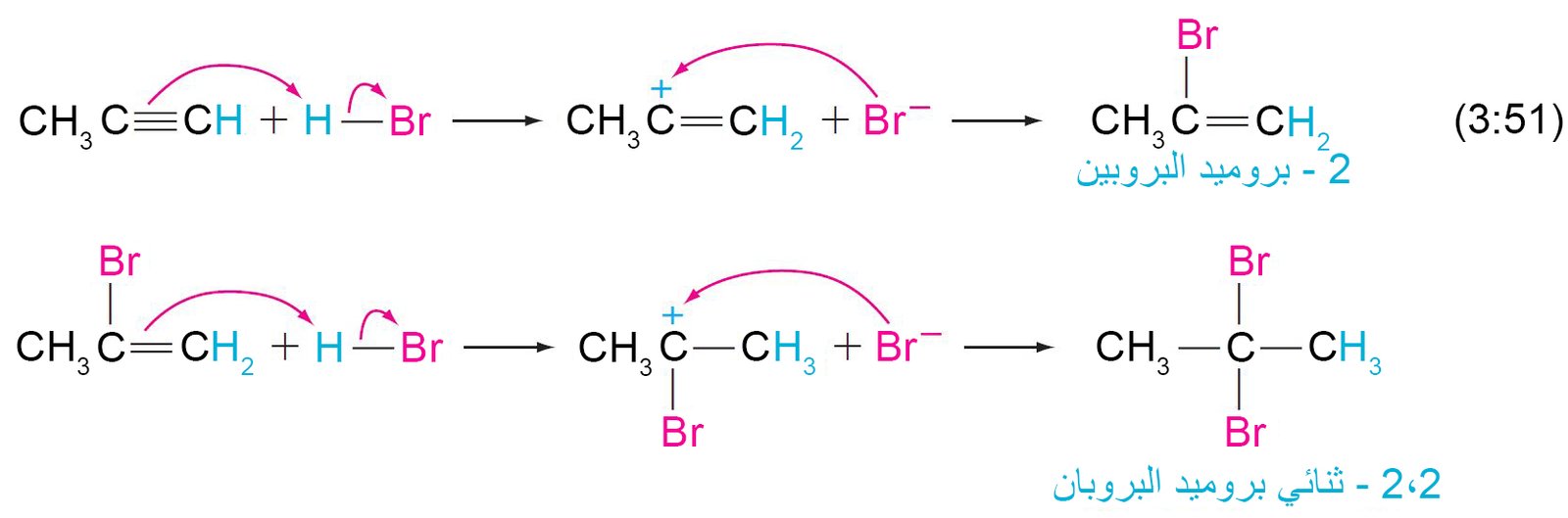
- مع الألكاينات غير المتناظرة و الكواشف غير المتناظرة، يتم تطبيق قاعدة ماركوفنيكوف في كل خطوة، كما هو مبين في الأمثلة الآتية:
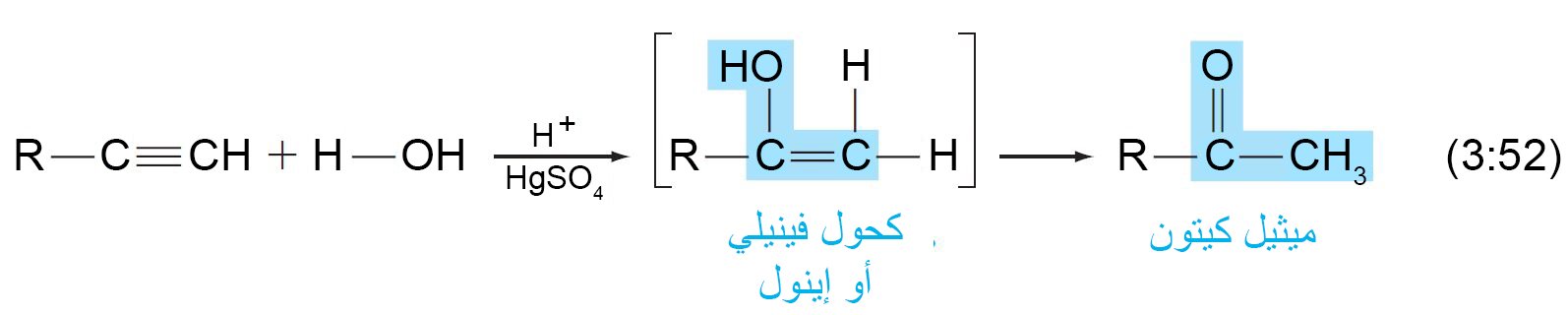
- تتطلب إضافة الماء إلى الألكاينات عامل محفز حمضي وأيون زئبق أيضًا.
- يشبه التفاعل كما هو الحاصل مع الألكينات ، ولكن المنتج الأولي – كحول فينيلي أو إنول – يعيد ترتيب نفسه لينتج مركب الكربونيل.
- الناتج في هذه الحالة ميثيل كيتون ، و في حالة الأسيتيلين يكون الناتج أسيتالدهيد.
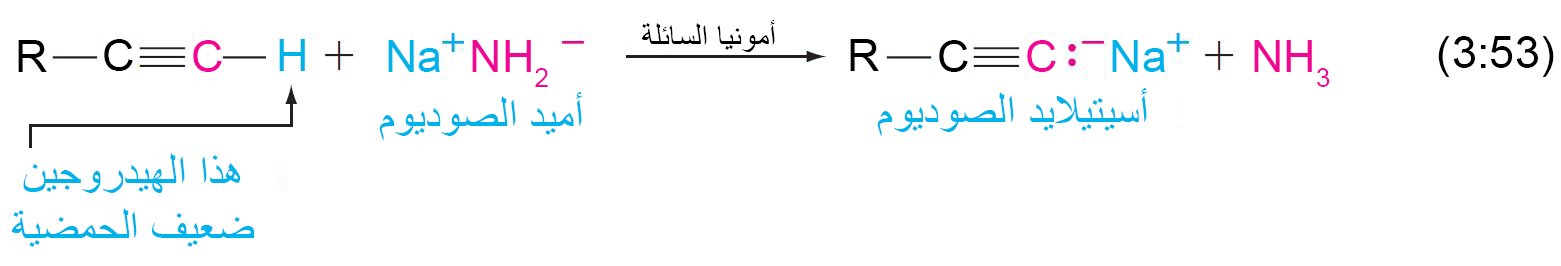
21- حمضية الألكاينات Acidity of Alkynes
- إن ذرة الهيدروجين المتصلة مع ذرة الكربون المرتبطة برابطة ثلاثية تكون حمضا ضعيفا ، و يمكن إزالتها بسهولة من خلال قاعدة قوية مثل أميد الصوديوم.
- يحدث هذا النوع من التفاعل بسهولة مع هيدروجين متصلة مع ذرتي كربون بينهما رابطة ثلاثية كربون-كربون (على سبيل المثال ، RC≡C ‒ H) ، ولكن أقل مع بوجود رابطة ثنائية أو أحادية.
- كلما زادت خصائص الفلك s في الرابطة تزداد حمضية الهيدروجين المرتبطة بها.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :