الإيثرات و الإيبوكسيدات (الفصل 8 ) Ethers and Epoxides
Posted in :
الإيثرات و الإيبوكسيدات Ethers and Epoxides : ملاحظة هامة: هذا المقال عبارة عن مختصر للفصل الثامن من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
ما هي الإيثيرات و الإيبوكسيدات؟
- الإيثرات هي مركبات بحيث يكون فيها مجموعتي ألكيل متصلتين بذرة أكسجين واحدة.
- الصيغة العامة للإيثيرات هي ‘R–O–R حيث R و ‘R مجموعتي ألكيل قد تكونا متشابهتين أو مختلفتين و قد تكونا أيضا مجموعات ألكيل أو مجموعات أريل.
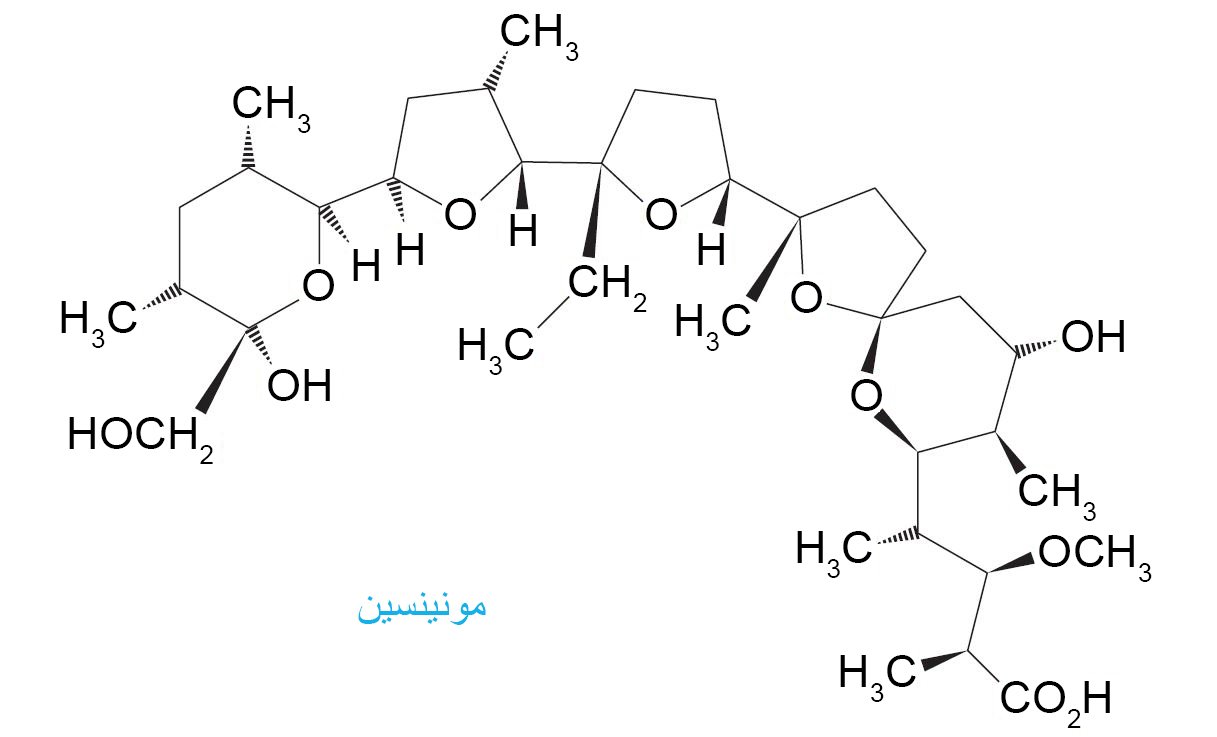
- فمثلا يحتوي المضاد الحيوي الطبيعي على المونينسين على المجموعة الوظيفية للإيثر.
- الإيبوكسيدات هي إيثرات حلقية تتكون من ثلاثة أضلاع ولها أهميتها في مجالالصناعات المختلفة.
1 – تسمية الإيثرات Nomenclature of Ethers
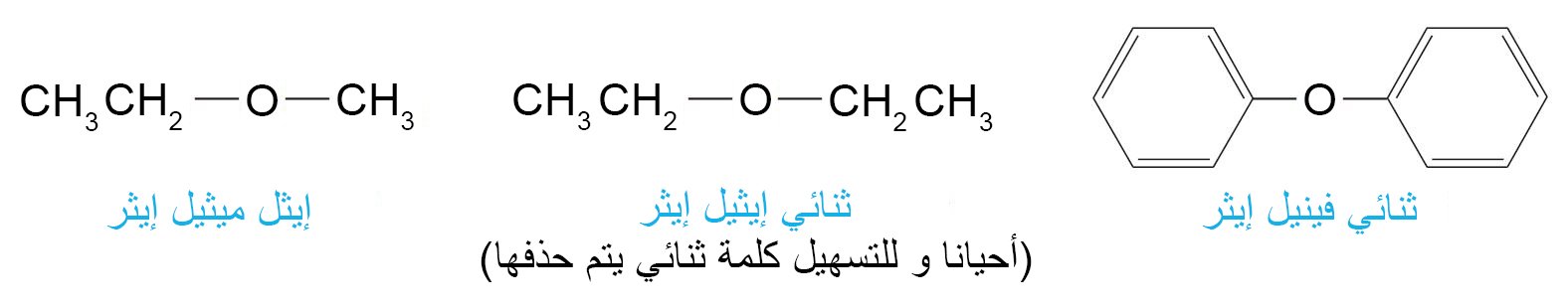
- يتم تسمية الإيثرات بذكر مجموعة الألكيل أو الأريل حسب الترتيب الهجائي و من ثم تلحق بكلمة إيثر.
- للإيثيرات التي لها تركيب معقد إلى حد ما، فإنه من الضروري تسمية مجموعة OR- كمجموعة ألكوكسي. و في نظام الأيوباك يتم تسمية مجموعة الألكوكسي الصغيرة كمجموعة بديلة.
2 – الخواص الفيزيائية للإيثرات Physical Properties of Ethers
- الإيثرات مركبات عديمة اللون و لها رائحة مميزة ، كما أن درجات غليانها منخفضة مقارنة مع الكحولات التي تساويها بعدد ذرات الكربون.
- للإيثرات درجات غليان مقارنة لدرجات غليان الهيدروكربونات المقابلة لها حيث تم استبدال مجموعة الأكسجين في الإيثرات بمجموعة –CH2– في الهيدروكربونات.
- لا يمكن للإيثرات أن تكون روابط هيدروجينية مع معضها البعض لغياب روابط H-O فيها.
- يمكن للإيثرات أن تكون روابط هيدروجينية مع الكحولات.
- الإيثرات ذات الأوزان الجزيئية المنخفضة يمكن بسهولة أن تذوب في الماء.
- الإيثرات أقل كثافة من الماء.
3 – الإيثرات كمذيبات Ethers as Solvents
- الاثيرات هي مركبات خاملة نسبيا، فهي لا تتفاعل عادة مع الحموض المخففة أو القواعد المخففة ، أو مع العوامل المؤكسدة و العوامل المختزلة الشائعة .
- لا تتفاعل الإيثرات مع فلز الصوديوم.
- معظم المركبات العضوية قابلة للذوبان في الأثير ، مما يجعل الإيثرات مذيبات ممتازة للقيام بالتفاعلات العضوية.
- تُستخدم الإيثرات أيضًا في استخراج المركبات العضوية من مصادرها الطبيعية ، على سبيل المثال ثنائي لإيثيل أثير.
- إذا تعرضت الإيثرات للهواء ، فقد تحتوي على بيروكسيدات كنتيجة لتفاعل الأكسدة، و التي هي قابلة للانفجار و يجلب إزالتها قبل أن يتم استخدام الإيثر بأمان.
4 – كاشف جرينيارد، مركب عضوي فلزي The Grignard Reagent; an Organometallic Compound
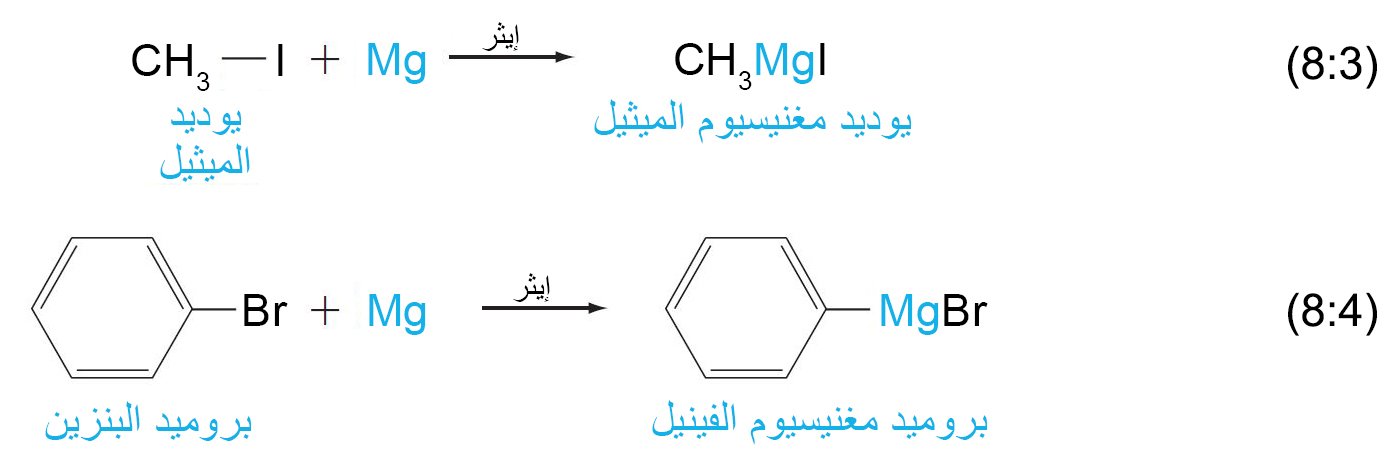
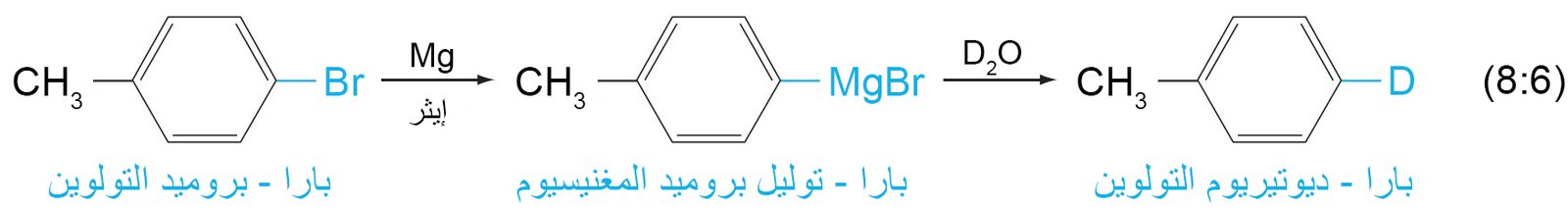
- كواشف جرينيارد عبارة عن هاليدات ألكيل أو أريل المغنيسيوم و تحضر عن طريق تفاعل المغنيسيوم مع هاليد الألكيل أو هاليد الأريل في وجود الإيثر.
- يلعب الإيثر دورا هاما في تحضير كاشف جرينيارد لأن زوج الإلكترون غير الرابطة على أكسجين الأثير يساعد على تثبيت المغنيسيوم من خلال التنسيق.
- لن يتشكل كاشف جرينيارد إلا إذا كان الإيثر جافًا تمامًا ، وخاليًا من آثار الماء أو الكحول.
- تتم تسمية كواشف جرينيارد كما هو موضح في المعادلات التالية:
- تتفاعل كواشف جرينيارد كما لو أن مجموعة الالكيل أو الأريل سالبة الشحنة (كربانيون أو أيون كربوني) و ذرة المغنيسيوم موجبة الشحنة.
- الكربانيون (الأيون الكربوني) مجموعة ألكيل أو أريل تكون فيها ذرة الكربون سالبة الشحنة. و تعتبر الكربانيونات قواعد قوية.
- تتفاعل كواشف جرينيارد بعنف مع حتى الحموض الضعيفة أو مع أي مركب آخر يوجد ه رابطة OH أو SH أو NH .
- من خلال استخدام كاشف جرينيارد ممكن إدخال نظير للترميز إلى المركب العضوي.
- إن كواشف جرينيارد هي مركبات عضوية فلزية.
- و المركبات العضوية الفلزية هي مركبات عضوية تحتوي على رابطة كربون-فلز. أما المركبات العضوية الليثيومية في مركبات تحتوي على رابطة كربون-ليثيوم.
5 – تحضير الإيثرات Preparation of Ethers
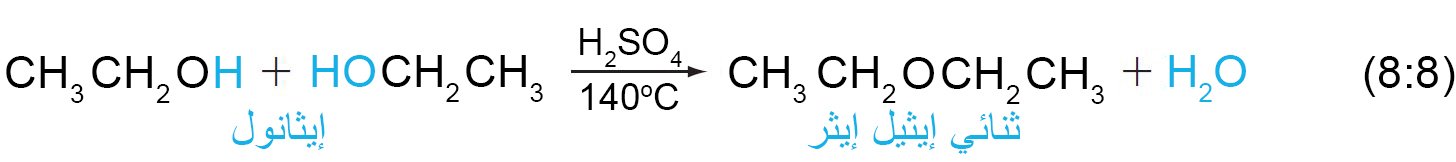
- يمكن تحضير ثنائي إيثيل إيثر من تفاعل الإيثانول مع حمض الكبريتيك.
- يمكن تحضير ثلاثي بيوتيل ميثيل إيثر (MTBE) من خلال إضافة الميثانول إلى 2-ميثيل بروبين بوجود حمد كعامل حفاز.
- تحضر الإيثرات غير المتماثلة بواسطة تحضير ويليامسون.
- تتكون طريقة ويليامسون من خطوتين:ا.
الخطوة الأولى: يتم تحويل الكحول إلى الألكوكسيد الخاص به من خلال معالجته بفلز نشط (الصوديوم أو البوتاسيوم) أو هيدريد فلزي.
الخطوة الثانية ، يتم حدوث إزاحة من نوع SN2 بين الألكوكسيد و هاليد ألكيل.
6 – شطر (تقسيم) الإيثرات Cleavage of Ethers
- في الإيثرات زوجين من الإلكترونات غير المشتركة على ذرة الأكسجين وبالتالي فهي قواعد لويس. فهي تتفاعل مع الحموض القوية و حموض لويس مثل هاليدات البورون.
- إذا كانت مجموعات الالأكيل R و/أو ‘R أولية أو ثانوية، فإن الرابطة المتصلة بالأكسجين يمكن كسرها من خلال نيوكليوفيل قوي مثل –I أو –Br ( من خلال مسار SN2 ):
- إذا كانت مجموعات الالأكيل R و/أو ‘R ثالثية ، فلا داعي لوجود النيوكليوفيل القوي لأتن التفاعل سوف يسير من خلال ميكانيكية SN1 أو E1 .
7 – الإيبوكسيدات أو الأوكسيرانات Epoxides or Oxiranes
- الإيبوكسيدات (أو الأوكسيرانات) هي إيثرات حلقية تتكون من حلقة ثلاثية الأضلاع تحتوي على ذرة أكسجين واحدة.
- أهم ايبوكسيد تجاري هو أكسيد الإيثيلين الذي ينتج عن الأكسدة الهوائية للإثيلين المحفز بفلز الفضة.
- في العادة يمكن تحضير الأيبوكسيدات الأخرى عن طريق تفاعل الألكين مع حمض فوق أكسيدي ( أو فوق حمض للتسهيل)
- تُعد الحموض فوق الأكسيدية عوامل مؤكسدة جيدة، و المثال عليها فوق حمض الخليك و ميتا كلوريد فوق حمض البنزويك.
8 – تفاعلات الإيبوكسيدات Reactions of Epoxides
- إن الإيبوكسيدات أكثر نشاطا من الإيثرات العادية بسبب التوتر الموجود في الحلقة ثلاثية الاضلاع.
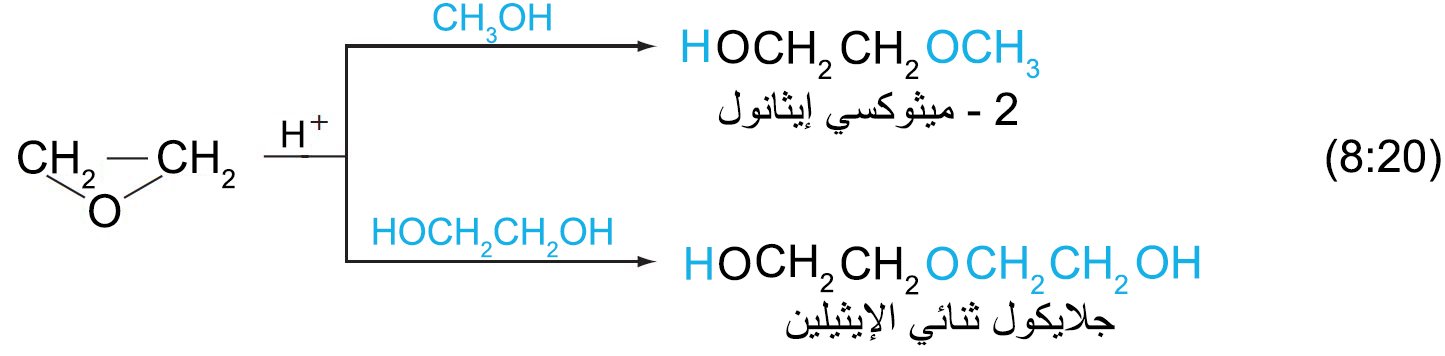
- في تفاعلات الإيبوكسيدات تفتح الحلقة و ينتج عن ذلك مركبات جديدة.
- كما يمكن إضافة نيوكيوفيلات أخرى إلى الإيبوكسيدات بنفس الطريقة.
- يمكن كسر حلقة أكسيد الإيثيلين بتفاعلها مع كاشف جرينيارد.
9 – الإيثرات الحلقية Cyclic Ethers
- الإيثرات الحلقية هي مركبات حلقية تتكون من أضلاع أكثر من ثلاثة أضلاع كما هو الحال في الإيبوكسيدات.
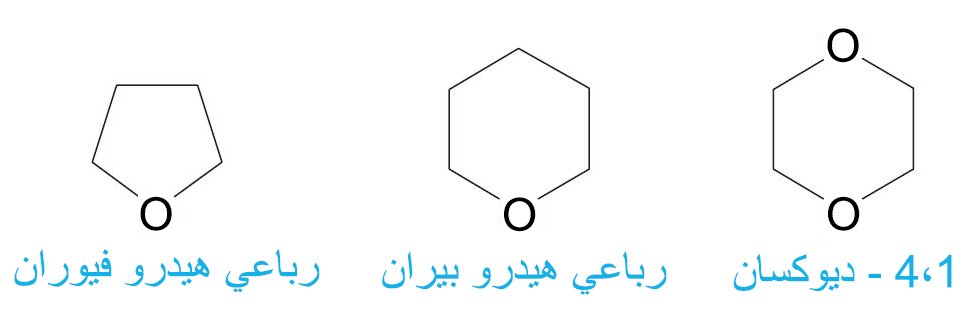
- من الإيثرات الحلقية الهامة رباعي هيدرو فيوران (THF) ورباعي هيدرو بيران و 4،1 – ديوكسان.
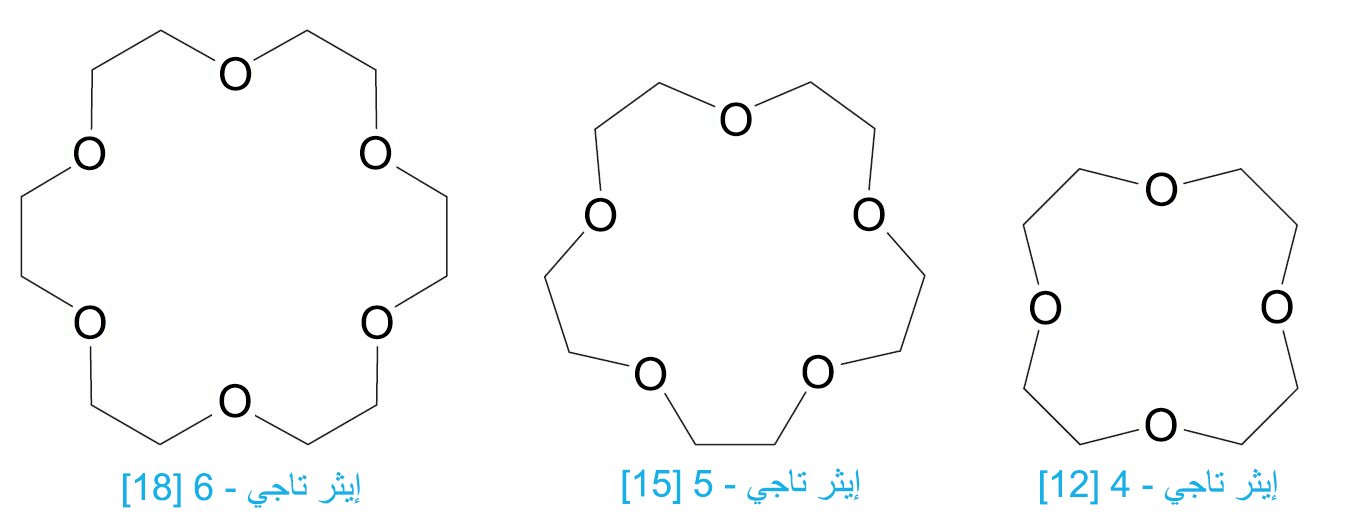
- و أيضا هناك مركبات حلقية كبيرة متعددة الإيثرات و تعرف باسم الإيثرات التاجية.
- الإيثرات التاجية هي مركبات حلقية كبيرة متعددة الإيثرات شكلها يشبه شكل التاج و يمكنها تشكيل المعقدات مع الأيونات الموجبة ( +Na و +K و هكذا ).
- إن قابلية تشكيل المعقدات هذه قوية للغاية بحيث يمكن للمركبات الأيوينة أن تذوب في المذيبات العضوية التي تحتوي على الإيثر التاجي. فمثلا برمنجنات البوتاسيوم قابل للذوبان في الماء و لكنه لا يذوب في البنزين، و لكن إذا ما تم تذويب dicyclohexyl[18]crown-6 في البنزين فإنه يستخلص برمنجنات البوتاسيوم من الماء إلى البنزين ! و يصبح لون البنزين بنفسجيا حيث يحتوي البنزين في هذه الحالة أيونات برمنجنات حرة غير ذائبة.
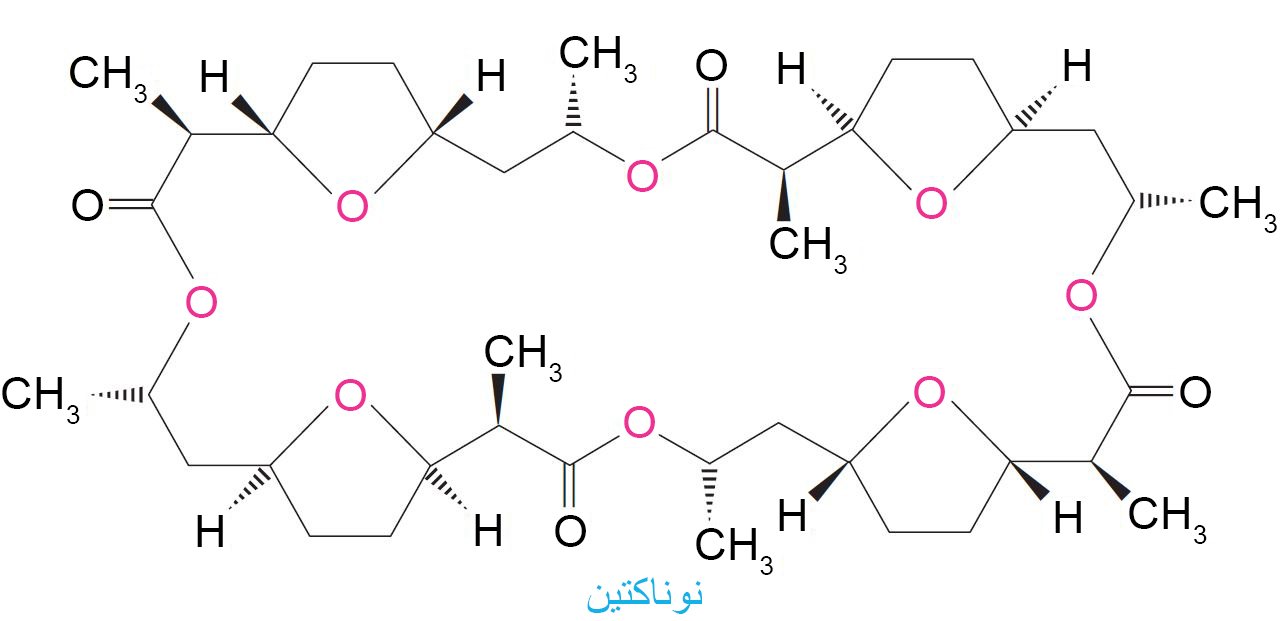
- كما أن الارتباط الانتقائي للأيونات الفلزية من قبل المركبات الحلقية الكبيرة له أهميته في الطبيعة، فمثلا يعمل المضاد الحيوي النوناكتين على الارتباط مع أيونات البوتاسيوم +K (رغم وجود أيونات الصوديوم +N أيضا) في الأوساط المائية ، مما يتسبب بانتقال انتقائي لأيونات +K خلال غشاء الخلية.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
2 thoughts on “الإيثرات و الإيبوكسيدات (الفصل 8 ) Ethers and Epoxides”
Leave a Reply Cancel reply
This site uses Akismet to reduce spam. Learn how your comment data is processed.

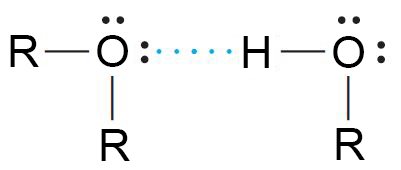
















كيف يتفاعل حمض الكبريت مع الايثرات وفق المعادلات ؟
عند تفاعل حمض الكبريتيك المركز مثلا مع ثلاثي بيوتيل ميثيل إيثر t-butyl methyl ether فإنه ينتج عن ذلك ايسوبيوتيلين isobutylene و الميثانول Methanol
كما أنه عندما يمرر تيار من البخار على ثنائي إيثيل إيثر Diethyl ether بوجود حمض الكبريتيك المخفف و ضغط ينتج عن ذلك كحول إيثيلي Ethyl alcohol