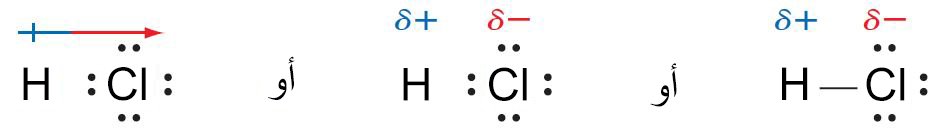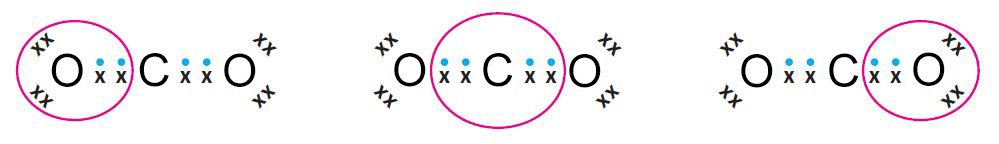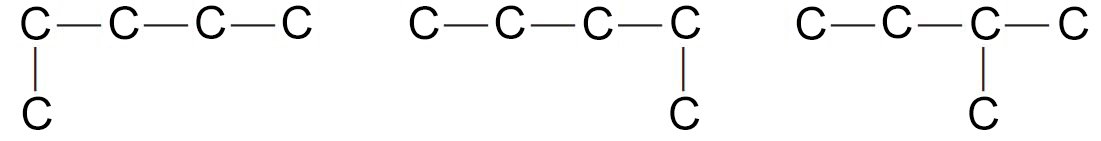الترابط و التصاوغ Bonding and Isomerism
Posted in :
الترابط و التصاوغ Bonding and Isomerism : ملاحظة هامة: هذا المقال عبارة عن مختصر للفصل الأول من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
الترابط و التصاوغ Bonding and Isomerism
1 – كيف تتوزع الإلكترونات في الذرات How Electrons Are Arranged in Atoms
- تحتوي الذرات على نواة صغيرة و كثيفة موجبــة الشحنة وتحتوي النواة على بروتونات موجبة الشحنة و نيوترونات متعادلة.
- يحاط بالنواة الإلكترونات.
- تحتوي النواة على أغلب كتلة الذرة.
- في الذرة المتعادلة، يتم موازنة الشحنة الموجبة للنواة بالشحنة السالبة للإلكترونات التي تساويها عدديا بالضبط والتي تدور حولها.
- العدد الذري للعنصر يساوي عدد البروتونات في النواة أو عدد الإلكترونـــــات التي تدور حـــــــول النــــــواة في الذرة المتعادلة.
- العدد الكتلي يساوي تقريبا مجموع عدد البروتونات و عدد النيوترونات في النواة.
- إن عدد و تتوزيع الإلكترونات حول النواة يحددان الأساس لكيفية تفاعل الذرة مع الذرات الأخرى لتكوين الجزيئات.
- العناصر الخفيفية هي التي لها أهميتها الكبرى في الجزيئات العضوية.
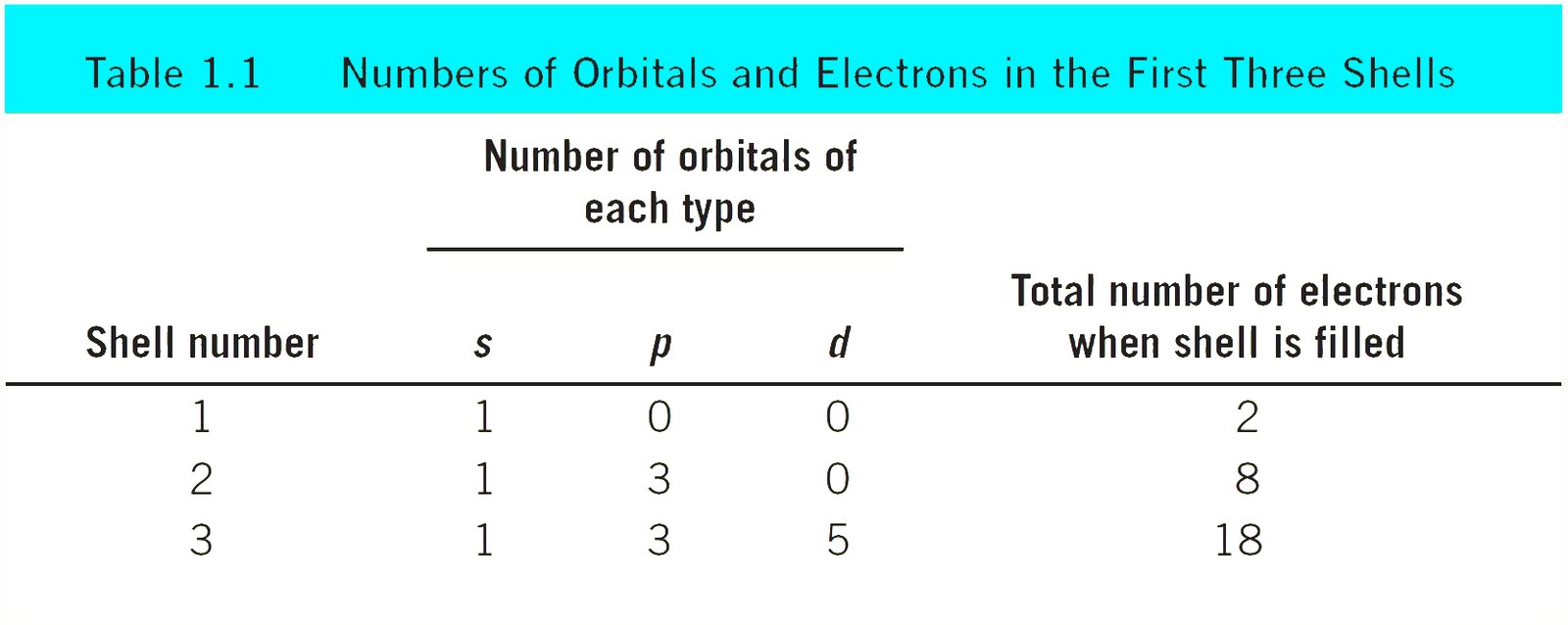
تتمركز الإلكترونات في مناطق محددة حول النواة تسمى الأفلاك.
كل فلك يحتوى على إلكترونين بحده الأقصى. - تختلف الأفلاك من حيث الشكل و عادة يرمز لها بالرموز s و p و d .
تتجمع الافلاك ضمن مستويات يرمز لها بالأعداد 1 و 2 و 3 وهكذا .
كل مستوى يحتوي على عدد مختلف من الأفلاك طبقا لرقم المدار .
فمثلا يحتوى المستوى رقم 1 على الفلك 1s و يحتوى المستوى رقم 2 على الفلكين 2s و 2p و يحتوي المستوى رقم 3 على الأفلاك 3s و 3p و 3d. - تُرتب العناصر ضمن مجموعات في الجدول الدوري و بخلاف الهيليوم فإن أعداد تلم المجموعات مساوية لعدد إلكترونات التكافؤ.
- توجد إلكترونات التكافؤ في المستوى الاخير للذرة . أما لُبّ الذرة فيحتوي على النواة و الإلكترونات الداخلية.
2 – الرابطة الأيونية و الرابطة التساهمية Ionic and Covalent Bonding
- تم اقتراح نظرية الترابط الكيميائي في العام 1916 من قبل العالم جيلبيرت نيوتن لويس.
- لاحظ لويس أن عدد الإلكترونات في ذرة الغاز الخامل الهيليوم يساوي 2 و عدد الإلكترونات التي تدور حول النواة في ذرة النيون يساوي 10 .
- طبقا لهذه النظرية فإن ذرات تلك الغازات تمتلك توزيع إلكتروني مستقر جدا.
- و اقترح أيضا أن الذرات سوف تتفاعل فيما بينها للوصول إلى التوزيع الإلكتروني الاكثر أستقرارا لها.
- و يمكن تحقيق هذه الاستقرارية من خلال طريقين : إما عن طريق نقل كامل للإلكترونات من ذرة لأخرى أو عن طريق مشاركة الإلكترونات بين الذرات.
2.1. أ المركبات الأيونية
- تتكون الروابط الأيونية نتيجة لانتقال إلكترون واحد أو أكثر من إلكترونات التكافؤ من ذرة إلى أخرى.
- الإلكترونات التي تمنح الإلكترونات تصبح أيونات موجبة الشحنة ، أي أنها تصبح كاتيوناً.
- الذرة التي تستقبل الإلكترونات تصبح أيونات سالبة الشحنة، أي أنها تصبح أنيوناً.
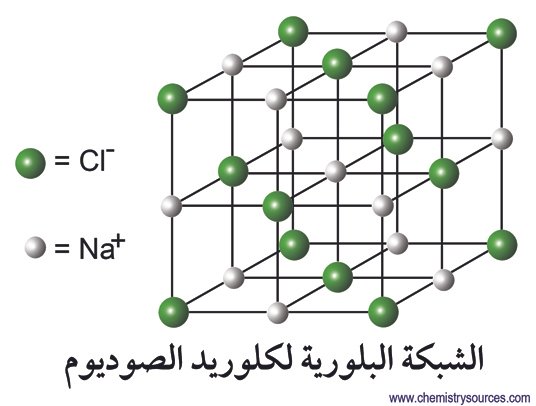
- مثال على المركبات الأيونية : مركب كلوريد الصوديوم NaCl .
- تمتلك ذرة الصوديوم إلكترون تكافؤ وحيد ، وعندما تقوم بمنح هذه الإلكترون ، فإن التوزيع الإلكتروني للصوديوم سوف يكون مشابها للتوزيع الإلكتروني للنيون، وتصبح موجبة الشحنة، أي أنها تصبح كاتيون صوديوم.
- تمتلك ذرة الكلور سبعة إلكترونات تكافؤ، و من خلال استقبال إلكترون واحد إضافي، سوف يصبح التوزيع الإلكتروني للكلور مشابها للتوزيع الإلكتروني للأرجون، و يصبح الكلور سالب الشحنة، أي: أنيون كلوريد.
- فالذرات مثل الفلزات و التي تميل إلى منح الإلكترونات يقال عنها بأنها كهروموجبة.
- الذرات مثل اللافلزات و التي تميل إلى استقبال الإلكترونات يقال عنها بأنها كهروسالبة.
- إن ناتج المعادلة رقم 1-1 هو كلوريد الصوديوم و هو مركب أيوني مكونا من أعادا متساوية من أيونات الصوديوم و أيونات الكلوريد.
- تتكون المركبات الأيونية عندما تتفاعل الذرات الكهروموجبة القوية مع المركبات الكهروسالبة القوية مع بعضها البعض.
- تتماسك الأيونات في بلورة المادة الأيونية مع بعضها البعض من خلال قوى التجاذب بين الشحنات المخالفة بالشحنة.
- الرابطة الأيونية ليست رابطة بالمعنى الحقيقي على الإطلاق حيث أنة الأيونات تجذب بعضها البعض كما تجذب أقطاب المغناطيس بعضها البعض.
- عندما يتم تذويب المادة الأيونية في الماء، فإن الأيونات تنفصل عن بعضها البعض و يكون لديها القدرة على التحرك في المحلول بحرية.
2.1. ب الرابطة التساهمية
- العناصر التي ليست كهروسالبة قوية أو كهروموجبة قوية أو التي لها كهروسالبية متشابهة تقريبا، فغنها تميل إلى تكوين روابط كمن خلال مشاركة أزواج الإلكترونات بدلا من أن يتم منحها أو استقبالها بالكامل.
- تتطلب الرابطة التساهمية مشاركة متبادلة لإلكترون واحد أو أكثر بين الذرات.
- عندما تكون ذرتين متطابقتين أو متساويتين في الكهروسالبية، فإن أزواج الإلكترونات يتم مشاركتها بالتساو ، مثال : جزيء الهيدروجين.
- يمكن اعتبار كل ذرة هيدروجين بأنها قد ملئت مسواها الإلكتروني الاول من خلال عملية المشاركة. أي أن يمكن اعتبار أن كل ذرة «تمتلك» كل الإلكترونات التي تشارك بها مع الذرة الأخرى ، كما هو موضح في الدوائر الحمراء في الشكل أدناه .
- عندما يتم تكوين جزيء الهيدروجين فإن ذلك يصاحبة تحرير للحرارة ، و هذه الحرارة (الطاقة) مساوية لتلك اللازمة لتكسير الرابطة بين ذرتي الهيدروجين .
- لتفكيك مول واحد من جزيئات الهيدروجين إلى ذرات هيدروجين فإنه يلزمنا حرارة قدرها 104 كيلوكالوري (أو 435 كيلوجول) .
- تعرف الطاقة اللازمة لكسر الرابطة باسم طاقة الرابطة و هي تختلف باختلاف الروابط بين الذرات المختلفة.
- إن الرابطة H-H رابطة قوية جدا ، لأن زوج الإلكترونات يكون مرتبطا بقة من قبل نواتي ذرتي الهيدروجين.
- فهناك تنافر بين النواتين المتشابهتين في الشحنة، و تنافر أيضا بين الإلكترونات المشحونة، و هنا يتولد توازن بين قوى التنافر و قوى التجاذب.
- و عليه فإن ذرات الهيدروجين لا تنفصل عن بعضها البعض و لا تندمج مع بعضها البعض.
- فذرات الهيدروجين تبقة متصلة مع بعضها البعض و تهتز ضمن مسافة متزنة ، و يطلق على هذه المسافة اسم طول الرابطة .
- فلجزيء الهيدروجين فإن طول الرابطة ( أي أن متوسط المسافة بين نواتي ذرتي الهيدروجين) تساوي 0.74 أنجستروم.
- يعتمد طول الرابطة في الترابط التساهمي على:
- أ – الذرات الداخلة في الرابطة
- ب – عدد أزواج الإلكترونات التي تم مشاركتها بين الذرات.
3 – الكربون و الرابطة التساهمية Carbon and the covalent Bond
- عادة نرمز لذرة الكربون بالرمز:
- حيث يمثل الرمز C إلى لُبّ الذرة ( النواة بالإضافة إلى إلكتروني الفلك 1s ) و تمثل النقاط الزرقاء إلكترونات التكافؤ.
- إن غلاف التكافؤ للكربون نصف ممتليء ( أو نصف فارغ).
- ليس لذرات الكربون قابلية قوية لفقدان جميع إلكتروناتها و قابلية قوية لإكتساب أربعة إلكترونات . أي أن الإلكترون ليس كهروموجب قوي و لا كهروسالب قوي.
- يميل الكربون إلى تكوين روابط تساهمية مع الذرات الاخرى عن طريق مشاركة الإلكترونات. فمثلا ترتبط ذرة الكربون مع أربعة ذرات هيدروجين من خلال مشاركة أربعة أزواج من الإلكترونات ، فتكون المادة الناتجة عن ذلك هو الميثان.
- كما يمكن للكربون مشاركة أزواج الإكترونات مع أربعة ذرات كلور ناتجا عن ذلك مركب رباعي كلوريد الميثان.
- من خلال مشاركة أزواج الإلكترونات فإن الذرات تكمل مستويات التكافؤ الخاصة بها بالإلكترونات.
- في الأمثلة المبينة أدناه يكون الكربون محاطا بثمانية إلكترونات تكافؤ.
4 – روابط الكربون – الكربون الأحادية Carbon-Carbon Single Bonds
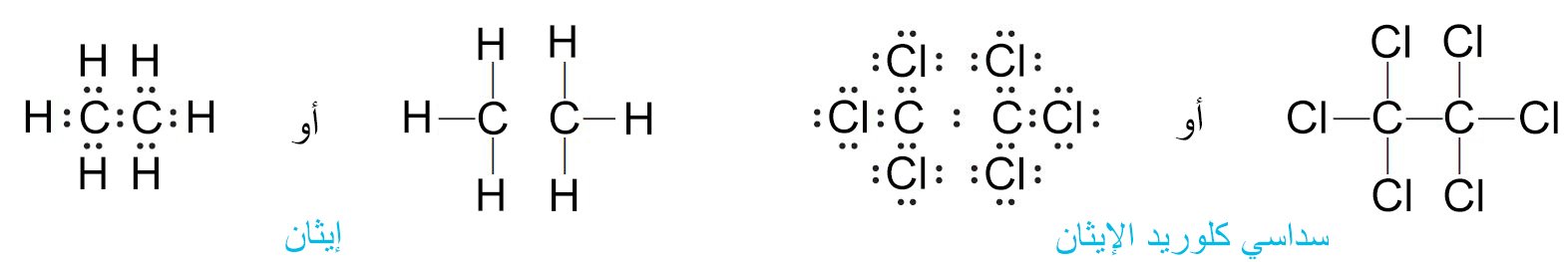
- إن الخاصية المميزة لذرات الكربون هي قابليتها لمشاركة الإلكترونات مع العناصر المختلفة و مع ذرات الكربون أيضا. و المثال على ذلك مركب الإيثان و مركب سداسي كلوريد الإيثان.
- إن الرابطة بين ذرتي الكربون في الإيثان رابطة تساهية نقية ، بحيث تم مشاركة الإلكترونات بين ذرتي الكربون المتطابقتين بالتساوي .
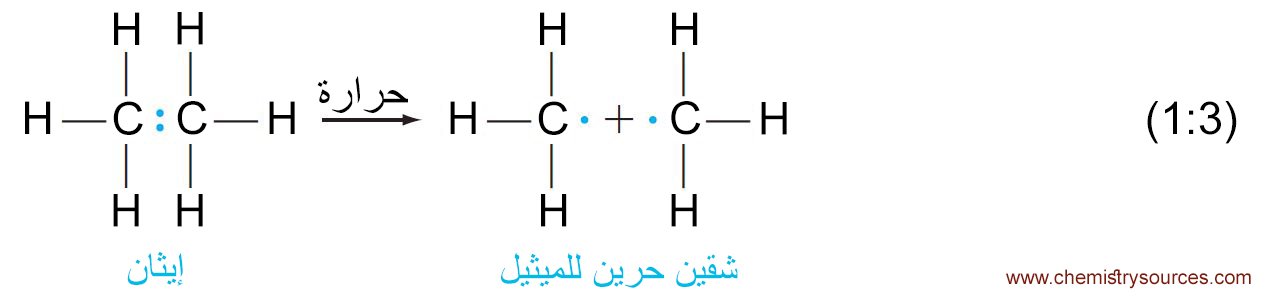
- فالحرارة اللازمة لتكسير الرابطة الكربون-الكربون في مركب الإيثان تعطي شَقَيّ ميثيل CH3 متطابقين .
فالشق هو كسر جزيئي يحتوي على إلكترونات فردية غير رابطة (حرة) . - فرابطة الكربون-الكربون في الإيثان (1.54 أنجستروم) أطول من رابطة الهيدروجين-الهيدروجين (0.74 أنجستروم) و إلى حد ما أضعف و بالتالي تحتاج إلى طاقة أقل لأن تُكسر الرابطة الكربون-الكربون في الإيثان مقارنة مع تلك اللازمة لكسر الرابطة الهيدروجين-الهيدروجين في جزيء الهيدروجين.
- تعتبر عملية كسر الرابطة الكربون-الكربون بالحرارة الخطوة الأولى في تقطير البترول و التي تعتبر طريقة هامة عند صناعة الجازولين.
- التسلسل هي قدرة العنصر على تكوين سلاسل من ذراته من خلال الترابط التساهمي.
5 – الرابطة التساهمية القطبية Polar covalent bond
- إذا اختلفت الذرات عن بعضها البعض فإن زوج الإلكترونات قد لا يتم مشاركته بالتساوي بينها.
- و مثل هذه الرابطة تسمى أحيانا بالرابطة التساهمية القطبية لأن الذرات الداخلة في هذه الرابطة تحمل شحنة سالبة جزئية و شحنة موجبة جزئية.
- المثال على الرابطة التساهمية القطبية هو مركب كلوريد الهيدروجين لأن ذرات الكلور أكثر كهروسالبية من ذرات الهيدروجين، وبالتالي ينزاح زوج الإلكترونات نحو الكلور و الذي يصبح إلى حد ما أكثر سالبية مقارنة مع الهيدروجين.
- و يمكن الإشارة إلى استقطاب هذه الرابطة من خلال سهم رأسه يشير إلى الطرف السالب و ذيله معلم بإشارة الزائد. أو باسلوب آخر، عادة ما يتم الإشارة للشحنة الجزئية الموجبة بالرمز و للشحنة السالبة الجزئية بالرمز (و تقرأ «زائد دلتا» و «ناقص دلتا»)، كما هو مبين أدناه.
- فزوج إلكترونات الرابطة و الذي تمت مشاركته بعدم تساوٍ، يكون منزاحا أكثر جهة الكلور.
- كلما انتقلنا من اليسار إلى اليمين في الدورة الواحدة في الجدول الدوري تصبح العناصر أكثر كهروسالبية، و كلما انتقلنا في المجموعة الواحدة من أعلى لأسفل تصبح العناصر أقل كهروسالبية.
- كلما زادت الكهروسالبية زادت الشحنة النووية على النواة و التي تعمل على جذب إلكترونات التكافؤ بقوة نحوها.
- في الشكل المبين أدناه فإن كل الذرات التي على جهة اليمين في جميع الروابط أدناه سوف تكون سالبة بالنسبة إلى الذرات الموجودة جهة اليسار.
6 – الروابط التساهمية المتعددة Multiple Covalent Bonds
- لإكمال عدد الإلكترونات في مستويات التكافؤ، يمكن للذرات في بعض الأحيان أن تتشارك بأكثر من زوج إلكتروني واحد. و المثال على ذلك ثاني أكسيد الكربون.
- في البُنية (التركيب) أ، تمثل النقاط الإلكترونات من الكربون و الإكسات x تمثل الإلكترونات من الأكسجين.
- فتُظهر البنية ب، الروابط و الإلكترونات غير الرابطة التي على ذرة الاكسجين.
- أما البنية ج، تظهر الروابط التساهمية فقط. هنا تم مشاركة زوجين من الإلكترونات بين الكربون و الاكسجين، و عليه فإن الرابطة التي بينهما تسمى رابطة ثنائية .
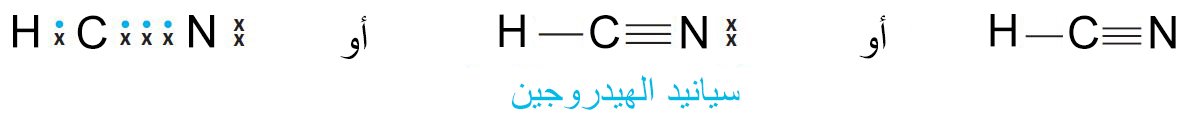
- يعتبر سيانيد الهيدروجين HCN مثالا لمركب بسيط يحتوي على رابطة ثلاثية، حيث تم مشاركة ثلاثة أزواج من الإلكترونات.
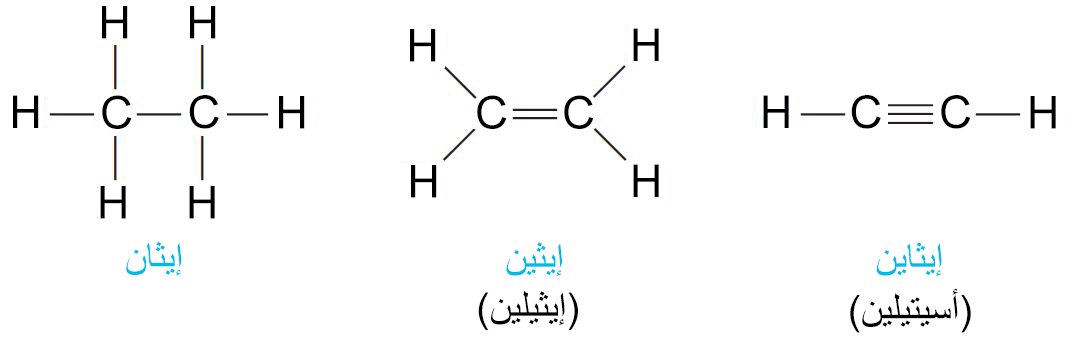
- يمكن لذرات الكربون أن ترتبط مع بعضها البعض بروابط أحادية أو ثنائية و أيضا ثلاثية.
- المركبات المبينة أعلاه تختلف عن بعضها البعض في نوع الرابطة بين ذرتي الكربون حيث أحادية أو ثنائية أو ثلاثية على الترتيب كما أنها تختلف أيضا بعدد ذرات الهيدروجين.
- لتلك المركبات أيضا إختلافا في النشاط الكيميائي بسبب اختلاف عدد الروابط بين ذرتي الكربون فيها.
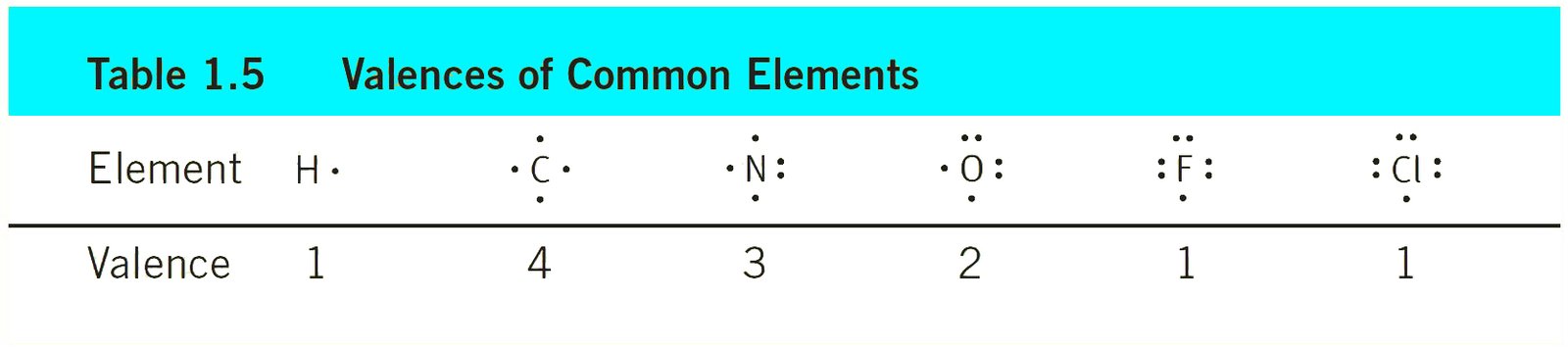
7 – التكافؤ Valence
- إن تكافؤ العنصر هو عدد الروابط التي يمكن لذرة ذلك العنصر أن تكونها.
- و عدد التكافؤ يكون بالعادة مساويا لعدد الإكترونات اللازمة لملء غلاف التكافؤ.
- هناك فرق بين عدد إلكترونات التكافؤ و عدد التكافؤ. فمثلا: للأكسجين ستة إلكترونات تكافؤ، بينما تكافؤه يساوي 2 فقط.
- إن مجموع العددين (أي عدد إلكترونات التكافؤ و عدد التكافؤ) يساوي مجموع عدد الإلكترونات في المستوى الممتليء بالكامل.
8 – التصاوغ Isomerism
- تخبرنا الصيغية البنائية كيفية ترتيب الذرات في المركب.
- الصيغة البنائية لـ H2O تعطينا معلومات حول الترابط بين الذرات و تخبرنا أن ذرتي الهيدروجين ترتبطان مع ذرة الأكسجين (و ليس مع بعضها البعض).
- إن الجزيئات التي لها نفس عدد الذرات و تختلف في الترتيب الفراغي تسمى المصاوغات.
- المصاوغات البُنيوية (أو البنائية) هي مركبات لها نفس عدد الذرات في الصيغة الجزيئية و لكن تختلف في الصيغة البنائية.
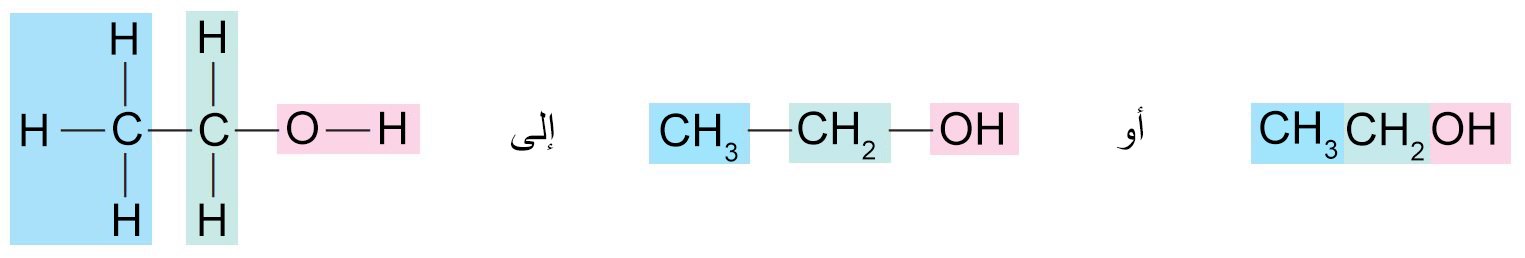
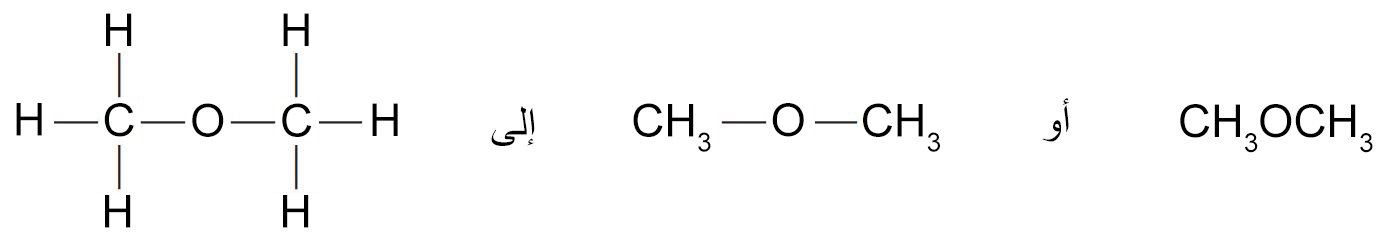
- هناك مركبين معروفين جيدا لهما نفس الصيغة الجزيئية و هي C2H6O، أحد المركبين عباره عن سائل عديم اللون و يغلي عند درجة حرارة 78.5 سيليزية، بينما الآخر عبارة عن غاز عند درجة حرارة الغرفة. (درجة غليانه -23.6 سيليزية)
- إن الإيثانول و ميثوكسي الميثان هما مثالا على التصاوغ البنيوي. فلهما نفس عدد الذرات و لكنها يختلفان في الصيغة البنائية.
- نتيجة لذلك يختلف الإيثانول و ميثوكسي الميثان في الخواص الفيزيائية و الكيميائية نتيجة لاختلافهما في البنية الجزيئية.
9 – كتابة الصيغ البنائية Writing Structural Formulas
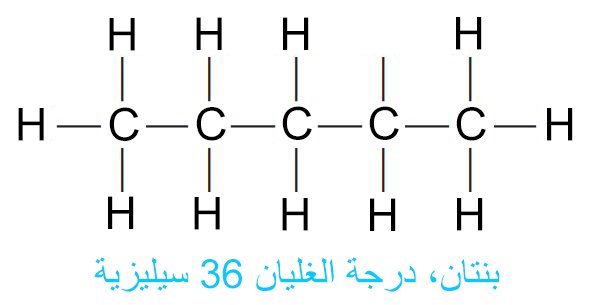
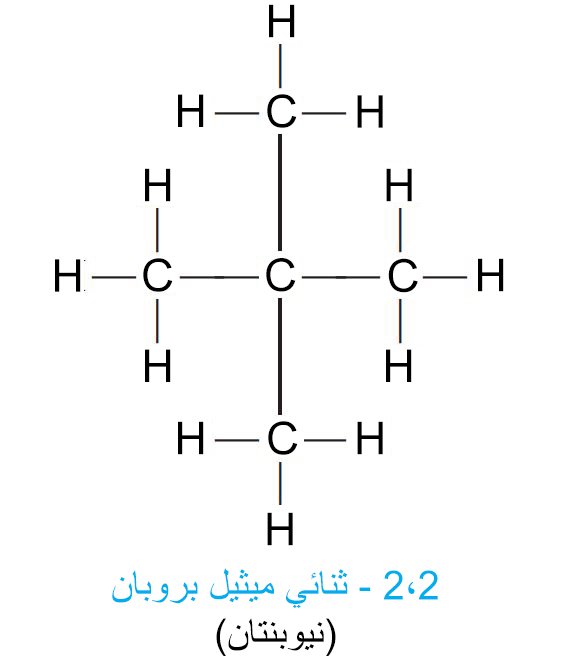
- افترض أننا نريد أن نكتب جميع الصيغ البنائية المحتملة المتعلقة بالمركب ذو الصيغة الجزيئية C5H12. في البداية نقوم بكتابة جميع ذرات الكربون الخمسة ضمن سلسلة واحدة متصلة.
- فكل ذرة كربون طرفية تحتاج الى ثلاث ذرات هيدروجين للوصول الى عدد التكافؤ، كما أن كل ذرة كربون وسطية تحتاج الى ذرتي هيدروجن للوصول على عدد التكافؤ. و عليه يمكن كتابة الصيغة البنائية في هذه الحالة كما يلي:
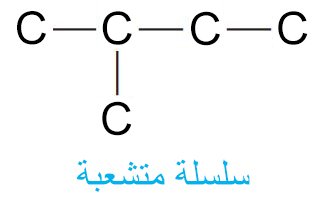
- لكتابة سلاسل متشعبة، فإننا نختصر من طول السلسلة فتصبح مكونة من أربع ذرات كربون، اما الذرة الخامسة فإننا نوصلها (نربطها) مع أحد ذرات الكربون الوسطية، كما هو مبين في الصيغة الآتية:
- إن ذرات االكربون الثلاث الطرفية كل منها يتو ربطه مع ثلاث ذرات هيدروجين ، و كل ذرتي الكربون الوسطيتين يرتبط معها ذرتي هيدروجين، و مع ذلك تبقيى الصيغة الجزيئية كما هي دون تغيير C5H12.
- لندرس السلاسل الآتية
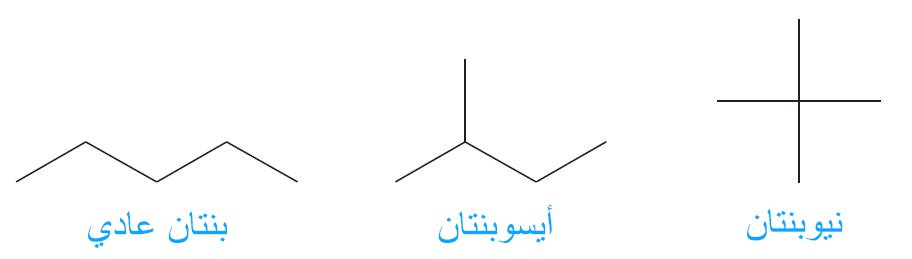
- إن أول سلسلتين عبارة عن سلسلة متصلة مكونة من 5 ذرات كربون، و هي مشابه تماما لصيغة مركب البنتان.
- أما البُنية الثالثة فهي مشابه لبُنية -2ميثيل بيوتان.
- هناك متصاوغ ثالث لـ C5H12 . و يمككنا كتابته من خلال تقليص طول السلسلة لتصبح ثلاث ذرات كربون و توصيل ذرتي كربون مع ذرة الكربون الوسطية ، أي أن التشعب يصبح من الوسط.
- إذا أكملنا الصيغة بذرات الهيدروجين، فسوف نلاحظ أن ذرة الكربون الوسطية لا يتصل معها أي ذرات هيدروجين.
- و عليه يمكننا رسم فقط ثلاثة صيغ بنائية مختلفة لها نفس الصيغة الجزيئية C5H12 ، و اسمها: ع-بنتان (ع-عادي، أي سلسلة بدون أي تشعبات)و أيسوبنتان و نيوبنتان.
10 – الصيغ البنائية المختصرة Abbreviated Structural Formulas
- نستطبع كتابة الصيغ البنائية بطريقة مختصرة و التي يمكن أيضا أن توفر لنا معاني الصيغ البنائية. فمثلا يمكننا أن نختصر الصيغة البنائية للإيثانول (الكحول الإيثيلي) على النحو الآتي (من اليسار إلى اليمين):
- كما يمكننا تمثيل ميثوكسي الميثان (ثنائي ميثيل إيثر) بأي من الصيغ البنائية الآتية:
- كما يمكن اختصار الصيغ البنائية الثلاثة للبنتان بنفس الطريقة:
و أحيانا يمكن اختصار تلك الصيغ أكثر فاكثر. فمثلا يمكن كتابتها على سطر واحد كما هو مبين أدناه:
- أما الاختصار النهائي للصيغ البنائية فيتضمن استخدام الخطوط للتعبير عن شبكة (بنية) ذرات الكربون.
11- الشحنة الشكلية Formal Charge
- في بعض الجزيئات، يمكن لذرة أو أكثر أن تشحن إما بالسالب أو بالموجب.
- و بسبب كون مثل تلك الشحنات في العادة تؤثر على التفاعلات الكيميائية لتلك الجزيئات، فإنه من الضروري معرفة مكان تواجد الشحنة في الجزيء.
- لندرس صيغة أيون الهيدرونيوم +H3O و هو ناتج عن تفاعل الماء مع البروتون (أيون الهيدروجين الموجب +H).
- كما نعلم أن الاكسجين يشارك بستة إلكترونات و كل ذرة هيدروجين تشارك بإلكترون واحد، و عليه تصبح العدد الإجمالي للإلكترونات ثمانية إلكترونات حول ذرة الأكسجين و إلكترونين حول كل ذرة هيدروجين، و كما هو ظاهر أن الايون يحمل شحنة موجبة واحدة ذلك يعني أنه تم منح إلكترون واحد فيتبقى ثمانية إلكترونات. فستة من تلك الإلكترونات الثمانية تستخدم لتشكل ثلاثة روابط أحادية من نوع H-O، فيتبقى زوج إلكتروني وحيد غير رابط (حر) على ذرة الاكسجين.
- لتحديد الشحنة الشكلية، فإننا نفترض أن كل ذرة «تمتلك» كل إلكتروناتها غير الرابطة بالإضافة إلى نصف إلكتروناتها الرابطة (إلكترون واحد من كل رابطة تساهمية). و من ثم نقوم بطرح هذه العدد الناتج من عدد إلكترونات التكافؤ في الذرة المتعادلة للحصول على الشحنة الشكلية.
12- الرنين Resonance
- في بُنيات (تراكيب) الإلكترون-نقطة، فإن كل زوج من النقاط أو خط يمثل رابطة بين ذرتين فقط.
- أحيانا يدخل زوج الإلكترونات مع أكثر من ذرة أثناء عملية تشكيل الروابط.
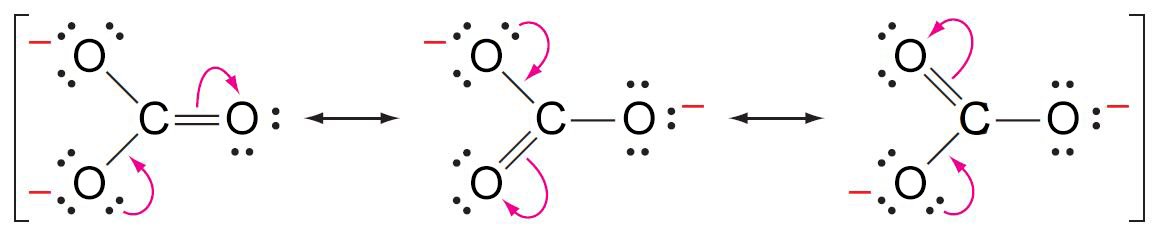
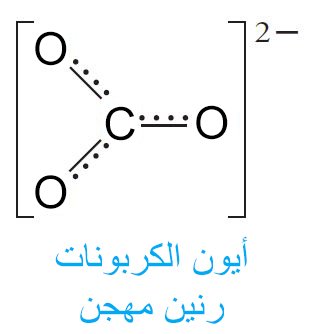
- فالجزيئات أو الأيونات الذي يحدث فيها ما سبق ذكره لا يمكن أن يتم تمثيلها بصيغة بنائية الإلكترون- النقطة بصورة مناسبة. مثال: أيون الكربونات –CO32.
- إن العدد الكلي لإلكترونات التكافؤ في أيون الكربونات هو 24. فالصيغة البنائية الإلكترون-نقطة التي تظهر إكتمال عدد إلكترونات التكافؤ للكربون و الأكسجين بحيث كل منها يحاط بثمانية إلكترونات، موضحة كما يلي:
- فالبنية السابقة تظهر وجود رابطتين أحاديتين بين ذرة أكسجين و ذرة الكربون و رابطة ثنائية واحدة بين ذرة أكسجين واحدة و ذرة كربون. و عند تطبيق قاعدة الشحنة الشكلية نلاحظ ان ذرة الكربون متعادلة شكليا ، و كل ذرة أكسجين مرتبطة مع الكربون برابطة أحادية تحمل شحنة -1 ، و ذرة الأكسجين المرتبطة براطة ثنائية مع الكربون متعادلة شكليا.
- عندما نقوم بكتابة الصيغة البنائية الإلكترون-نقطة لأيون الكربونات، فإنه حقيقة يمكن كتابة رسم ثلاثة صيغ بنائية يمكن التعبير عنها كما يلي:
- فالبُنيات السابقة لها نفس ترتيب الذرات و لكنها تختلف عن بعضها البعض في توزيع و ترتيب الإلكترونات.
- تم إعادة رسم بُنيات أيون الكربونات كما مبين أدناه، وتظهر الأسهم المنحنية كيفية انتقال أزواج الإلكترونات للتحول من بُنية لأخرى.
- يستخدم الكيميائيون الأسهم المنحنية للدلالة على التغير في موقع الإلكترونات.
- وقد أظهرت الدراسات الفيزيائية أن ليس أي من البُنيات السابقة تمثل البنية الصيغة البنائبة الحقيقية لأيون الكربونات.
- إن أطوال روابط الأكسيجن-الكربون الثلاثة متساوية : 1.31 أنجستروم، و هذا الطول يقع بين الأطوال المتعارف عليها للرابطة الثنائية بين الأكسجين و الكربون (1.20 أنجستروم) و الرابطة الاحادية C-O و تساوي 1.41 أنجستروم.
- إن لأيون الكربونات بُنية (تركيب) و التي هي رنين هجين لبُنيات الرنين الثلاثة السابقة.
- و من المهم التنبيه هنا أن أيون الكربونات لا يتنقل فيزيائية بين تراكيب الرنين الثلاث السابقة و لكن حقيقة لديه بُنية واحدة هجينة مكونة من بُنيات الرنين الثلاث.
- إن بُنيات (تراكيب) الرنين للجزيء تختلف في توزيع الإلكترونات و لكن يبقي توزيع و ترتيب الذرات في الجزيء كم هو دون تغيير.
- و الرنين يختلف عن التصاوغ و الذي يحدث فيه إعادة ترتيب للذرات بحد ذاتها.
- و عندما يكون هناك إمكانية لحدوث الرنين، فإنه يقال عن المادة بأن لها بنية رنين هجينة لعدد من البنيات المختلفة.
- نستخدم السهم مزدوج الرأس (↔) بين البُنيات الداخلة في عملية الهجين و ذلك للتفريق بين الرنين و الإتزان بين المركبات المختلفة حيث نستخدم الرمز ⇋ .
- فكل رابطة أكسجين-كربون في أيون الكربونات ليست أحادية و لا ثنائية و لكن شيءٌ ما بين ذلك.
- و أحيانا نقوم بالتعبير عن رنين هجين بصيغة نرسم فيها خط للدلالة على كل رابطة مكتملة و خط منقط لكل رابطة جزئية.
13- رؤية الأفلاك للترابط، رابطة سيجما The Orbital View of Bonding; the Sigma Bond
- عادة ما تكون بُنيات (تراكيب) الإلكترون-نفطة مفيدة ولكنها محدودة إلى حد ما.
- كما أن نظرية لويس للترابط بحد ذاتهايشوبها بعض العيوب و خاصة عند شرح الأشكال ثلاثية الابعاد للجزيئات.
- فهناك نظرية أخرى أكثر فائدة و شمولا للترابط يدخل فيها استخدام الافلاك.
- إن للأفلاك الذرية أشكالا محددة.
- إن فلك s يكون كرويا.
- و أشكال أفلاك p الثلاثة تتكون من فصين مشابه للدمبل و متعامدة مع بعضها البعض على طول المحاور x و y و z .
- من وجهة نظر الأفلاك للترابط ، تقترب الذرات من بعضها البعض بطريقة تتداخل أفلاكها الذرية لتشكيل الرابطة.
- إذا شكّلت ذرتان هيدروجين جزيء هيدروجين ، فإن فلكيهما الكرويين 1s يتحدان لتكوين فلك جديد يشتمل على كلتا الذرتين.
- و يحتوي هذا الفلك على إلكترونات التكافؤ.
- لا يمكن أن يحتوي كل فلك جزيئي على أكثر من إلكترونين.
- الفلك الموجود في جزيء الهيدروجين متماثل أسطوانيًا على طول المحور النووي H-H.
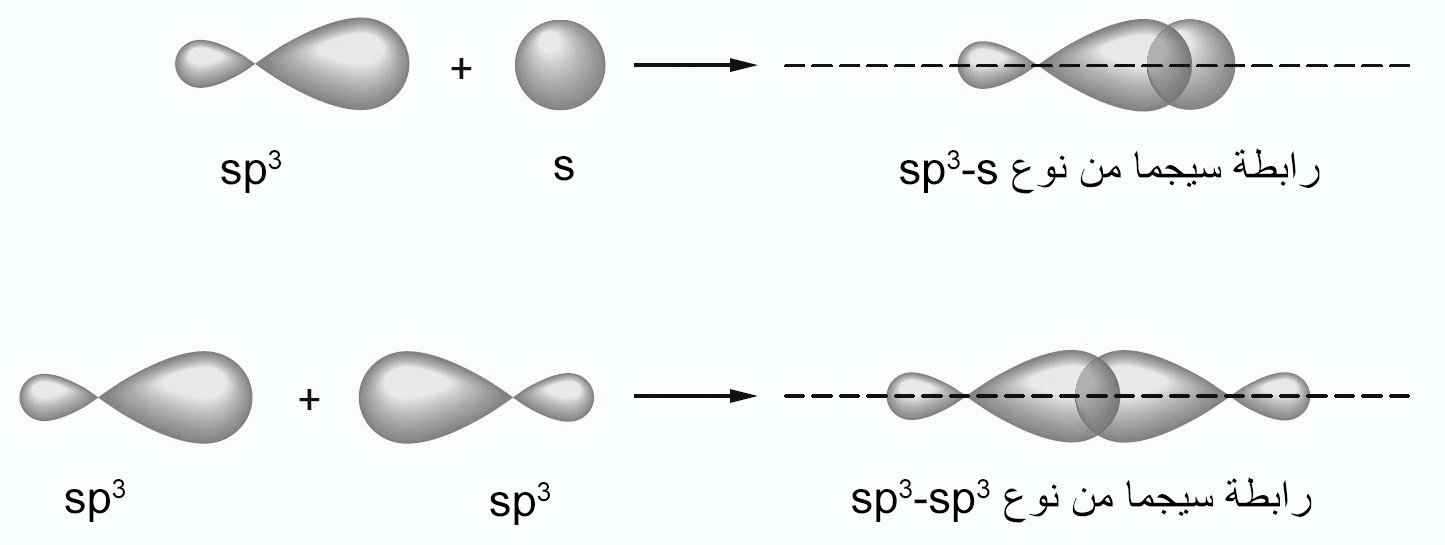
- تسمى هذه الافلاك بأفلاك سيجما (σ) ، ويشار إلى الرابطة باسم رابطة سيجما. كما يمكن أيضًا تكوين روابط سيجما من خلال تداخل الفلك s و فلك p أو فلكي p اثنين ، كما هو موضح في الشكل الآتي.
14- أفلاك الكربون المهجنة من نوع sp3 ز Carbon sp3 Hybrid Orbitals
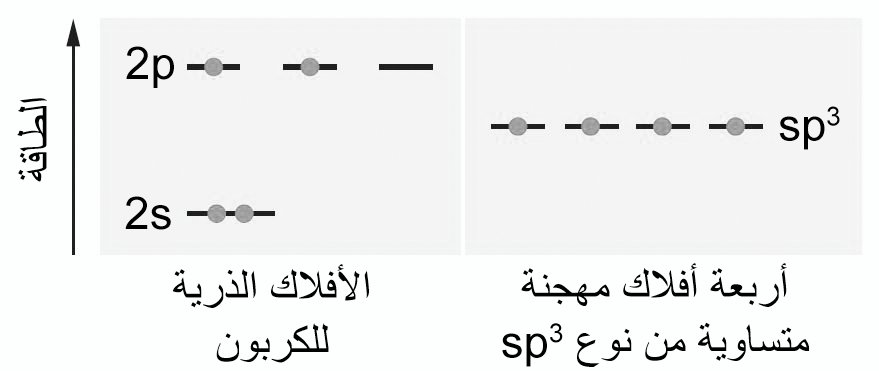
- في ذرة الكربون ، يتم توزيع الإلكترونات الستة كما هو موضح في الشكل أدناه.
- هناك أربعة إلكترونات تكافؤ ، إثنين في فلك 2s واثنين في فلك 2p.
- من مقياس الطاقة في اليسار والذي يمثل طاقة الإلكترونات في مختلف الأفلاك ، نلاحظ أنه كلما كان الإلكترون أبعد من النواة ، زادت طاقة جهده
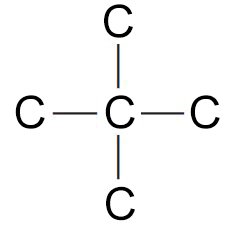
- يكون الكربون عادة أربع روابط أحادية ، وغالبًا ما تكون هذه الروابط متكافئة ، كما هو الحال في CH4 أو CCl4.و عند خلط أو الجمع بين الأفلاك الذرية الأربعة لغلاف التكافؤ يتشكيل أربعة أفلاكا مهجنة متطابقة، يحتوي كل منها على إلكترون تكافؤ وحيد .
- تسمى الأفلاك المهجنة أفلاك sp3 الهجينة لأن لكل منها مكون من جزء s واحد وثلاثة أجزاء من p.
- لكل فلك sp3 نفس الطاقة: أقل من أفلاك 2p ولكن أكبر من فلك 2s.
- يشبه شكل أفلاك sp3 شكل أفلاك p ، باستثناء أن الفصين غير متشابهين ، والأرجح أن توجد الإلكترونات في الفص الذي يمتد خارج لمسافة أكبر بعيدا عن النواة.
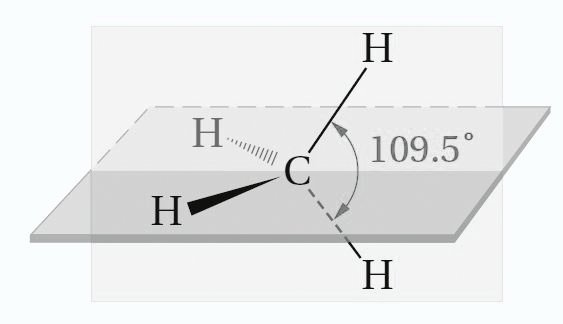
- كما هو موضح في الشكل الآتي ، يتم توجيه الأفلاك الأربعة الهجينة sp3 لذرة كربون واحدة نحو زوايا رباعي الاسطح المنتظم.
- تبلغ الزاوية بين أي اثنين من الروابط الأربعة المتكونة من أفلاك sp3 حوالي 109.5 درجة ، وهي الزاوية التي تصنعها خطوط مرسومة من المركز إلى زوايا رباعي الأسطح المنتظم.
- يمكن للأفلاك المهجنة أن تكون روابط سيجما من خلال التداخل مع أفلاك مهجنة أخرى أو مع أفلاكا ذرية غير مهجنة.
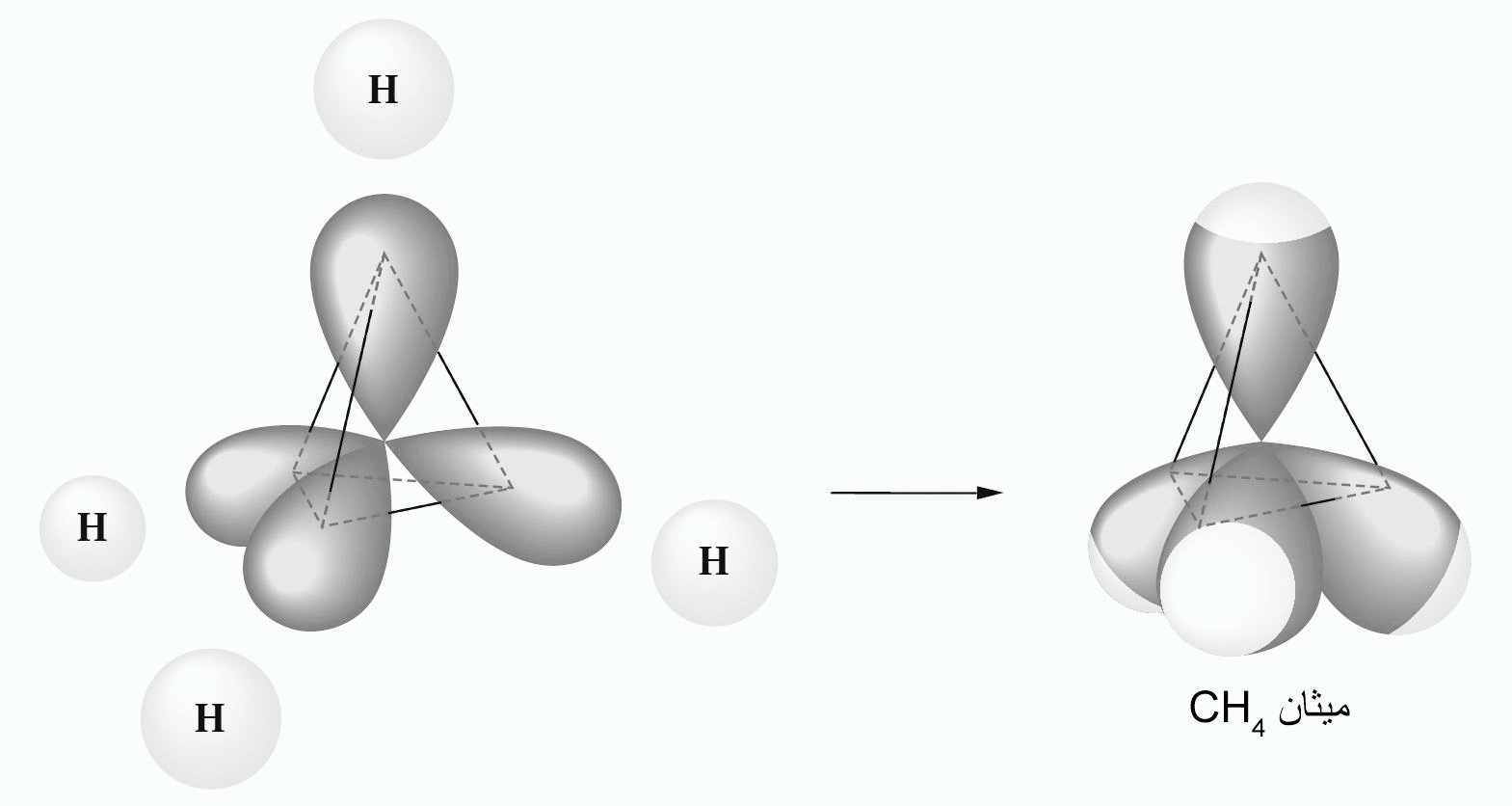
15- بنية رباعي الأسطح المنتظم للكربون، الترابط في الميثان Tetrahedral Carbon; the Bonding in Methane
- في الميثان ترتبط ذرة الكربون مع كل ذرة هيدروجين برابططة سيجما و التي نتجت عن تداخل فلك sp3 مع فلك 1s للهيدروجين حيث نتج عن ذلك هيكل رباعي الأسطح المنتظم.
- زاوية كل رابطة H-C-H متساوية و تساوي 109.5 درجة.
- تتمثل إحدى ميزات رباعي الأسطح المنتظم في أن المركز وأي زاويتين من رباعي الأسطح تشكل مستوى و الذي يكون منصف عموديا لمستوىً مماثل يتكون من المركز والزاويتان الأخريان.
- في الميثان ، على سبيل المثال ، فإن أي ذرتي هيدروجين وكربون يشكلان مستوى يقسم بشكل عمودي المستوى الآخر و الذي يتكون من الكربون و ذرتي الهيدروجين الأخرى.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :