الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
Posted in :
ملاحظة هامة: هذا المقال عبارة عن مختصر للفصل العاشر من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
- الحموض الكربوكسيلية (الأحماض الكربوكسيلية) هي حموضا عضوية تحتوي على مجموعة الكربوكسيل.
- في مشتقات الحموض الكربوكسيلية يتم استبدال مجموعة OH- بمجموعات أخرى.
- عن طريق تكثف ألدول يمكن صناعة العديد من المركبات.
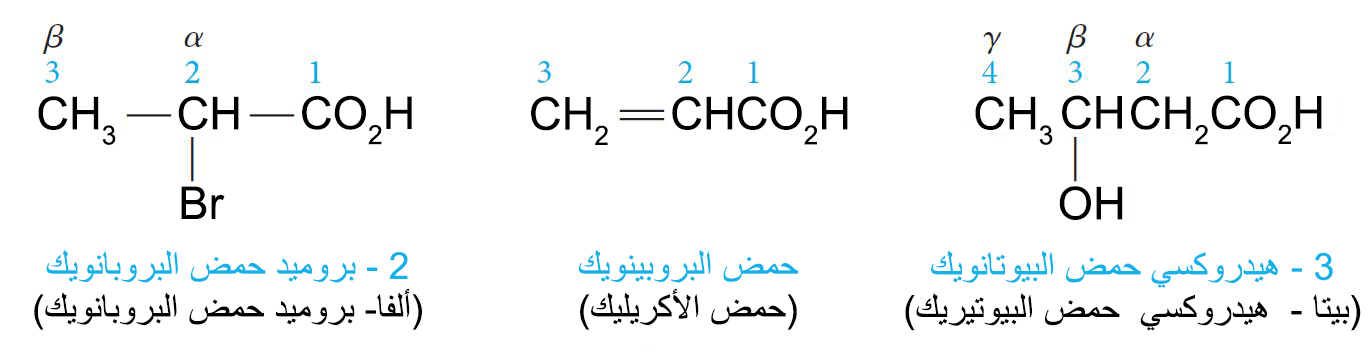
1 – تسمية الحموض (الاحماض) Nomenclature of Acids
- لكتابة اسم الحمض الكربوكسيلي حسب الأيوباك فإن اسم الألكان المقابل ينتهي باللاحقة -ويك و من ثم تحلق كلمة حمض (هذا بالإنجليزية، في العربية يكتب أولا اسم حمض ثم اسم الالكان بالإضافة إلى اللاحقة -ويك).
- تسمى المجموعات المتفرعة بطريقتين. فحسب نظام الأيوباك نستخدم الأرقام للإشارة إلىمكانها. أما إذا كنا نستخدم الاسماء الشائعة فإنه نستخدم الحروف اليونانية للإشارة إلى مكانها بدئا من أول ذرة كربون ترتبط بالموجوعة الوظيفية حيث تسمى ألفا-كربون.
- في وجود المجموعة الوظيفية للكحولات أو الألدهيدات أو الكيتونات بالاضافة الى مجموعة الكربوكسيل تكون الأولوية في التسمية لمجموعة الكربوكسيل.
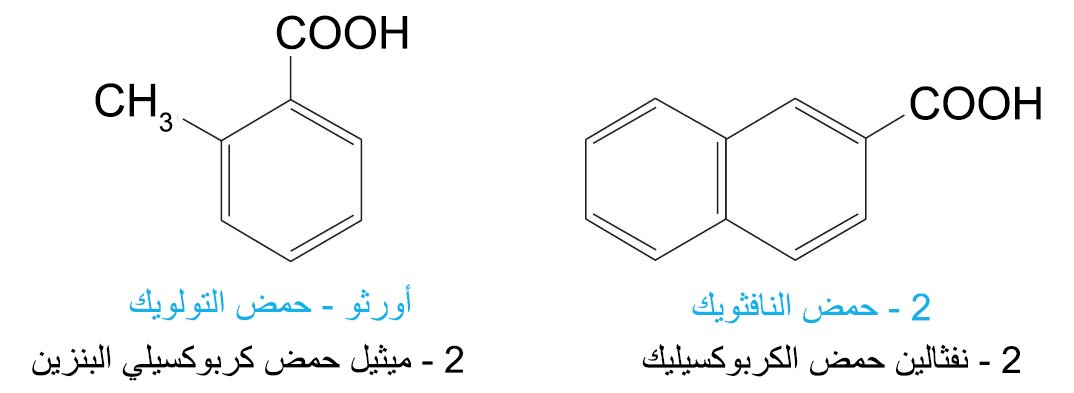
- عندما تكون مجموعة الكربوكسيل متصلة بحلقة، فإنه يضاف إلى إسم الحلقة الألكانية اللاحقة حمض كربوكسيلي (هذا بالإنجليزية، في العربية: تكتب كلمة حمض ثم اسم الحلقة الألكانية ثم تلحق بكلمة كربوكسيلي.
- أما الحموض العضوية الأليفاتية ثنائية حمض الكربوكسيليك فإنه تستخدم اللاحقة -ديويك حمض (في حالة اللغة اللإنجليزية)
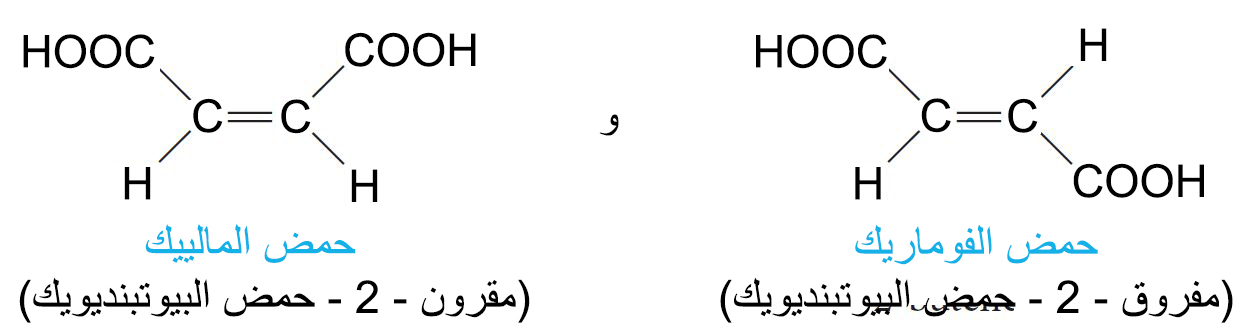
- هناك مركبان هامان ثنائيا الحمضية و اللذان لعابا دوها تاريخيا في دراسة تصاوغ المقرون المفروق هما: حمض الماليك و حمض الفوماريك.
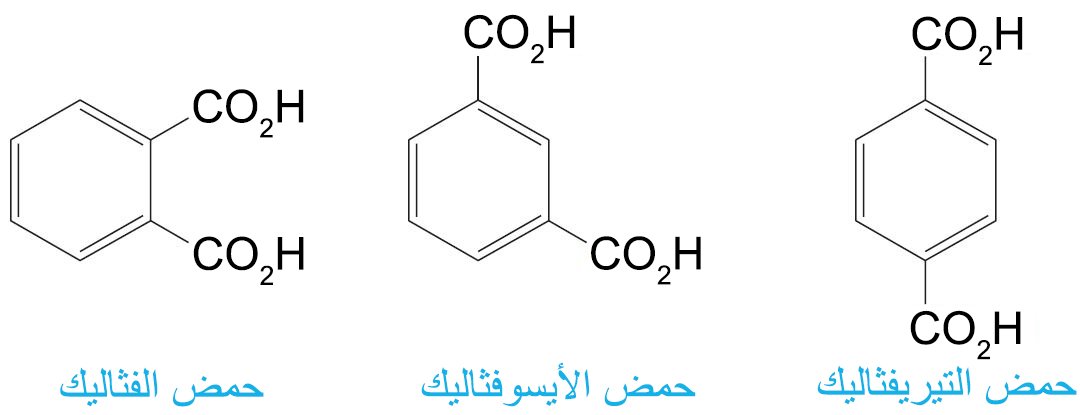
- أما حموض البنزين الكربوكسيلية ثنائية الحمض الثلاثة فتعرف عادة باسمائها الشائعة.
- كما نستطيع تسمية مجموعات الأسيل من الحمض المقابل عن طريق تغيير اللاحقة -يك باللاحقة -يل .
2 – الخواص الفيزيائية للحموض Physical Properties of Acids
- المركبات الاولى في سلسلة الحموض الكربوكسيلية هي سوائل عديمة اللون و لها رائحة نفاذة حادة، مثال: حمض الخليك
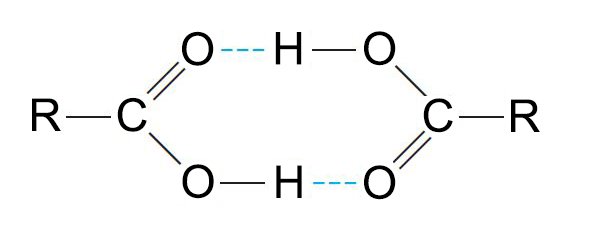
- الحموض الكربوكسيلية قطبية ، بحيث يمكنها أن تشكل روابط هيدروجينية فيما بينها و مع الجزيئات الأخرى.
للحموض الكربوكسيليو درجات غليان مرتفعة جدا حسب وزنها الجزئي- و هي أعلى من تلك للكحولات المقابلة لها. - يمكن للحموض الكربوكسيلية أن تشكل الدياميرات بحيث كل وحدة ترتربط مع بعضها البعض برابطتين هيدروجينيتن .
3 – الحمضية و ثوابت الحموضة Acidity and Acidity Constants
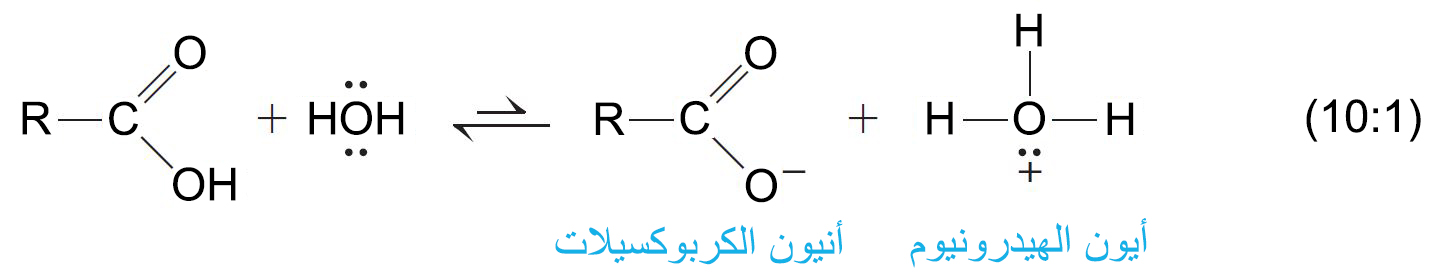
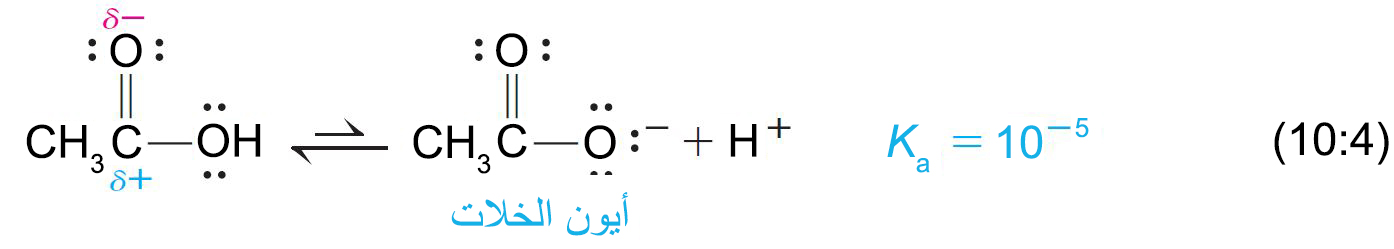
- تتفكك الحموض الكربوكسيلية في الماء و ينتج عن تفككها أنيون الكربوكسيلات (–RCO2) و أيون الهيدرونيوم.
- و ثابت الحموضة في الماء Ka هو :
4 – ما الذي يجعل الحموض الكربوكسيلية حموضا؟
What Makes Carboxylic Acids Acidic?
- في الحموض الكربوكسيلية تحمل ذرة الكربون الكربونيلية شحنة موجبة (+δ). و تسهِّل هذه الشحنة وضع شحنة سالبة على ذرة الأكسجين المجاورة.
إذا أخذنا حمض الخليك كمثال، نلاحظ أن في أيون الخلات ، تتنقل الشحنة السلبة من خلال الرنين، وبالتالي تنتشر الشحنة السالبة بالتساوي على ذرتي الأكسجين بحيث يحمل كل أكسجين في أيون الكربوكسيل نصف الشحنة السالبة فقط. و بالتالي يصبح أيون الخلات أكثر استقرارا عن طريق بالرنين وهذا الاستقرار يساعد على دفع التوازن أكثر إلى اليمين كما هو مبين في المعادلة 4-10 ، لذلك يتم تشكيل المزيد من +H .
5 – تأثير التركيب على الحمضية، التأثير الحثي مرة أخرى.
Effect of Structure on Acidity; the Inductive Effect Revisited
- إن العامل الأكثر أهمية في حمضية الحموض الكربوكسيلية هو التأثير الحثي للمجموعات القريبة من مجموعة الكربوكسيل.
- تذكر أن المجموعات التي تسحب الإلكترون تعزز الحموضة، وأن المجموعات التي تطرد الإلكترون تقلل من الحموضة.
- على سبيل المثال ، في حالة مشتقات الكلورو لحمض الخليك ، نجد أن حمض ثلاثي كلوريد الخليك أكثر حمضية من حمض كلوريد الخليك ، لأن الكلور أكثر كهروسالبية من الكربون ، وتكون الرابطة C-Cl مستقطبة بحيث يحمل الكلور شحنة سالبة جزئية ، الكربون يحمل شحنة موجبة جزئية ،و بالتالي تنجذب الإلكترونات نحو الكلور.
- و من ناحية أخرى نجد بأن حمض الفورميك أكثر حمضية من حمض الخليك لأن مجموعة الميثل في حمض الخليك تطرد الإلكترونات مقارنة مع ذرة الهيدروجين في حمض الفورميك.
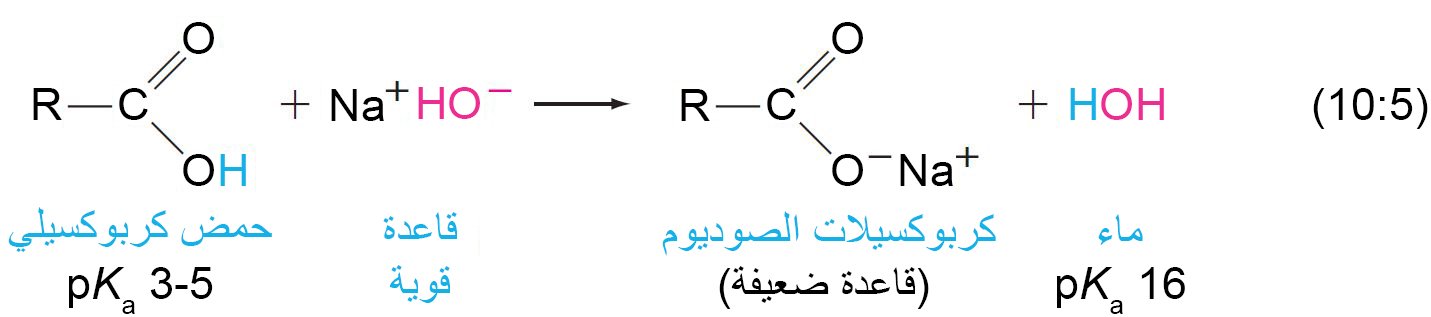
6 – تحويل الحموض إلى أملاح Conversion of Acids to Salts
- عندما يتم معالجة الحموض الكربوكسيلية مع القثواعد القوية يمكن تحضير أملاح الكربوكسيلات.
- يمكن تسمية أملاح الكربوكسيلات كما هو مبين في الأمثلة التالية.
7 – تحضير الحموض (تحضير الاحماض) Preparation of Acids
أ – أكسدة الكحولات الأولية و الألدهيدات
- من العوامل المؤكسدة و الاكثر استخداما في هذه العملية: KMnO4 و CrO3 و HNO3 و Ag2O .
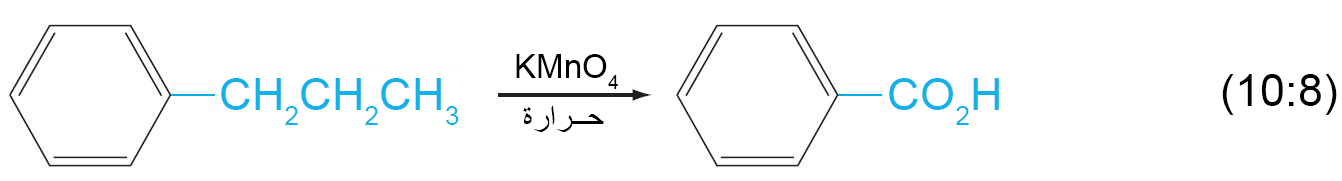
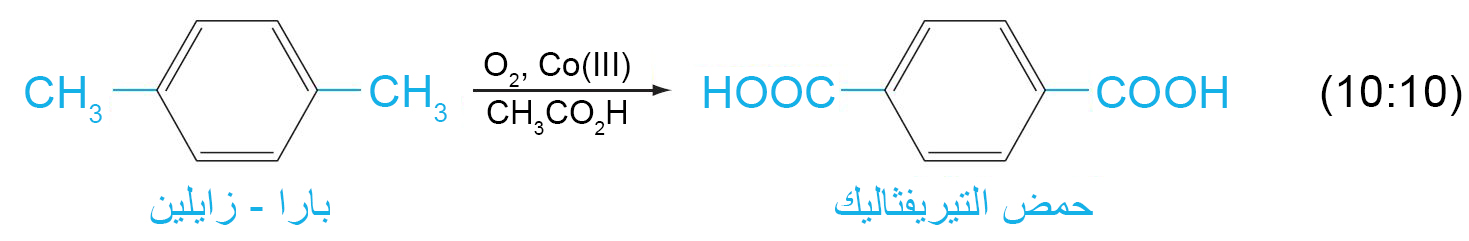
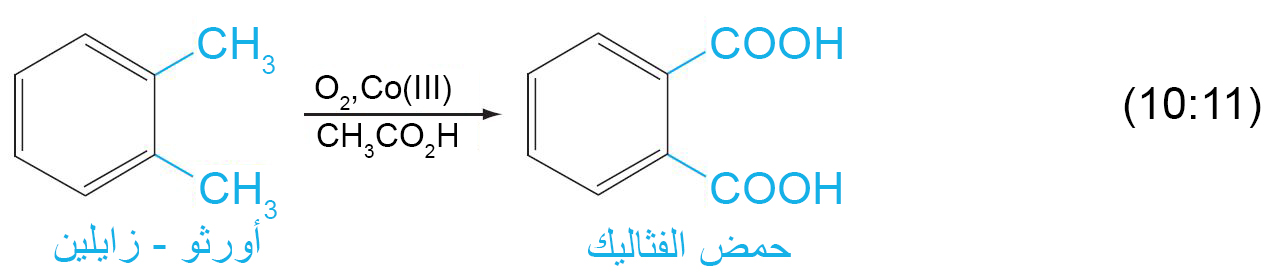
ب – اكسدة السلاسل الجانبية العطرية
- يتطلب هذا التفاعل على أكسدة الرابطة C-H المجاورة لحلقة البنزين.
- إذا لكم يكن هناك رابطة C-H مجاورة لحقة البنزين فإنه في هذه الحالة يتم أكسدة الحلقة العطرية و ذلك تحت ظروف قاسية.
- باستخدام مواد مؤكسدة اخرى يمكن صناعة مركبات جديدة كما هو مبين في المعادلتين الآتيتين:
ج – تفاعل كواشف جرينيارد مع ثاني أكسيد الكربون
- تضاف كواشف جرينيارد إلى مجموعة الكربونيل في ثاني أكسيد الكربون لإنتاج الحموض و ذلك بعد إضافة أين الهيدروجين إلى الملح الكربوكسيلي الوسيط عن طريق حمض معدني مثل حمض الهيدروكلوريك المائي.
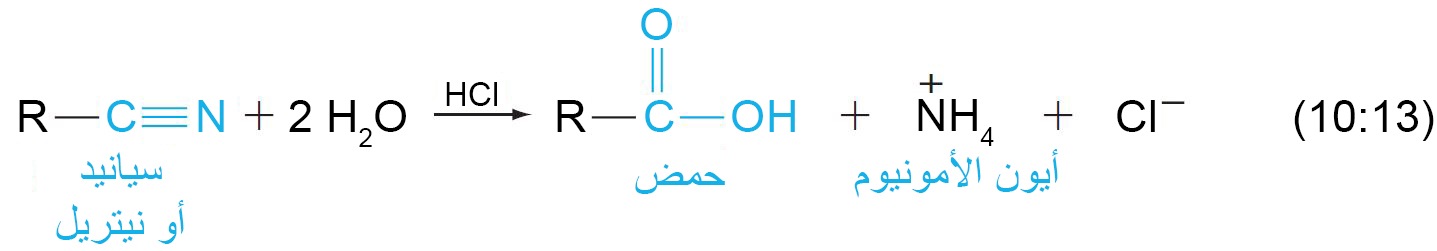
د – حلمهة السيانيدات (النيتريلات)
- يمكن حلمهة الرابطة الثلاثية بين الكربون و النيتروجين في السيانيدات إلى مجموعة كربوكسيل في وجود حمض أو قاعدة.
- في وجود الحمض، تتحول ذرة النيتروجين في السيانيد إلى أيون الأمونيوم.
- في وجود القاعدة ، تتحول ذرة النيتروجين في السيانيد إلى الأمونيا .
- ميكانيكية التفاعل كما يلي
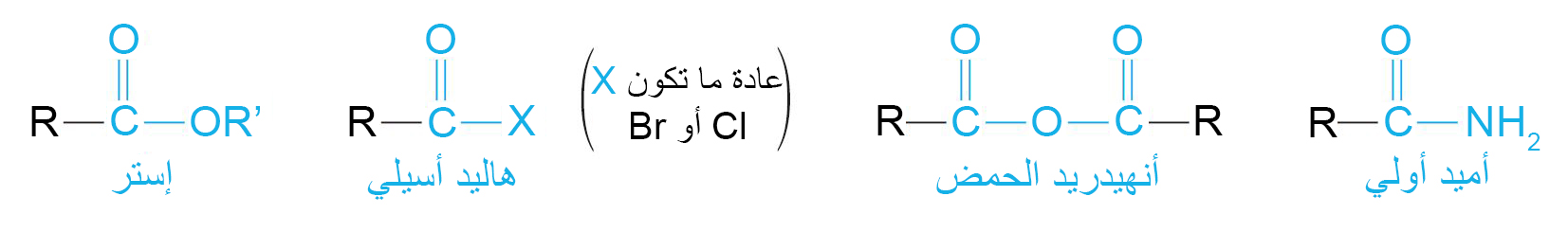
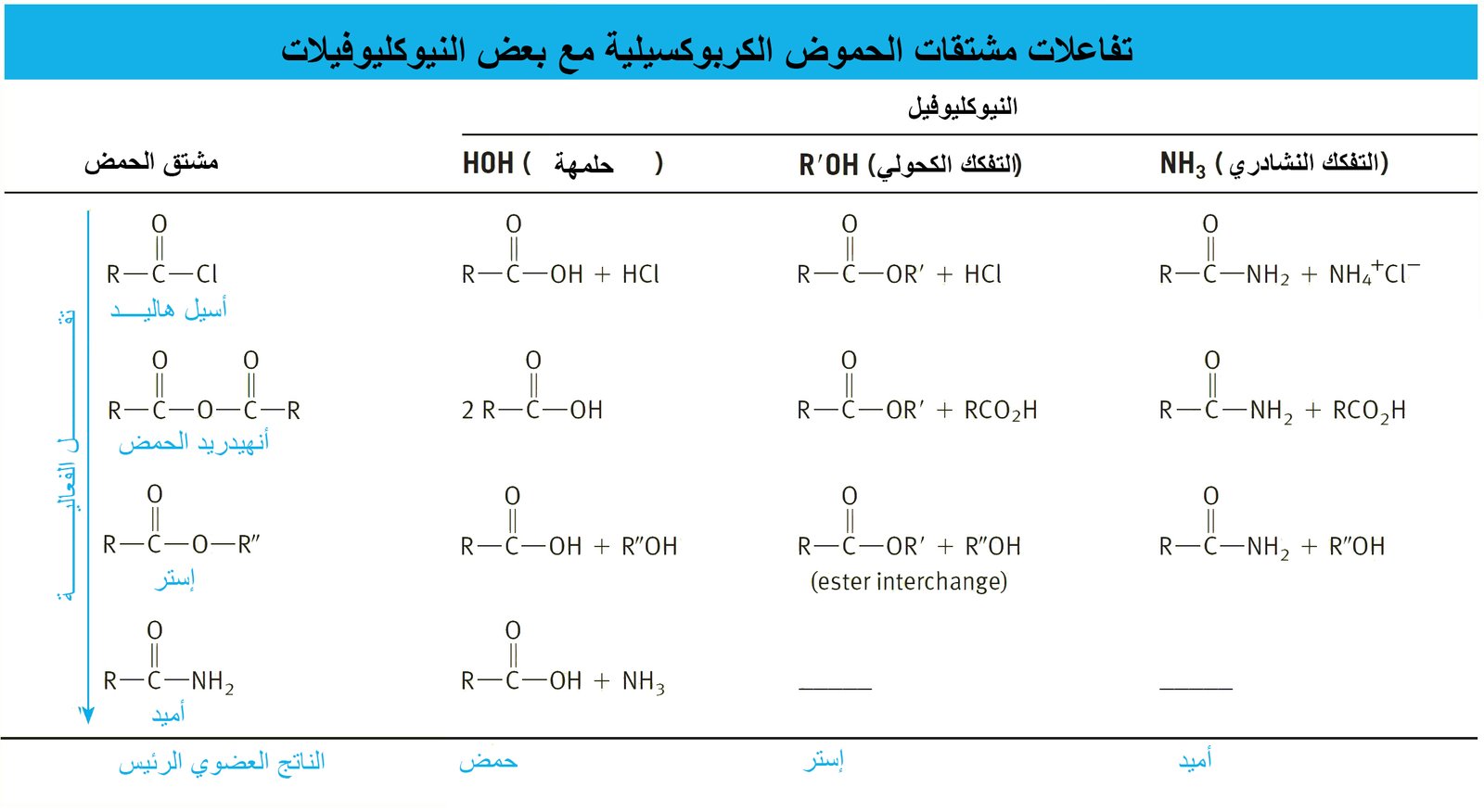
8 – مشتقات الحموض الكربوكسيلية Carboxylic Acid Derivatives
- مشتقات الحموض الكربوكسيلية هي مركبات تم فيها استبدال جزء الهيدروكسيل من مجموعة الكربوكسيل بمجموعات مختلفة أخرى.
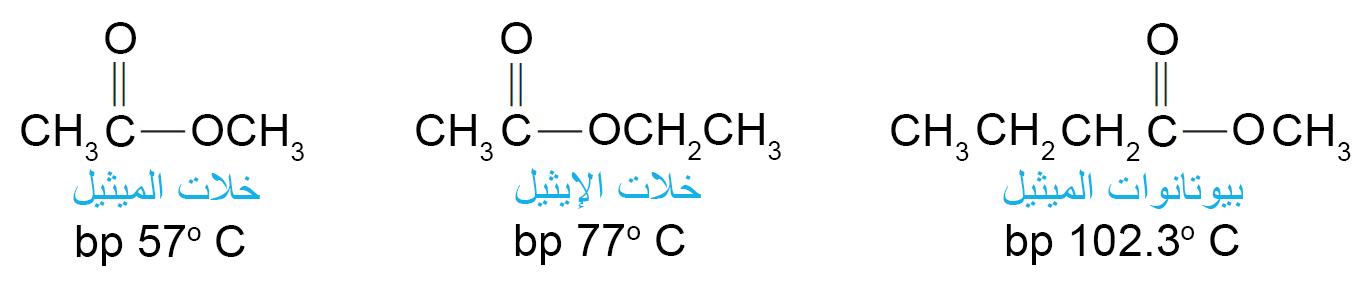
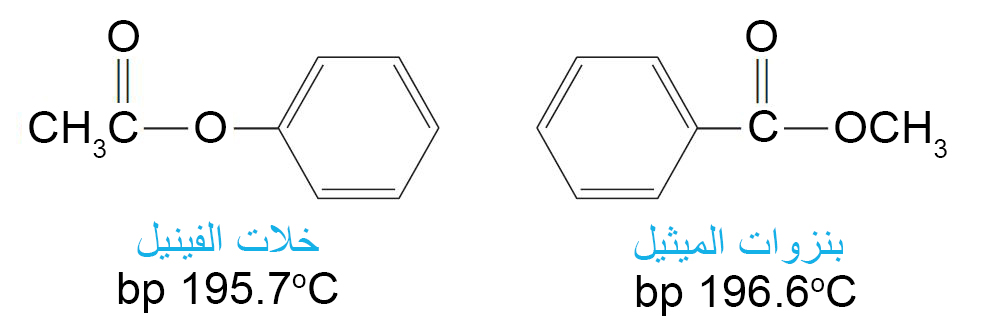
9 – الإسترات Esters
- الإستر هو أحد المركبات المشتقة من الحمض الكربوكسيلي بحيث تم استبدال مجموعة OH- في الحمض بمجموعة OR- .
- عند تسمية الإستر يتم أولا تسمية جزء R من المجموعة OR- ومن ثم تسمية الحمض حيث تستبدل اللاحقة -يك باللاحقة -ات .
- تتميز العديد من الإسترات بالرائحة الجميلة المميزة والتي تكون مسؤولة عن نكهة و رائحة العديد من الفواكه و الأزهار، مثل خلات البنتيل (الموز) و خلات الأوكتيل (البرتقال) و بيوتانوات الإيثيل (الأناناس) و بيوتانوات البنتيل (المشمش) .
10 – تحضير الإسترات ، أسترة فيشر Preparation of Esters; Fischer Esterification
في أسترة فيشر يتم تسخين الحمض الكربوكسيلي و الكحول في وجود حمض كمادة محفزة (عادة HCl أو H2SO4) و ينتج عن ذلك إستر و ماء
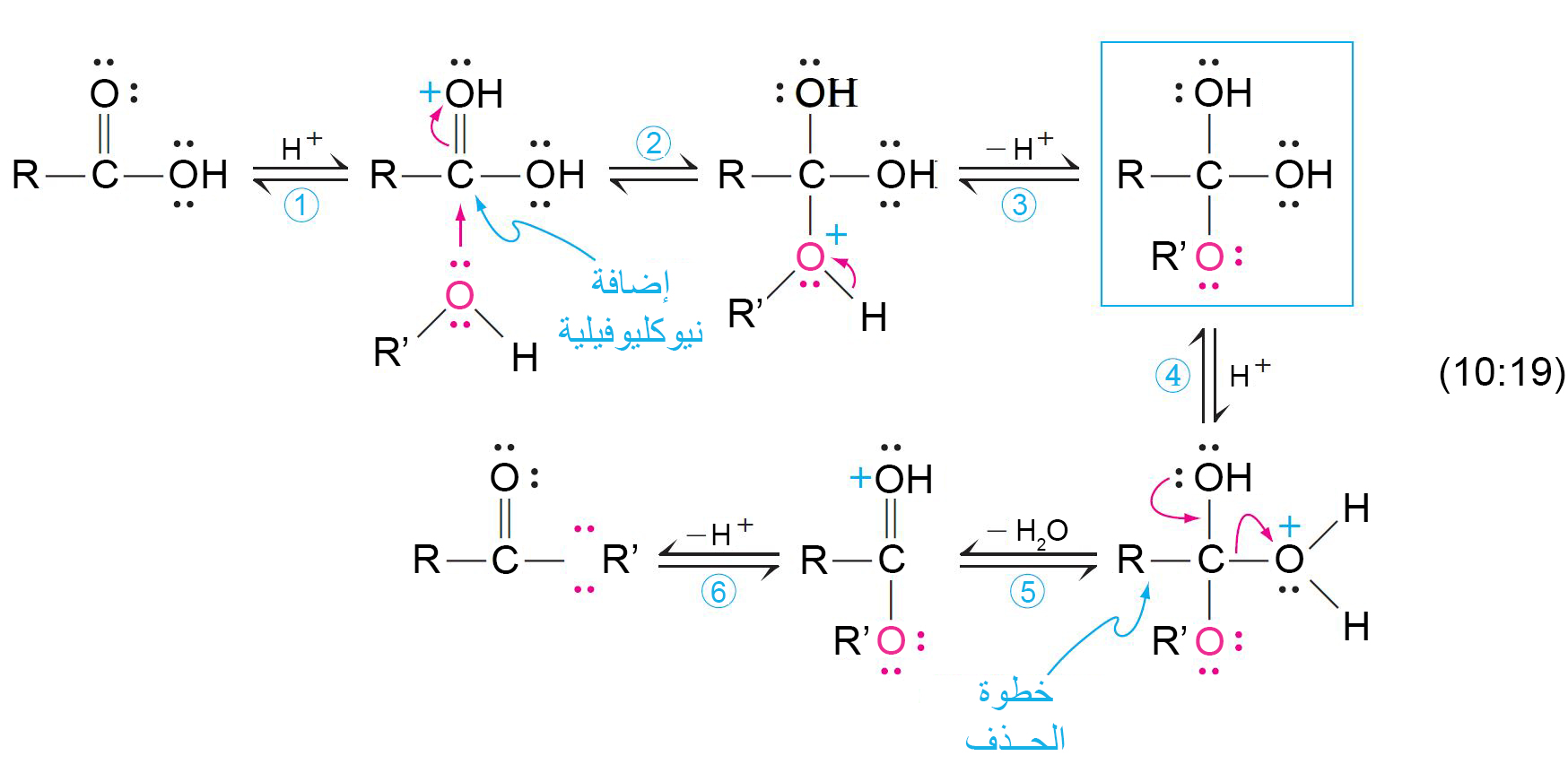
11 – ميكانيكية الأسترة المحفزة بحمض؛ الاستبدال الأسيلي النيوكليوفيلي
The Mechanism of Acid-Catalyzed Esterification; Nucleophilic Acyl Substitution
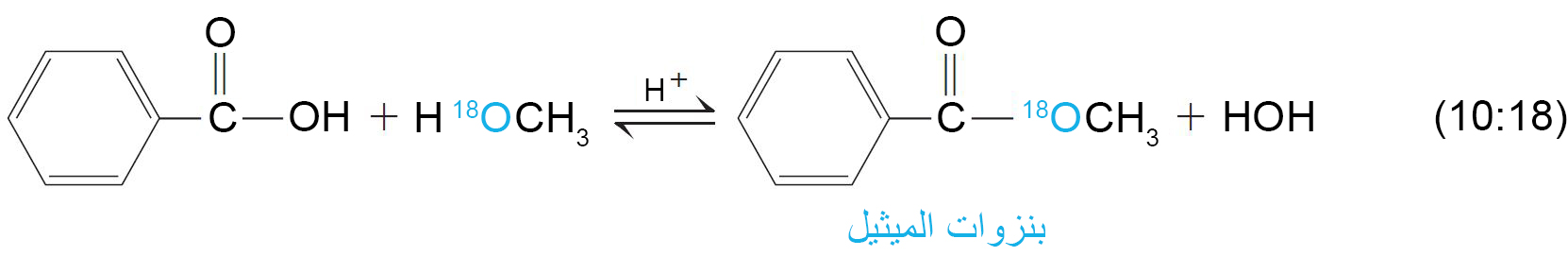
- باستخدام الترميز النظائري ، نلاحظ أن الماء يتم تشكيله باستخدام مجموعة الهيدروكسيل الخاصة بالحمض و ذرة الهيدروجين الخاصة بالكحول. وبعبارة أخرى ، في أسترة فيشر ، تحل مجموعة OR‒ من الكحول محل مجموعة OH‒ من الحمض.
- والنتيجة النهائية لهذه العملية هي استبدال مجموعـة ‘OR‒ من الكحول لمجموعة OH‒ من الحمض. وبالتالي يشار إلى هذا التفاعل على أنه استبدال أسيلي نيوكليوفيلي.
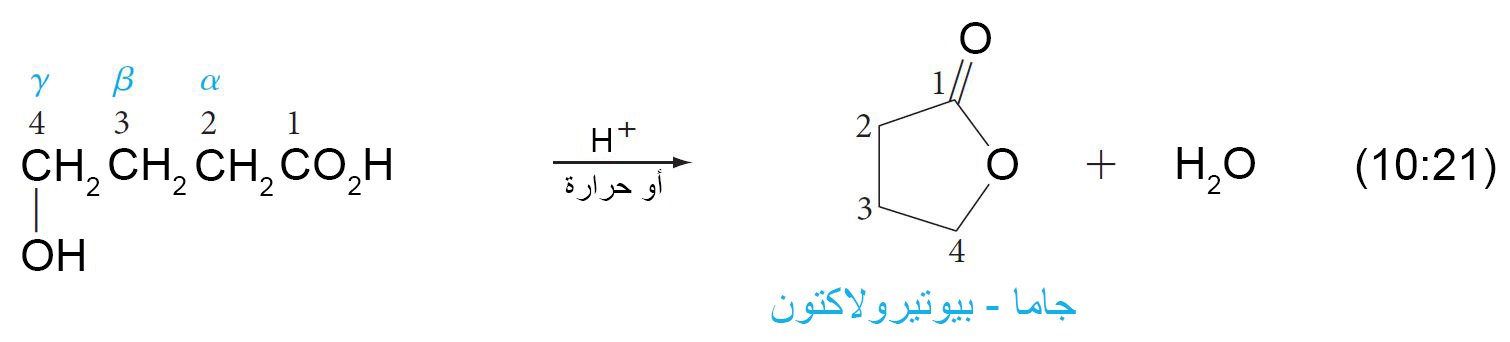
12 – اللاكتونات Lactones
- الحموض الهيدروكسيلية هي حموضا تحتوي على مجموعة الهيدروكسل و في نفس الوقت على مجموعة الكربوكسيل (في نفس المركب).
- اللاكتونات هي إسترات حلقية.
- تتكون أغلب اللاكتونات الشائعة من خمس أو ست حلقات.
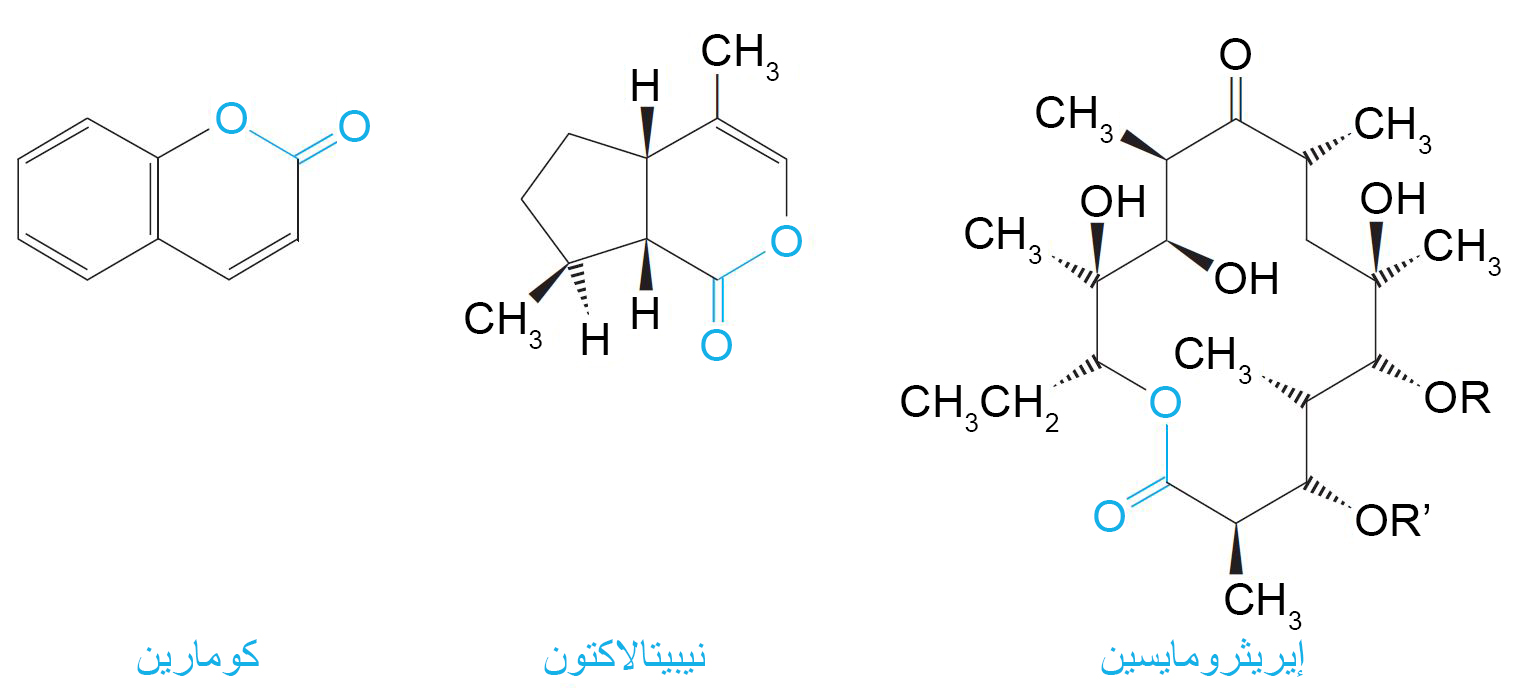
- من الأمثلة على اللاكتونات سداسية الحلقات الكومارين ونيبيتالاكتون و للاكتونات الضخمة الإريثرومايسين.
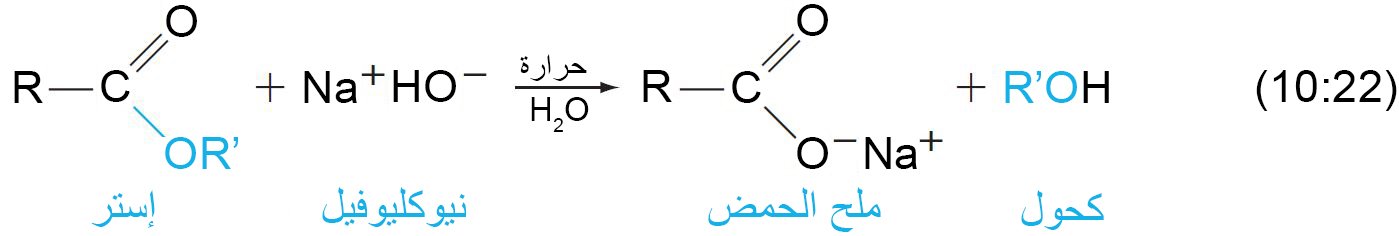
13 – تصبن الإسترات Saponification of Esters
- التصبن هو حلمهة الإستر مع قاعدة .
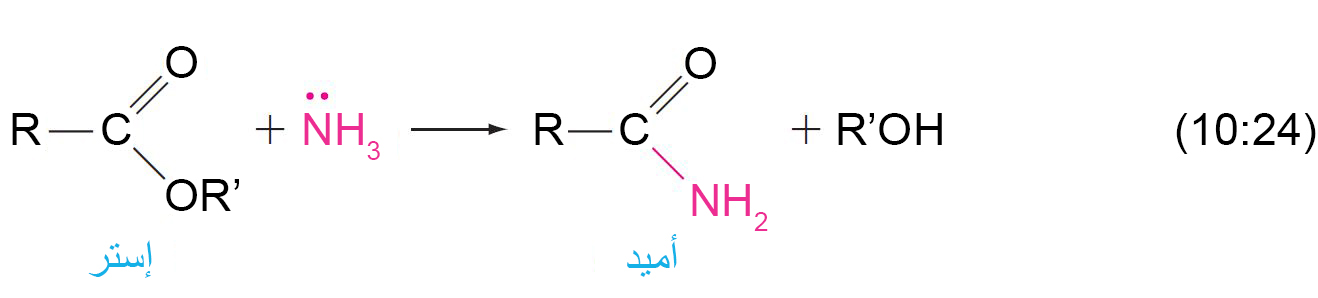
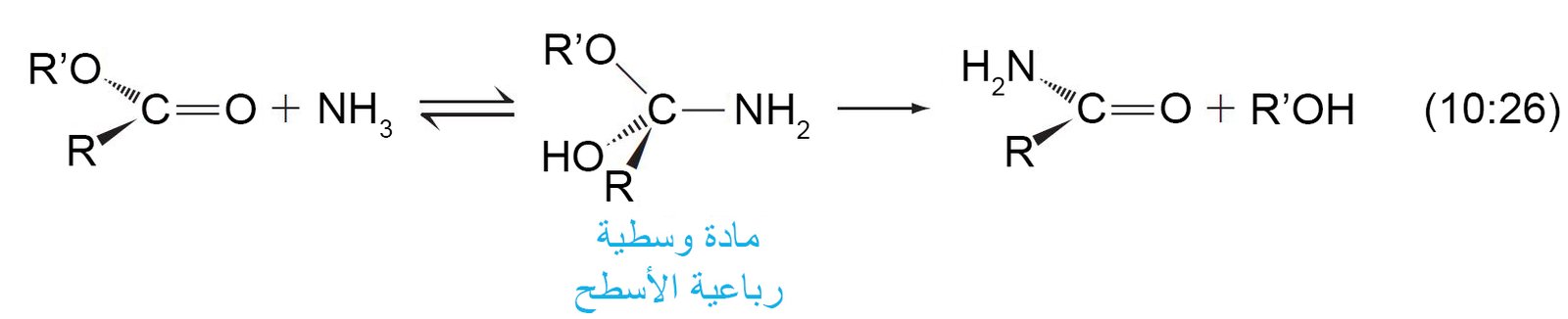
14 – التفكك النشادري للإسترات Ammonolysis of Esters
- يمكن للأمونيا أن تحول الإسترات إلى أميدات.
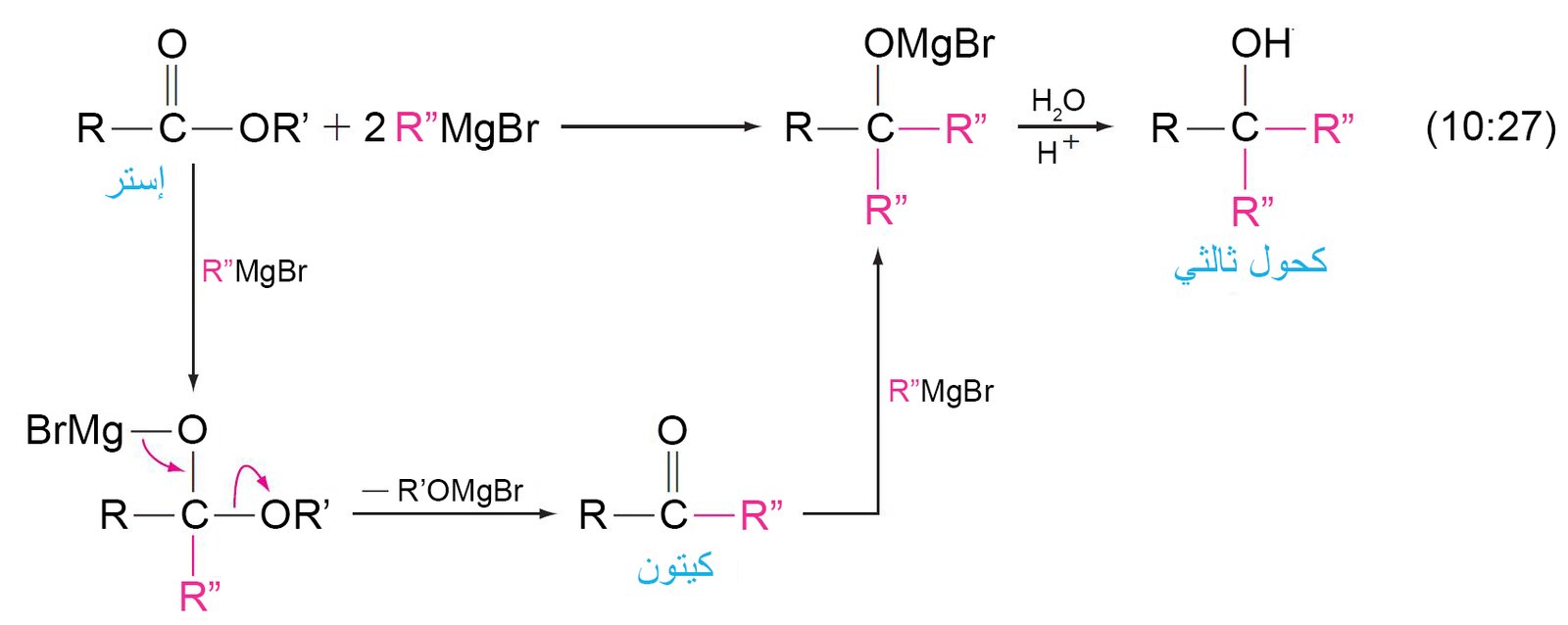
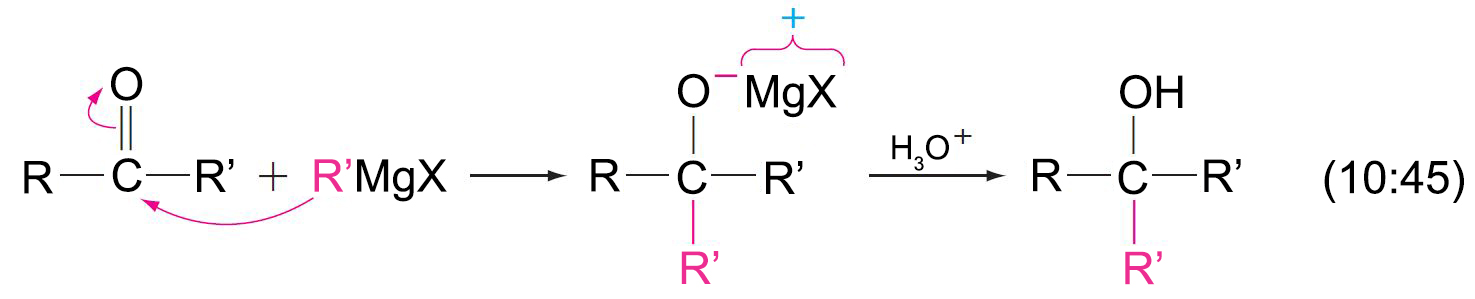
15 – تفاعل الإسترات مع كواشف جرينيارد Reaction of Esters with
Grignard Reagents
- يمكن أن تتفاعل الإسترات مع مكافئين من كاشف جرينيارد و ينتج عن ذلك تكون كحولات ثالثية.
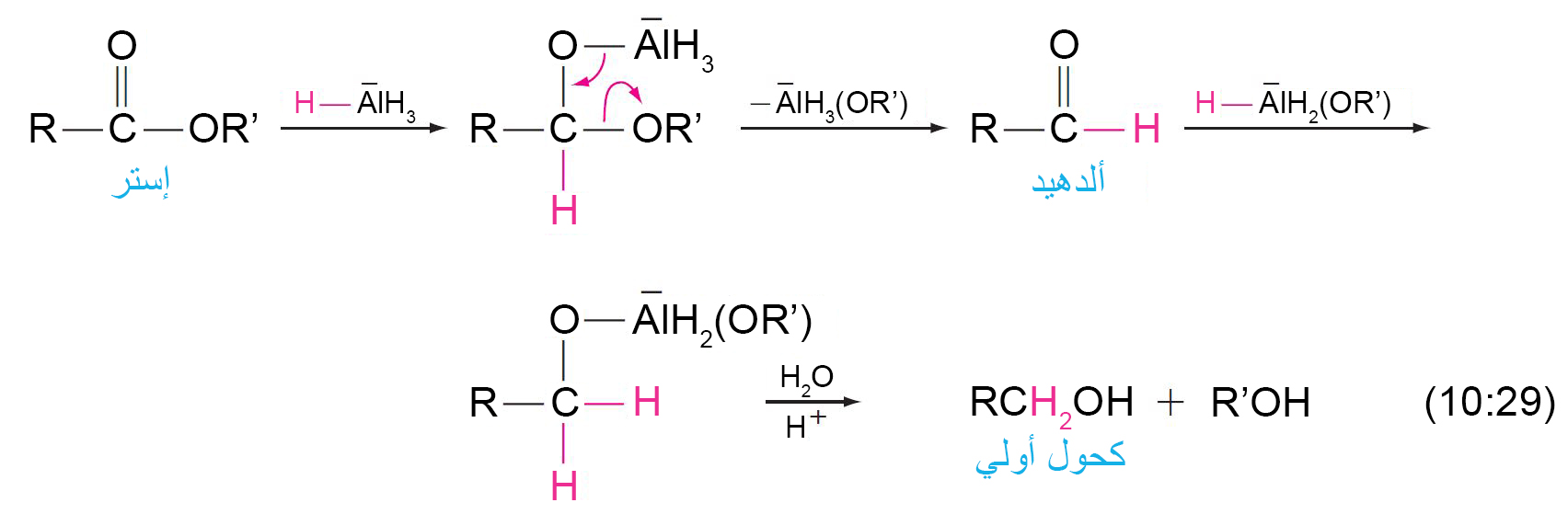
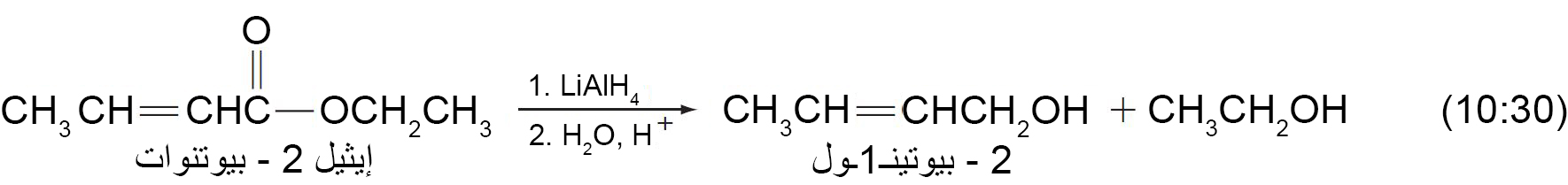
16 – اختزال الإسترات Reduction of Esters
- يمكن اختزال الإسترات إلى كحولات أولية باستخدام هيدريد الليثيوم الألومنيوم (LiAlH4) .
- و ميكانيكية التفاعل كما يلي:
- لذلك مع LiAlH4 يمكن اختزال مجموعة الكربونيل الخاصة بالإستر بدون اختزال رابطة C=C في نفس المركب، مثال:
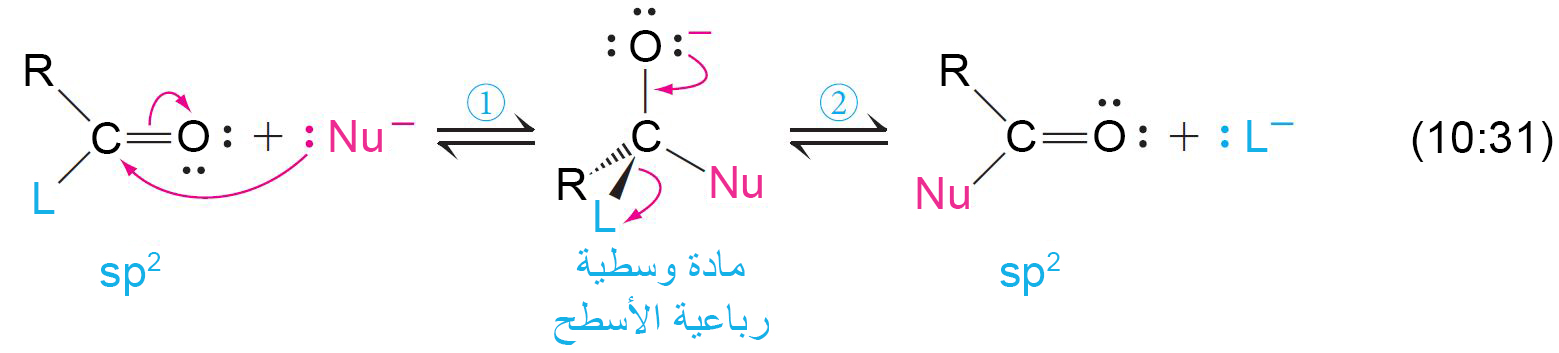
17 – الحاجة إلى مركبات أسيل منشَّطة The Need for Activated Acyl Compounds
- أغلب تفاعلات الحموض الكربوكسيلية و الإسترات و المركبات المرتبطة بها، تتطلب كخطوة أولى هجوم نيوكليوفيلي على ذرة الكربون الكربونيلية.
- و يمكن تلخيص التفاعل الكلي عن طريق ميكانيكية تفاعل من خطوة واحدة.
- النقل الأسيلي هو نقل مجموعة الأسيل من المجموعة المغادرة إلى النيوكليوفيل.
- كلما كانت المجموعة المغادرة L أكثر كهروسالبية ، أصبحت ذرة الكربون الكربونيلية موجبة أكثر و بالتالي تكون معرضة أكثر للهجوم النيوكليوفيلي، و أيضا كلما كانت L أكثر كهروسالبية تصبح مجموعة مغادرة أفضل.
- تكون الإسترات أكثر ثباتًا وبالتالي فهي أقل تفاعلًا تجاه النيوكليوفيلات لأن الشحنة الموجبة على ذرة الكربون الكربونيلية في الإستر يمكن أن تنتقل إلى ذرة الأكسجين.
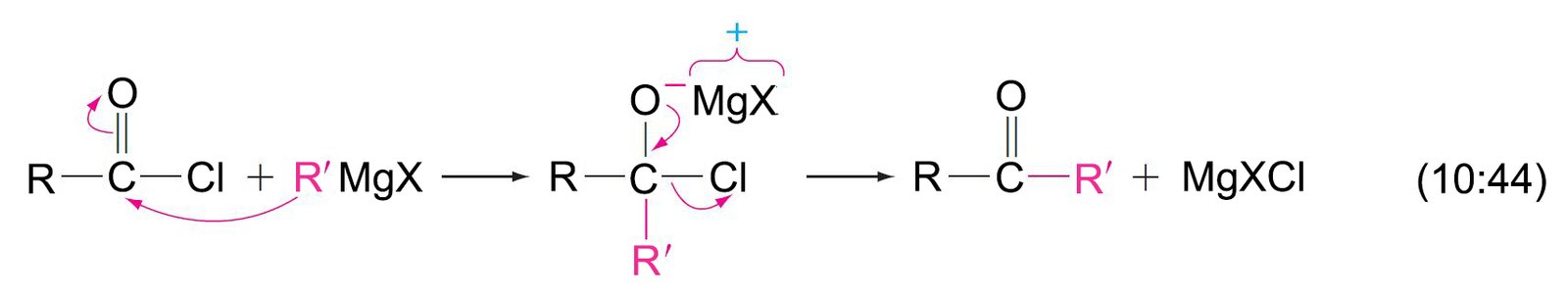
18 – هاليدات الأسيل Acyl Halides
- هاليد الأسيل هو أحد مشتقات الحمض الكربوكسيلي تم فيه استبدال مجموعة OH- بذرة هالوجين.
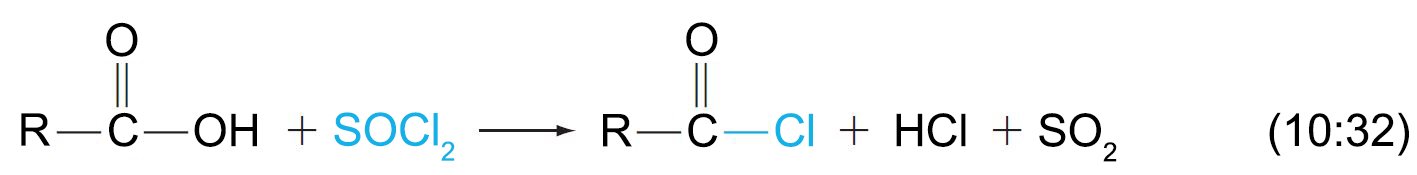
- يمكن تحضير الأسيلات الكلوريدية من تقاعل الحموض (الكربوكسيلية) مع كلوريد الثيونيل.
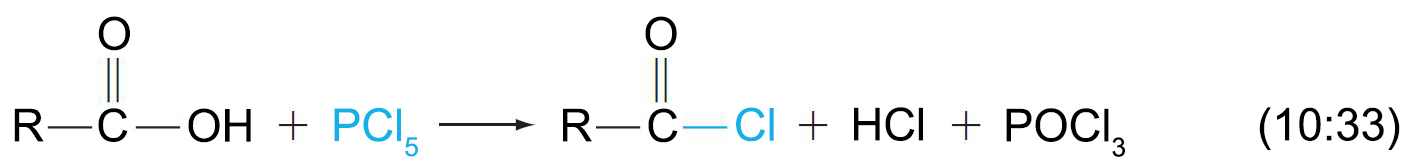
- يمكن استخدام خماسي كلوريد الفوسفور و كواشفا اخرى لتحضير كلوريدات الأسيل من الحموض الكربوكسيلية.
- تتفاعل هاليدات الأسيل و بسرعة مع أغلب النيوكليوفيلات، و بالتالي تتميز بأن لها رائحة مزعجة.
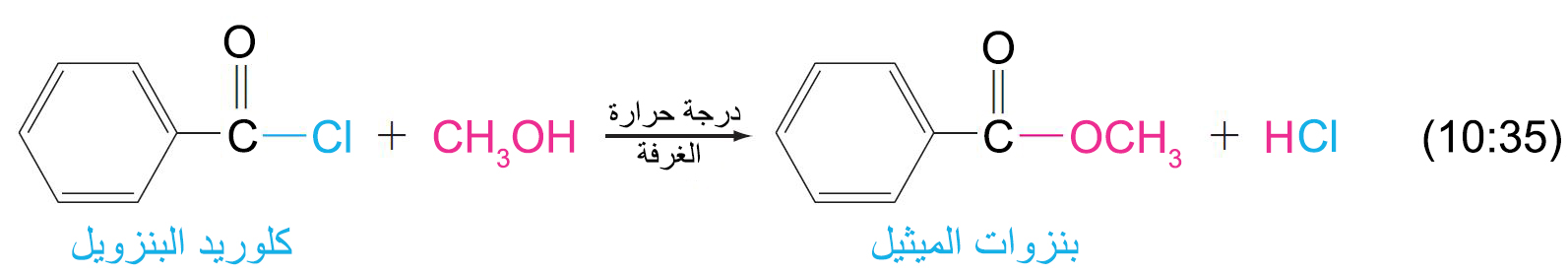
- تتفاعل هاليدات الأسيل بسرعة مع الكحولات لإنتاج الإسترات.
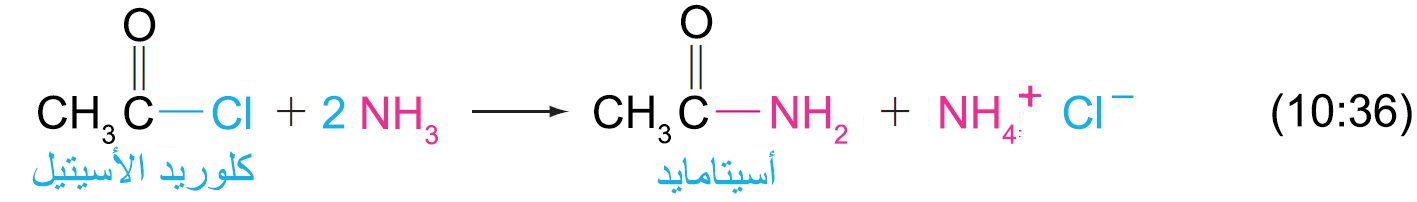
- تتفاعل هاليدات الأسيل بسرعة مع الأمونيا لإنتاج الأميدات.
19 – الحموض منزوعة الماء (الأنهيدريدات) Acid Anhydrides
الحموض منزوعة الماء (أنهيدريدات) هو أحد مشتقات الحمض الكربوكسيلي تتشكل من تكثيف حمضين كربوكسيليين بعد إزالة مجموعة OH- من حمض و ذرة H من الحمض الآخر (الماء).
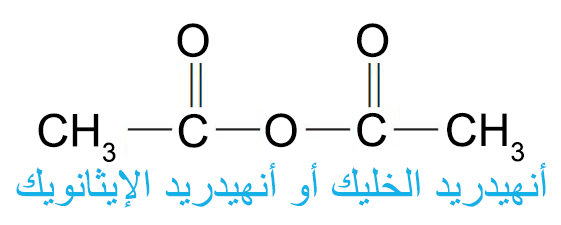
- أكثر الحموض الأليفاتية منزوعة الماء أهمية على المستوى التجاري هي حمض الخليك منزوع الماء ( أنهيدريد الخليك)
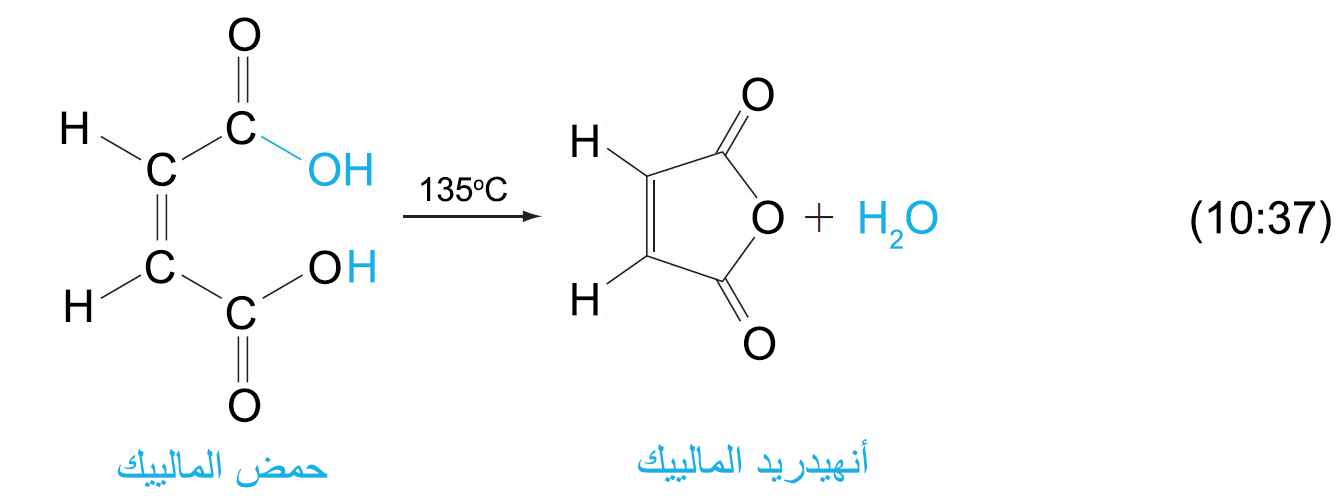
- تحضر الأنهيدرات عن طريق إزالة الماء من الحموض، أما الحموض ثنائية مجموعة الكربوكسيل حيث المسافة بين مجموعتي الكربوكسيل كافية ، فهي تفقد جزيء الماء لتشكل مركبات حلقية خماسية أو سداسية منزوعة الماء (أنهيدراتية)
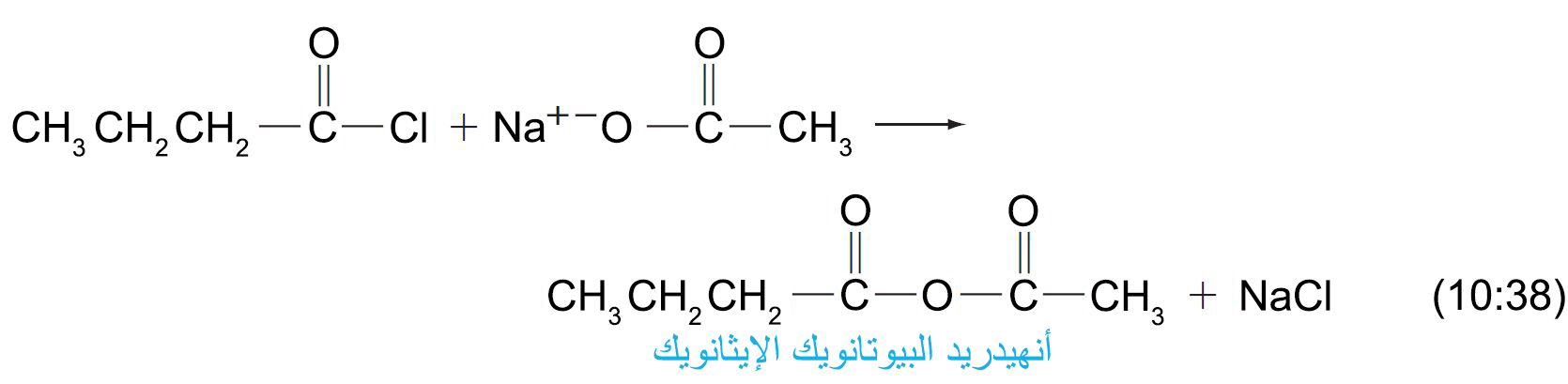
- يمكن أن تحضر الأنهيدريدات من كلوريدات الحمض و الأملاح الكربوكسيلية ، و يسمى الحمض الناتج و الذي يحضر من نوعين مختلفين من الحموض الكربوكسيلية باسم الأنهيدريدات المختلطة.
- تخضع الأنهيدريدات لتفاعلات الاستبدال الأسيلي النيوكليوفيلي، و هي أكثر نشاطا من الإسترات و لكنها اقل نشاطا من هاليدات الأسيل بالنسبة للنيوكليوفيلات.
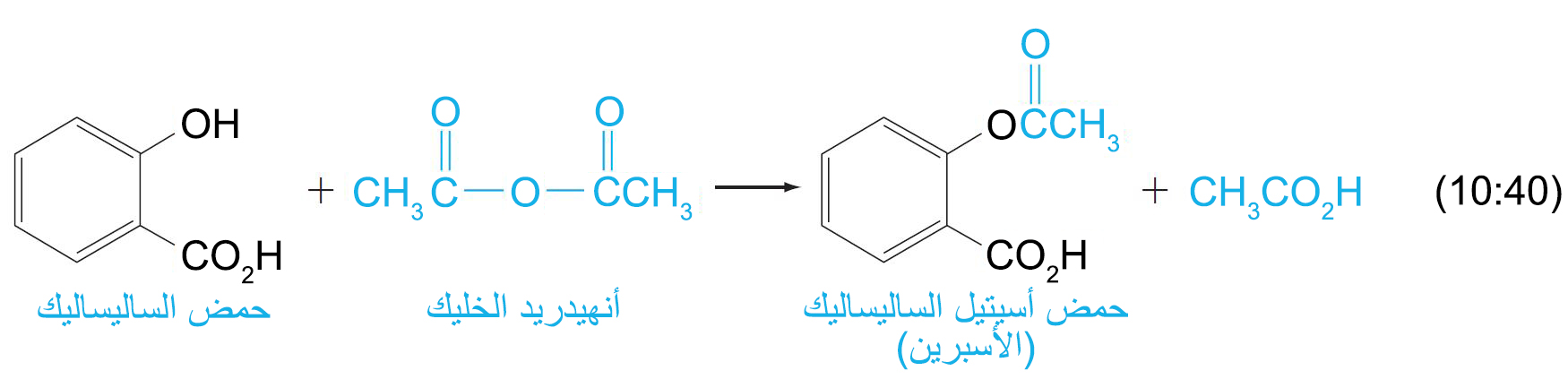
- يقال عن الكحول بأنه تأسلد acetylated (من أستلة) عندما يتم تحويله إلى الإستر الخلي الخاص به.
20 – الاميدات Amides
- الأميدات هي أحد مشتقات الحموض الكربوكسيلية و التي فيها تسابدل مجموعة OH- بمجموعة NH2‒ أو بمجموعة NHR- أو بمجموعة NR2‒ .
- أكثر الأميدات أهمية هي البروتينات .
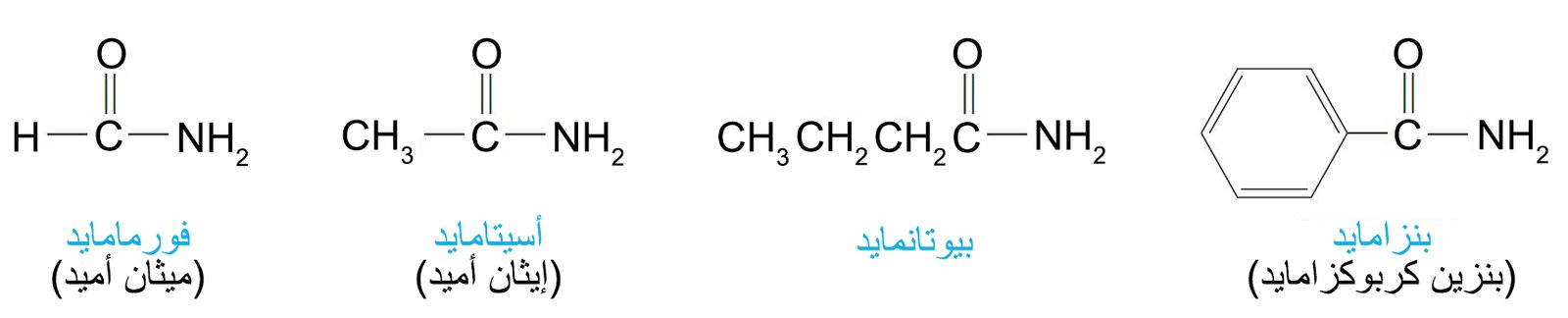
- الصيغة العامة للأميدات الأولية هي RCONH2.
- يمكن تحضير الأميدات الأولية بتفاعل الأمونيا مع الإسترات أو هاليدات الأسيل أو مع أنهيدريدات الحمض.
- يمكن تحضير الأميدات أيضًا بتسخين أملاح الأمونيوم للأحماض.
- تسمى الأميدات من خلال استبدال اللاحقة -يك أو -ويك من اسم الحمض باللاحقة أميد سواء كان ذلك في الاسم الشائع أو حسب نظام الأيوباك.
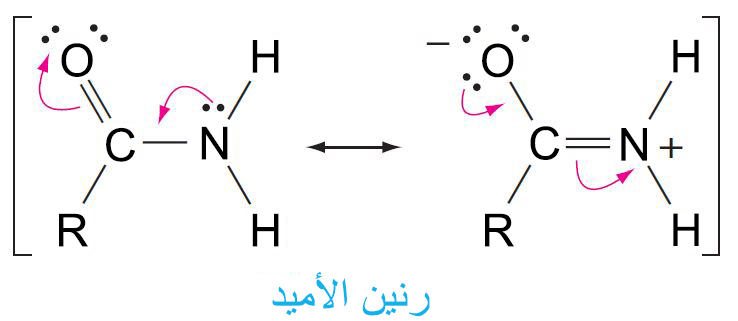
- للأميدات ترتيب هندسي مستوٍ.
- يكون الدوران حول الرابطة الكربون-النيتروجين مقيد بسبب حالة الرنين.
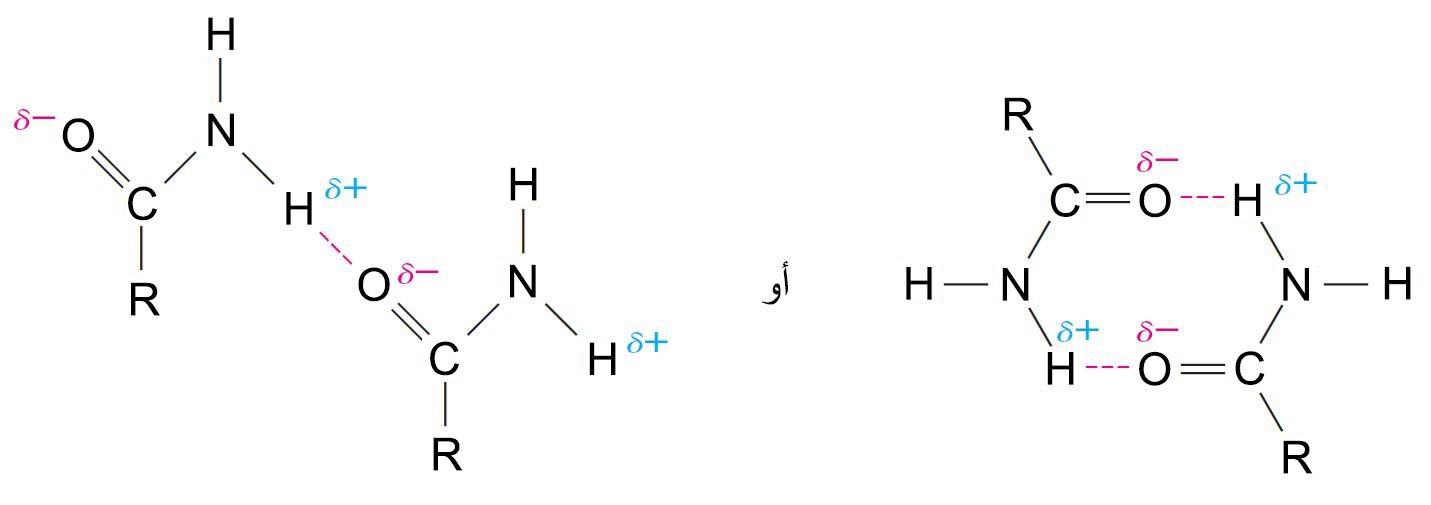
- إن قطبية الأميدات عالية و بالتالي يمكنها أن تشكل راوبط هيدروجينية قوية.
- للأميدات درجات غليان عالية بشكل استثنائي بالنسبة لأوزانها الجزيئية ، على الرغم من أنه كلما زادت مجموعات الألكيل المتصلة بذرة النيتروجين تقل درجتي الانصهار والغليان عن طريق تقليل احتمالات الترابط الهيدروجيني.
- و كما هو الحال مع مشتقات الحموض الأخرى فإنه يمكن للأميدات أن تتفاعل مع النيوكليوفيلات.
- يمكن اختزال الأميدات إلى أمينات عن طريق هيدريد الليثيوم الألومنيوم.
21 – ملخص لمشتقات الحموض الكربوكسيلية A Summary of Carboxylic Acid Derivatives
- تحدث جميع التفاعلات في الجدول أعلاه عن طريق مهاجمة النيوكليوفيل لذرة الكربون الكربونيلية في مشتقات الحموض الكربوكسيلية. و بالتالي يمكننا أن نستخدم تلك الفكرة للتنبؤ بتفاعلات جديدة. فمثلا تفاعل الإسترات مع كواشف جرينيارد يتطلب هجوم نيوكليوفيلي لكاشف جرينيارد على مجموعة الكربونيل. و مع الاخذ بعين الاعتبار بأن جميع مشتقات الحموض الكربوكسيلية معرضة للهجوم النيوكليوفيلي، فإنه من المفهوم بأن هاليدات الأسيل سوف تتفاعهل أيضا مع كواشف جرينيارد لإنتاج الكحولات الثالثية . و يمكن تمثيل الخطوة الأولى من التفاعل و التي ينتج عنها كيتون كما يلي:
- أحيانا يمكن استخلاص الكيتون، و لكن في العادة يتفاعل الكيتون مع مول آخر من كاشف جرينيارد لإنتاج الكحول الثالثي.
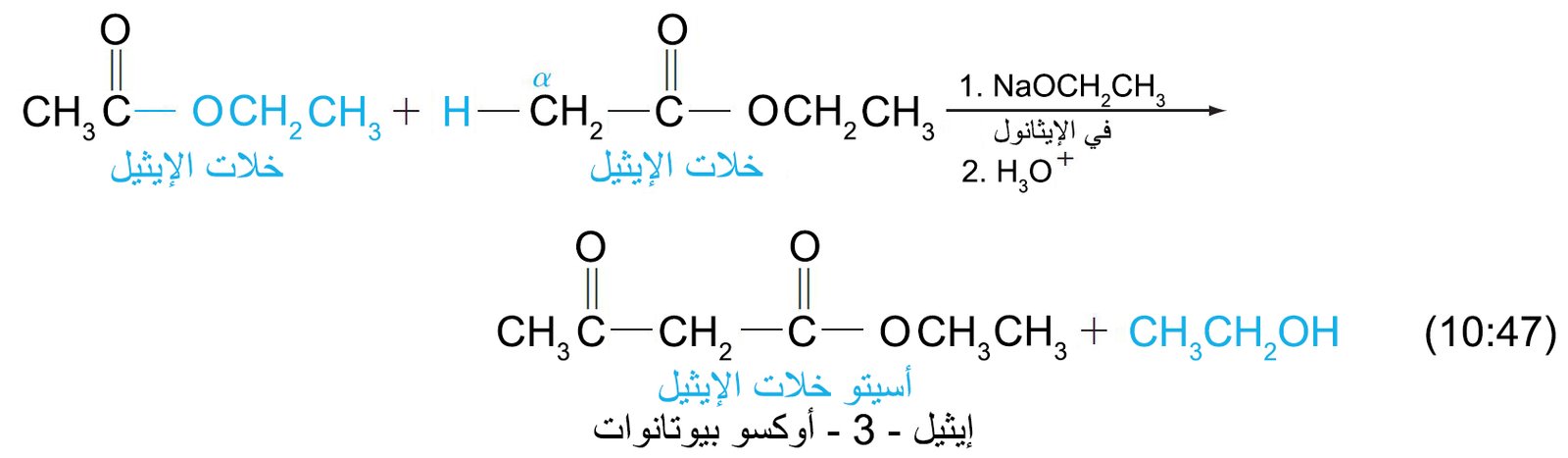
22 – ألفا – هيدروجين للإسترات؛ تكثيف كلايزن The α-Hydrogen of Esters; the Claisen Condensation
- ألفا هيدروجين هو مصطلح يطلق على ذرة الهيدروجين الملاصقة بمجموعة الكربونيل.
- إن ذرات ألفا- الهيدروجينية الخاصة بالإسترات هي ححموضا ضعيفة و بالتالي يمكن إزالتها عن طريق قاعدة قوية مثل ألكوكسيدات الصوديوم أو هيدريد الصوديوم، والناتج هو أنيون يطلق عليه اسم إينولات الإستر.
- يمكن لإينولات الإستر أن يقوم مقام النيوكليوفيل الكربوني و يالتالي يمكنه أن يضاف إلى مجموعة الكربونيل لجزيء إستر آخر. و يسمى تفاعل إضافة إينولات الإستر إلى مجموعة الكربونيل في إستر أخر اسم تكثيف كلايزن.
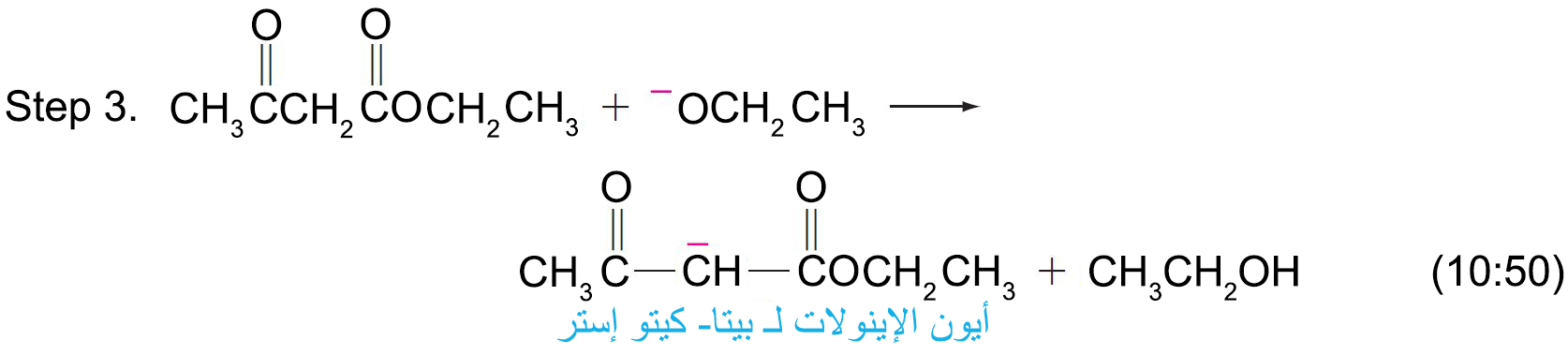
- عن طريق تكثيف كلايزن يمكننا أن نحضر بيتا كيتو إستر.
- يحدث تكثيف كلايزن خلال ثلاث خطوات:
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
2 thoughts on “الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives”
Leave a Reply Cancel reply
This site uses Akismet to reduce spam. Learn how your comment data is processed.




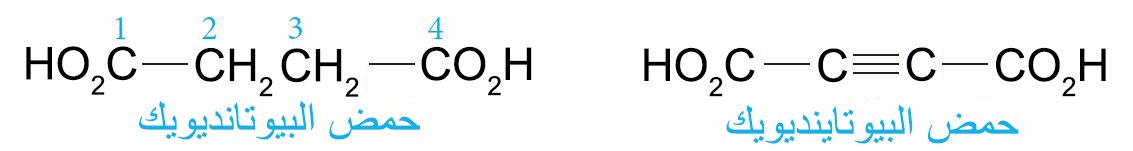


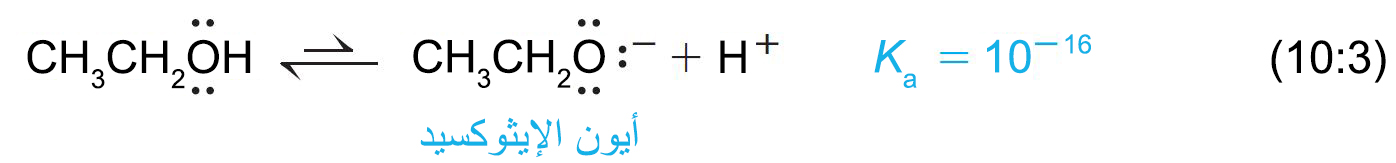




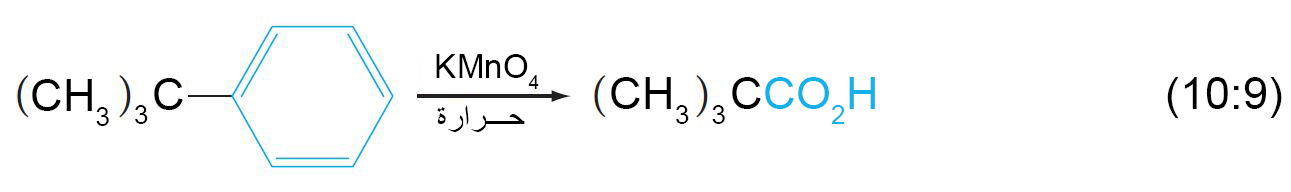
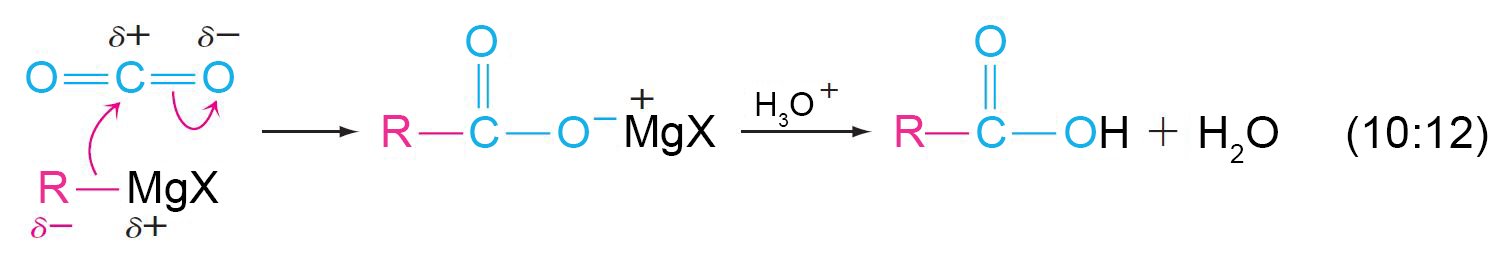

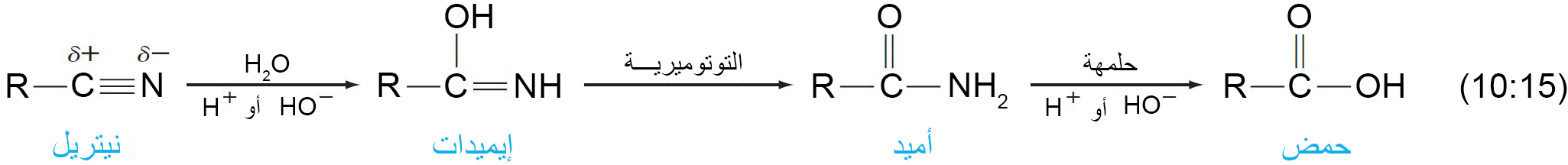





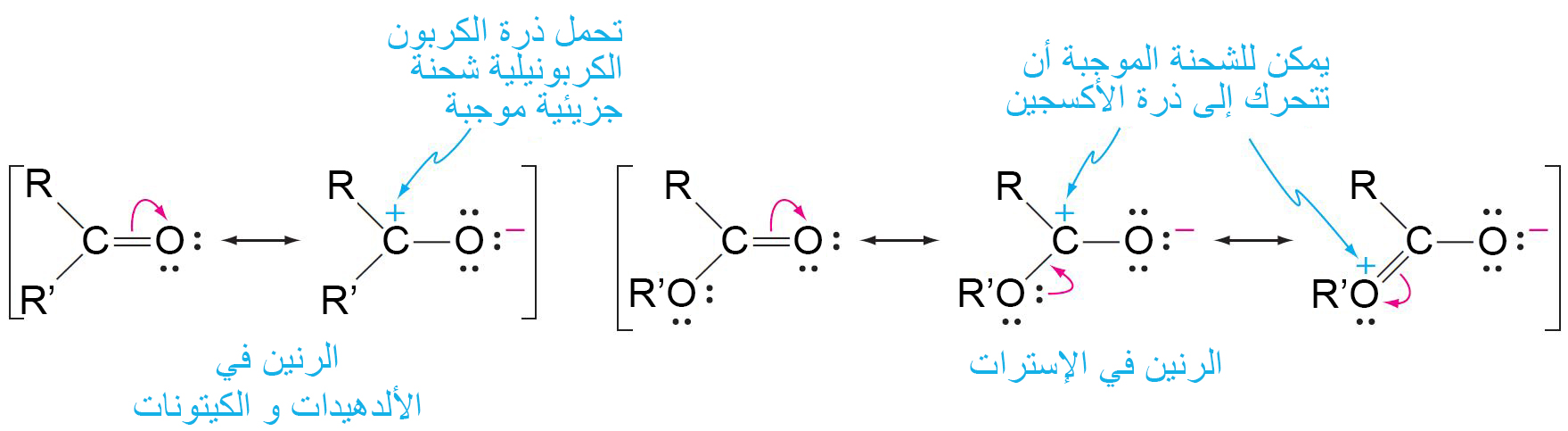



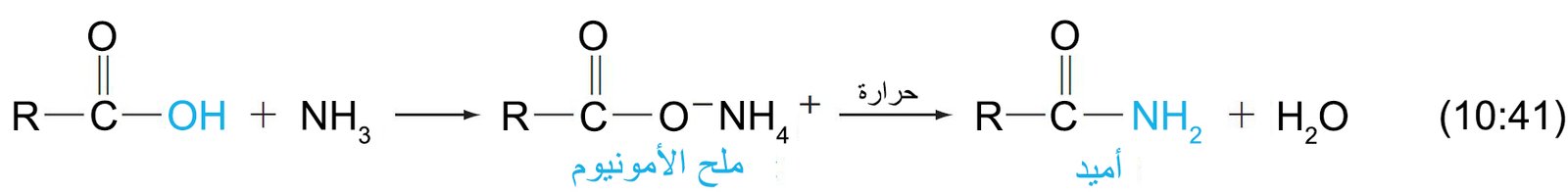






لماذا أضيف النتري لمشتقات الحوامض الكاربوكسيلي
ة؟؟
الاجابة تكمن في المعادلة رقم 41-10 من نفس المقال