الفلزات القلوية الترابية (الفلزات القلوية الأرضية ) – المجموعة الثانية
إذا كنت تبحث عن بوستر (لوحة) للقلوية الترابية فاضغط هنا
ملاحظة هامة حول مجموعة الفلزات القلوية الترابية (الفلزات القلوية الأرضية ) – المجموعة الثانية : إذا كنت تبحث عن ملف بوربوينت powerpoint فأرجو التوجه إلى المقال الآتي : سلايدات بوربوينت powerpoint كيمياء المجموعة الرئيسة – المجموعة 2(الفلزات القلوية الترابية – الفلزات القلوية الأرضية)
خصائص الفلزات القلوية الترابية –
المجموعة الثانية – القلويات الترابية
مقدمة
الفلزات القلوية الترابية، هي سلسلة من ستّة عناصر كيميائية في المجموعة الثانية من الجدول الدوري . هي عوامل مختزلة قوية بحيث تعطي إلكترونات بسهولة. هي أقل نشاطا من الفلزات القلوية، لكنها نشطة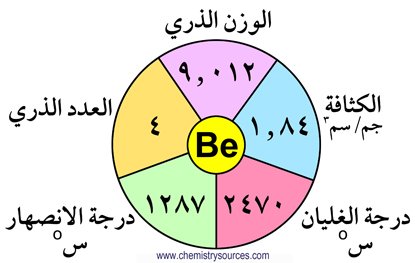 بما فيه الكفاية بحيث لا توجد حرة في الطبيعة. بالرغم من أنها هشّه ، ألا أن الفلزات القلوية الترابية قابلة للسحب و الطرق. هي جيدة التوصيل للتيار الكهربائي، وعندما تسخن، تحترق بسهولة في الهواء. الفلزات القلوية الترابية ترتب في المجموعة حسب الزيادة في العدد الذري كما يلي : البيريليوم Be، المغنيسيوم Mg، الكالسيوم Ca، السترونشيوم Sr، الباريوم Ba، و الراديوم Ra. أكسيدها تعرف بالقلويات الترابية.
بما فيه الكفاية بحيث لا توجد حرة في الطبيعة. بالرغم من أنها هشّه ، ألا أن الفلزات القلوية الترابية قابلة للسحب و الطرق. هي جيدة التوصيل للتيار الكهربائي، وعندما تسخن، تحترق بسهولة في الهواء. الفلزات القلوية الترابية ترتب في المجموعة حسب الزيادة في العدد الذري كما يلي : البيريليوم Be، المغنيسيوم Mg، الكالسيوم Ca، السترونشيوم Sr، الباريوم Ba، و الراديوم Ra. أكسيدها تعرف بالقلويات الترابية.
الخصائص العامة
 1 – مدارها الأخير يحتوي على إلكترونين .
1 – مدارها الأخير يحتوي على إلكترونين .
2 – حجومها الذرية صغيرة و لكنها أكبر من نظيرتها للفلزات القلوية . يزداد الحجم الذري في المجموعة كلما انتقلنا فيها من أعلى لأسفل .
3 – طاقات تأينها الأولى صغيرة و لكنها أكبر من تلك لعناصر الفلزات القلوية. و لكن طاقات تأينها الثانية مرتفعة جدا .
4 – كثافاتها قليلة مقارنة مع باقي العناصر ما عدا عناصر مجموعة الفلزات القلوية .
5 – تكوِّن أكاسيد قاعدية ، و عادة ما تكون مستقرة حراريا و من هنا جاءت التسمية « الفلزات القلويات الترابية».
6 – كربوناتها لا تذوب في الماء ، و لكن عند تسخين كربوناتها تتفكك إلى أكاسيد و ثاني أكسيد الكربون .
7 – نظرا لانخفاض طاقات تأينها ، تعتبر عناصر القلويات الترابية عوامل مختزلة قوية .
 8 – تعتبر الفلزات القلوية الترابية عناصر كهروموجبية عالية و لكنها أقل من تلك للفلزات القلوية ، و هذه الميزة تزداد في المجموعة كلما انتقلنا من أعلي لأسفل.
8 – تعتبر الفلزات القلوية الترابية عناصر كهروموجبية عالية و لكنها أقل من تلك للفلزات القلوية ، و هذه الميزة تزداد في المجموعة كلما انتقلنا من أعلي لأسفل.
9 – تتفاعل بشدة مع الحموض و ينتج عنها غاز الهيدروجين .
10 – عند احتراقها ينتج عنها الأكاسيد . و عند تفاعلها مع الماء ينتج غاز الهيدروجين .
11 – هاليدات البيريليوم مركبات تساهمية ككلوريد البيريليوم بينما هاليدات العناصر الأخرى مركبات أيونية .
12 – عند تعريضها للهب ينتج عنها ألوان مميزه لها .
13 – أكثر عنصرين من المجموعة توافرا في الطبيعة المغنيسيوم و الكالسيوم .
الأملاح و المركبات البسيطة للمجموعة الثانية
 تميل مركبات البيريليوم البسيطة اللامائية لأن تكون بطبيعتها تساهمية على الرغم من أنها عندما تتبلور من الماء ، فإن الأملاح المحتوية على الماء يتم تشكيلها +Be(H2O)4]2]. و كمثل أيون +Al(H2O)6]3] ، فإن أيون +Be(H2O)4]2]حمضيا بطبيعتها بسبب طاقة الاستقطاب العالية لأيون +Be2 الناتج عن عملية التميؤ . أما كأيونات عناصر المجموعة الثانية المتميئة فإنها غير حمضية و تحمل شحنتها الخاصة بها .
تميل مركبات البيريليوم البسيطة اللامائية لأن تكون بطبيعتها تساهمية على الرغم من أنها عندما تتبلور من الماء ، فإن الأملاح المحتوية على الماء يتم تشكيلها +Be(H2O)4]2]. و كمثل أيون +Al(H2O)6]3] ، فإن أيون +Be(H2O)4]2]حمضيا بطبيعتها بسبب طاقة الاستقطاب العالية لأيون +Be2 الناتج عن عملية التميؤ . أما كأيونات عناصر المجموعة الثانية المتميئة فإنها غير حمضية و تحمل شحنتها الخاصة بها .
[Be(H2O)4]2+ + H2O ⇋ [Be(HO)(H2O)3]+ + H3O+
و عليه فإن +Be(H2O)4]2] يوجد فقط في المحاليل الحمضية القوية . أما كلوريد البيريليوم BeCl2 فهو مبلمر في حالته الصلبة و يحتوي على الرابطة الجسرية Cl-Be-Cl . و لكن عند تسخينه فإن المبلمر يتفكك ناتجا عن ذلك خليط من BeCl2 و Be2Cl4 حيث يكونا في حالة اتزان . أما هاليدات البيريليوم اللامائية فهي مستقرة في العديد من المذيبات و تميل إلى تشكيل المتراكبات .
 و عند دراسة كلوريدات و بروميدات و يودات المغنيسيوم و الكالسيوم و الباريوم فيلاحظ بأنها جميعا أملاحا أيونية و قابلة للذوبان في الماء . أما الفلوريدات فهي شحيحة الذوبان في الماء بسبب طاقات الشبكية العالية حيث الكاتيونات ثنائية الشحنة الموجبة و أنيونات الفلوريد السالبة الصغيرة في الحجم. كما يعرف عن هذه المجموعة العديد من كبريتات عناصرها ذات الصيغة العامة MSO4 حيث يلاحظ بأن ذائبيتها في الماء تقل كلما انتقلنا في المجموعة من أعلى لأسفل . و عند تسخين تلك الكبريتات عند درجات حرارة عالية فإنه ينتج عنها أكسيد الفلز.
و عند دراسة كلوريدات و بروميدات و يودات المغنيسيوم و الكالسيوم و الباريوم فيلاحظ بأنها جميعا أملاحا أيونية و قابلة للذوبان في الماء . أما الفلوريدات فهي شحيحة الذوبان في الماء بسبب طاقات الشبكية العالية حيث الكاتيونات ثنائية الشحنة الموجبة و أنيونات الفلوريد السالبة الصغيرة في الحجم. كما يعرف عن هذه المجموعة العديد من كبريتات عناصرها ذات الصيغة العامة MSO4 حيث يلاحظ بأن ذائبيتها في الماء تقل كلما انتقلنا في المجموعة من أعلى لأسفل . و عند تسخين تلك الكبريتات عند درجات حرارة عالية فإنه ينتج عنها أكسيد الفلز.
MSO4 → MO + SO3
و يظهر جليا ميل أملاح البيريليوم للتفكك و التحلل مقارنة مع أملاح باقي عناصر المجموعة الثانية المقابلة لها حيث يلاحظ بأن استقرار تلك الأملاح تزداد كلما انتقلنا في المجموعة من أعلى لأسفل . فكربونات البيريليوم BeCO3 توجد فقط عندما تتبلور بوجود CO2 ، و عند تفكك كربونات المغنيسيوم أو الكالسيوم أو السترونشيوم بالتسخين فإنه ينتج عنها أكسيد الفلز و ثاني أكسيد الكربون .
MgCO3 → MgO + CO2
أما الأملاح الكربوكسالاتية للفلزات من المغنيسيوم إلى الباريوم فهي من نوع M(O2CR)2 ، و لكن عند تفاعل هيدروكسيد البيريليوم مع الحموض الكربوكسيلية فإنه تنتج الأملاح الكربوكسيلية القاعدية من نوع Be4O(O2CR)2.
الخصائص الكيميائية
1 – التفاعل مع الأكسجين
يمكن لعناصر المجموعة الثانية أن تحترق بوجود الأكسجين فينتج عن ذلك الأكاسيد الأحادية MO ، و لكن يمكن لأكسيد السترونشيوم SrO و أكسيد الباريوم BaO أن يمتصا الأكسجين تحت ضغط محدد فينتج عنهما فوق الأكسيد MO2 . كما يلاحظ بأنه لا يمكن تكوين فوق الأكاسيد و الأكاسيد العليا باحتراق الفلز كما أنها تكون غير مستقرة لأن أيونات الفلز الصغيرة تمتلك طاقة استقطاب عالية و تعمل على ميل أملاح فوق الأكاسيد و الأكاسيد العليا لأن تتفكك إلى أكاسيد أحادية MO .
عند دراسة الأكاسيد الأحادية يلاحظ بأنها قاعدية و تتفاعل مع الماء لتعطي الهيدروكسيدات M(OH)2 و التي يمكن أن تحضر بإضافة أيونات –OH إلى محاليل أيونات+M2 ، حيث يلاحظ بأن هيدروكسيد الباريوم Ba(OH)2 الأكثر استقرارا و الأكثر ذوبانا في الماء .
CaO + H2O → Ca(OH)2
Mg2+ + 2OH– → Mg(OH)2
و تتميز عناصر هذه المجموعة بأنها أقل تأكسدا بالهواء مقارنة مع عناصر المجموعة الأولى .
2Mg + O2 → 2MgO
Ba + O2 → BaO2
2 – التفاعل مع الماء
تتفاعل عناصر هذه المجموعة مع الماء ببطء حيث يتنج عن ذلك تصاعد للأكسجين و تكوين الهيدروكسيدات الفلزية .
Ca + 2H2O → Ca(OH)2 + H2
3 – التفاعل مع الهيدروجين
يمكن لجميع فلزات المجموعة الثانية (ما عدا البيريليوم) أن تشكل الهيدريدات الثنائية MH2 ، و ذلك بحرق الفلز بوجود الهيدروجين . أما هيدريد البيريليوم و الذي هو غير مستقر فإنه يجب أن يحضر بطريقة غير مباشرة عن طريق التحلل الحراري للمركب ثنائي-ثلاثي-بيوتيل البيريليوم . فهيدريد المغنيسيوم مركب تساهمي بينما الهيدريدات الأخرى أيونية .
Mg + H2 → MgH2
4- التفاعل مع الهالوجينات
جميع عناصر هذه المجموعة تتفاعل مع الهالوجينات عند درجات حرارة عالية من نوع MX2 . فهاليدات البيريليوم مركبات تساهمية بينما هاليدات العناصر الأخرى أيونية لذلك فإنها تذوب في الماء و توصل التيار الكهربائي في محاليلها المائية و في حالتها المنصهرة .
Mg + Cl2 → MgCl2
Ca + Br2 → CaBr2
5 – التفاعل مع النيتروجين
يمكن لجميع عناصر المجموعة الثانية أن تشكل النيتريد M2N2 و ذلك عند تسخين الفلز و النيتروجين ، و عندما تتفاعل النيتريدات مع الماء فإنها تنتج الأمونيا.
3Mg + N2 → Mg3N2
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
كما يمكن لفلزات المجموعة الثانية أن تذوب في محلول الأمونيا (هيدروكسيد الأمونيوم) و ينتج عن ذلك محاليل زرقاء اللون تحتوي على إلكترونات حرة.
6 – التفاعل مع الكربون
يمكن لفلزات المجموعة الثانية أن تشكل أنواعا مختلفة من الكربيدات.فالمغنيسيوم و الكالسيوم و السترونشيوم و الباريوم تشكل كربيدات من نوع MC2 ، و المثال على ذلك كربيد الكالسيوم CaC2 ، و جميع تلك الكربيدات تحتوي على أيون –C22 . أما البيريليوم و المغنيسيوم فإنهما يشكلان نوعان آخران من الكربيدات . فالبيريليوم يشكل Be2C عند اتحاده مباشرة مع الكربون .
إن أكثر المركبات الفلزية العضوية أهمية لفلزات المجموعة الثانية هي كواشف جريجنارد RMgX حيث X هاليد .
R-Cl + Mg → RMgCl
و تستخدم كواشف جريجنارد لتكوين روابط الكربون-الكربون من خلال إضافة مجموعة الكربونيل . كما تعرف أيضا مركبات المغنيسيوم العضوية و هي أقل دراسة و شهرة من كواشف جريجنارد ، و من الأمثلة عليها ثنائي ميثيل المغنيسيوم .
7 – التفاعل مع الحموض المخففة تتفاعل الفلزات القلوية الترابية مع الحموض المخففة بوتيرة تزداد كلما انتقلنا في المجموعة من أعلى لأسفل . فالبيريليوم يتفاعل ببطء مع الحموض و لكن المغنيسيوم يتفاعل بسرعة معها ، أما العناصر السترونشيوم و الباريوم و الراديوم فإنها تتفاعل بعنف مع الحموض.
Ca + 2HCl→ CaCl2 + H2
Mg + H2SO4 → MgSO4 + H2
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة