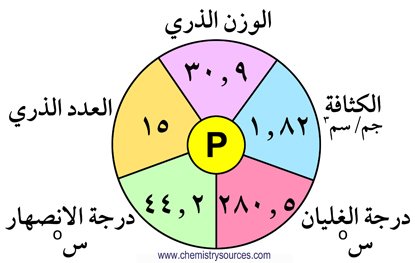
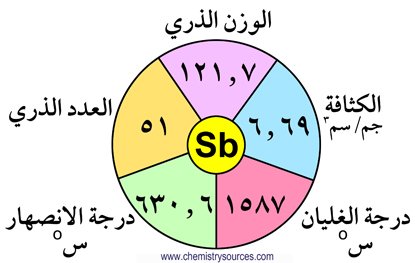
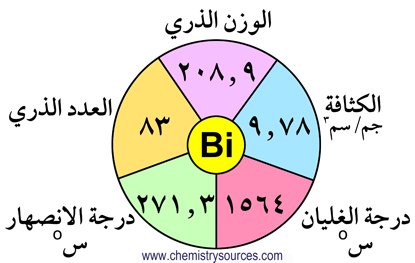
المجموعة الخامسة- المجموعة 15- النكتوجينات
ملاحظة هامة حول المجموعة الخامسة- المجموعة 15- النكتوجينات : إذا كنت تبحث عن ملف بوربوينت powerpoint فأرجو التوجه إلى المقال الآتي : سلايدات بوربوينت powerpoint كيمياء المجموعة الرئيسة – المجموعة الخامسة (15) – مجموعة النيتروجين
مقدمة
تحتوي المجموعة الخامسة عشر على العناصر التالية : النيتروجين (N) ،الفوسفور (P) ، الزرنيخ (As) ، الأنتيمون (Sb) ، البزموث (Bi) . و تتميز هذه المجموعة بتوزيع عناصرها الإلكتروني الذي ينتهي بالصيغة ns2 np3 . و يلاحظ في هذه المجموعة أن الصفات الفلزية تزداد مع ازدياد العدد الذري ، و يلاحظ أيضا التدرج في الخصائص و الصفات كلما انتقلنا من النيتروجين إلى البزموث .
فالنيتروجين و الفوسفور تعتبر عناصر لا فلزية ، بينما الزرنيخ و الأنتيمون عناصر شبه فلزية و البزموث عنصر فلزي. يوجد النيتروجين حرا في الطبيعة على شكل N2 ، كما يوجد و بكميات كبيرة على شكل مركب غير عضوي وهو نترات النيتروجين يعرف باسم ملح شيلي . يمكن تحضير النيتروجين في المختبر من خلال تفاعل نتريت الصوديوم مع كلوريد الأمونيوم و من ثم تسخين نتريت الأمونيوم:
NH4Cl + NaNO2 → NaCl + NH4NO2
NH4NO2 → N2 + 2H2O
أما الفوسفور فهو لا يوجد حرا في الطبيعة و لكنه يوجد في شكل مركبات عدة من بينها فوسفات الكالسيوم مثلا ، و أيضا يوجد في العديد من المعادن مثل
الأباتيت Ca5X(PO4)3 .
الخصائص العامة
1 – مدارها الأخير يحتوي على خمسة إلكترونات .
2 – تعرف هذه المجموعة باسم النيكتوجينات أو الخانقات بالعربية.
3 – يشكل النيتروجين 78% من الغلاف الجوي .
4 – أكثر عناصر المجموعة انتشارا في القشرة الأرضيه هو الفوسفور .
5 – حيث أن الفلك p نصف ممتليء فإن هذه العناصر تعتبر مستقرة .
6 – النيتروجين مادة غازية بينما الفوسفور و الزرنيخ و البزموث موادا صلبة.
7 – يوجد النيتروجين على شكل جزى ثنائي الذره برابطة ثلاثية N≡N .
8 – توجد العناصر الفوسفور و الزرنيخ و الأنتيمون على شكل جزيء رباعي الذرات و تركيبه الهندسي رباعي الأوجه .
9 – الحجم الذري يزداد في المجموعة من أعلى لأسفل .
10 – بسبب حجم النيتروجين الصغير نسبيا فإنه يمتك كهرسالبية عالية.
11 – الكهرسالبية تقل في المجموعة من أعلى لأسفل .
12 – درجة الانصهار في المجموعة تزداد من النيتروجين إلى الزرنيخ و من ثم تنخفض .
13 – بسبب الحجم الكبير و الخصائص الفلزية للانتيمون و البزموث فإن درجة حرارة انصهارهما تكون منخفضة.
14 – يوجد للفوسفور ثلاثة حالات تآصلية و هي الفوسفور الأبيض و الأحمر و الأسود.
15 – يظهر الفوسفور حالة تأكسد -3 في بعض المركبات مثل Zn3P2 .
16 – يظهر النيتروجين عدة حالات تأكسد.
هيدريدات عناصر المجموعة الخامسة عشر
يمكن لعناصر المجموعة الخامسة أن تتفاعل مع الهيدروجين تشكل هيدريدات من نوع MH3 ، مع وجود اختلافات في الخصائص الكيميائية و الفيزيائية فيما بينها . فعند دراستها يلاحظ بأن درجات غليانها تزداد كلما انتقلنا في المجموعة من أعلى لأسفل مع وجود حالة شاذه و هي الأمونيا NH3 حيث درجات غليانها مرتفة بسبب وجود الرابطة الهيدروجينية H…N-H . كما أنه يلاحظ بأن زاوية الرابطة H-M-H تقل كلما انتقلنا في المجموعة من أعلى لأسفل وكذلك الإستقرارية الحرارية تقل من أعلى لاسفل أيضا . ومن أشهر تلك المركبات الأمونيا NH3 و الفوسفين PH3 ، الزرنيخين AsH3 ، الأنتيمونين SbH3 والبزموثين BiH3 . و يمكن تحضير الهيدريدات تقريبا بنفس الطريقة و ذلك عن طريق إما تميؤ المركبات الثنائية لتلك العناصر أو من خلال تفاعلها مع الحموض المخففة .
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Ca3P2 + 6HCl → 3CaCl2 + 2PH3
و عند دراسة هيدريدات المجموعة الخامسة عشر يلاحظ ما يلي :
1 – استقرارية الهيدريدات تقل كلما انتقلنا في المجموعة من أسفل لأعلى أي أن NH3 أكثر استقرارا من BiH3 ، لأن حجم الذرة المركزية يزداد و بالتالي تصبح الرابطة الفلز-الهيدروجين أكثر ضعفا .
2 – الخاصية الإختزالية للهيدريدات تزداد تدريجيا من أعلى لأسفل ، لذلك يلاحظ أن الأنتيمونين و البزموثين عوامل مختزلة قوية.
3 – الأمونيا NH3 و الفوسفين PH3 غازان متطايران و عديمان اللون .
4 – الاستقرارية الحرارية لتلك الهيدريدات تقل من أعلى لأسفل المجموعة لذلك نجد بأن أقلها استقرارا هو BiH3 بسبب الانخفاض في طاقة الرابطة M-H .
5 – لجميع تلك الهيدريدات شكل هرمي مع تواجد زوج من الإلكترونات على الذرة المركزية . و بسبب تواجد تلك الإلكترونات فإن تلك الهيدريدات ممكن اعتبارها قواعد لويس. و يمكن ترتيب تلك الهيدريدات حسب قوتها القاعدية كما يلي :
NH3 > PH3 > AsH3 > SbH3 > BiH3
6 – بسبب الفارق العالي في الكهرسالبية بين النيتروجين و الهيدروجين ، فإن الأمونيا قادر على تشكيل روابط هيدروجينية .
هاليدات عناصر المجموعة الخامسة عشر
يمكن لعناصر المجموعة الخامسة أن تتفاعل مع الهالوجينات لتشكيل الهاليدات الثلاثية و الخماسية . فالهاليدات الثلاثية يكون تهجينها من نوع sp3 و تركيبها الهندسي رباعي الأوجه الممدد أو هرمي . بينما الهاليدات الخماسية يكون تهجينها من نوع sp3d و شكلها البنائى هرمي ثنائي مزدوج. يمكن تميؤ الهاليدات الثلاثية بتفاعلها مع الماء ، حيث تقل عملية التميؤ في المجموعة من أعلى لأسفل، فنلاحظ بأن NCl3 يتميأ بسهوله و لكن تكون هناك صعوبة في عملية تميؤ SbCl3 و BiCl3 . و نلاحظ هنا إلى أنه لا يمكن تميؤ NF3 بسبب عدم تواجد فلك d فارغ مع النيتروجين ، و أيضا لا يمكن تميؤ PF3 و PF5 لأن الرابطة P-F أقوى من الرابطة التساهمية P-O .
نتائج تميؤ بعض هاليدات عناصر هذه المجموعة يمكن توضيحها من خلال التفاعلات التالية :
NCl3 + 3H2O → NH3 + 3HOCl
PCl3 + 3H2O → H3PO3 + 3HCl
2AsCl3 + 3H2O → As2O3 + 6HCl
BiCl3 + H2O → BiOCl + 2HCl
و ما عدا NF3 يلاحظ أن هاليدات النيتروجين غير مستقرة و تتفكك بعنف شديد . فثلاثي فلوريد النيتروجين NF3 مادة مستقرة و خاملة ، بينما مادة ثلاثي كلوريد النيتروجين شديدة الانفجار و خطيرة جدا.
ثلاثي فلوريد أو ثلاثي كلوريد الفوسفور أو الأنتيمون يمكن اعتبارها حموضا ودرجة الحموضة تقل في المجموعة كلما انتقلنا من أعلى لأسفل :
PCl3 > AsCl3 > SbCl3
كما أن النيتروجين لا يمكن أن يكوِّن خماسي الهاليد بسبب عدم توفر فلك d فارغ. خماسي كلوريد الفوسفور PCl5 غير مستقر بسبب طول الروابط المحورية و بالتالي ضعفها ، و عليه يتفكك خماسي كلوريد الفوسفور إلى PCl3 و Cl2 .
PCl5 ⇋ PCl3 + Cl2
و عند تميؤ خماسي كلوريد الفوسفور PCl5 ينتج حمض الأورثوفوسفوريك.
PCl5 + 4H2O → H3PO4 + 5HCl
إن عدم استقرارية مادة خماسي كلوريد الفوسفور PCl5 تجعله لأن يكون عامل كلورة ممتاز . جميع خماسي الألدهيدات تعتبر حموضا لأنها يمكن أن تستقبل زوجا من الإلكترونات من أيون الهاليد .
كما أن مادة خماسي كلوريد الفوسفور PCl5 تعتبر مركبا أيونيا و تتفاعل مع الرطوبة لذك يجب حفظها في زجاجات محكمة الإغلاق .
و بسبب كبر حجم ذرات اليود و الفارق البسيط في الكهرسالبية بين اليود و الفوسفور فإنه لا يمكن أن توجد PI5 .
النيتريدات و الفوسفيدات
هناك بعض الفلزات النشطة مثل الليثيوم و فلزات المجموعة الثانية يمكن أن تكون النيتريدات و التي تحتوي على أيون النيتريد –N3 ، و عند تميؤ تلك المواد فإنها تنتج الأمونيا .
Li3N + 3H2O → NH3 + 3Li+ + 3OH–
و يمكن للفوسفور و الزرنيخ أن تشكل الفوسفيدات و الزرنيخيدات و التي عند تميؤها تنتج PH3 و AsH3 .
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :