الهيدروجين – خصائص و معلومات عن غاز الهيدروجين Hydrogen
Posted in :
الهيدروجين – خصائص و معلومات عن غاز الهيدروجين Hydrogen
بحث عن غاز الهيدروجين و خصائص غاز الهيدروجين و معلومات عن غاز الهيدروجين
الهيدروجين عنصر كيميائي غازي ، عديم اللون والرائحة و يعتبر من أخف العناصر على الإطلاق و الأكثر انتشارا في الكون و رمزه H ، عدده الذري 1 و وزنه الذري 1.008 و.ك.ذ، و كثافته 0.0899 جرام /سم3 ، درجة انصهاره -259.14 و درجة غليانه -252.87 درجة سيليزية . فهو يوجد في في الماء و في جميع المركبات العضوية . للهيدروجين ثلاثة نظائر فالهيدروجين الموجود في الطبيعة يوجد على شكل نظيرين مستقرين وهما 
بعض التريتيوم ينتج في الطبقات العليا من الغلاف الجو عن طريق قصف النيتروجين بنيوترونات نشطة تنتج من الأشعة الكونية . و قد لوحظ بأن مياه الامطار تحتوي على كميات نذرة جدا من التريتيوم . يدخل التريتيوم في صناعات القنابل الهيدروجينية و أيضا كمادة مرمزة في بعض التفاعلات البيوكيميائية .
غاز الهيدروجين يوجد على شكل جزيء ثنائي الذرة و هو على نوعين أورثو هيدروجين حيث يكون غزل النواة متواز و النوع الآخر هو الباراهيدروجين حيث يكون غزل النواة غير متواز . المصدر الاساسي للهيدروجين هي الغازات المتصاعدة عن الغاز الطبيعي كما يمكن تحضير الهيدروجين عن طريق التحليل الكهربائي للماء و الاستخدام الاساسي للهيدروجين يدخل في صناعة الأمونيا ، كما يدخل الهيدروجين في العديد من الصناعات مثل اختزال الخامات المؤكسدة و تكرير البترول و انتاج الهيدروكربونات من الفحم و هدرجة الزيوت النباتية. وحاليا يستخدم الهيدروجين كمصدر من مصادر الوقود كما هو الحال في خلية الوقود . عمليا يتفاعل الهيدروجين مع أغلب الفلزات . اكتشف الهيدروجين عام 1776 من قبل الكيميائي البريطاني هنري كافينديش .
موضع الهيدروجين في الجدول الدوري
من العروف أن ذرة الهيدروجين تتكون من نواة يوجد فيها بروتون يحمل شحنة واحدة موجبة و يدور حولها إلكترون يحمل شحنة سالبة و توزيعة الإلكتروني 1s1 ، و عليه و بناء على دراسة خواص الهيدروجين يمكن وضعه في قمة المجموعة الأولى أو في قمة المجموعة السابعة عشر (الهالوجينات) نظرا لوجود أوجه التشابه بين الهيدروجين و هاتين المجموعتين.
الوجود:
1 – في حالته الحرة : يوجد الهيدروجين بكميات قليلة في الجو و في الغازات البركانية و حول الشمس.
2 – يوجد متحدا مع العناصر الأخرى :
أ – يمثل 0.1 % من وزن H2O .
ب – يوجد الهيدروجين متحدا مع الأكسجين كأحد المكونات الرئيسة في أنسجة الحيوانات و النباتات.
ج – يوجد الهيدروجين متحدا مع الكربون في النفط و مع الكربون و الأكسجين في الشحوم و الخشب و الكربوهيدرات.
د – يمثل العنصر الرئيس في أغلب الحموض مثل HCl و H2SO4 .
التحضير :
1 – طريقة الإزاحة
أ – إزاحة أيونات الهيدروجين +H :
يمكن لعنصر يمتلك شحنة موجبة أعلى من الهيدروجين أن يزيحه من محاليله .
مثال :
Zn → Zn2+ + 2e_
2H+ + 2e_ → 2H (atom) ≡ H2 (molecule)
Zn + 2H+ → Zn2+ + H2
يمكن قياس قابلية ميل الفلز للإزاحة من خلال جهد القطب القياسي ، حيث تم ترتيب الفلزات في سلسة توضح ذلك تعرف باسم السلسلة الدافعة الكهربائية أو السلسلة الكهركيميائية حسب موقعها من الهيدروجين .
و السلسلة الدافعة الكهربائية هي قائمة بالفلزات والهيدروجين مرتبة حسب ميلها لفقد الإلكترونات أثناء التفاعل الكيميائي. والفلزات التي يزيد فقدانها الإلكترونات عن الهيدروجين تُرتب قبله في السلسلة، بينما تُرتب تلك التي يقل ميلها لفقد الإلكترونات عن الهيدروجين بعده في هذه السلسلة.
1 – الفلزات الموجودة ما بعد الهيدروجين مثل الصوديوم و البوتاسيوم و الليثيوم تعتبر نشطة جدا ، فهي تتفاعل مع الماء البارد أو حمض الهيدروكلوريك بعنف و ينتج عن تفاعلها مع الحموض انفجارات عنيفة.
2Na + 2H2O → 2NaOH + H2
2K + 2HCl → 2KCl + H2
2 – يتفاعل عنصري الباريوم و الكالسيوم مع الماء الساخن أو حمض الهيدروكلوريك الساخن كما يلي :
Ba + 2H2O → Ba(OH)2 + H2
Ca + 2HCl → CaCl2 + H2
3 – يحل الخارصين و الألومنيوم محل الهيدروجين في المحاليل الحمضية و القلوية بسبب كون هيدروكسيدات تلك الفلزات أمفوتيرية.
Zn + 2H+ → Zn2+ + H2
Zn + 2OH_ → ZnO22_ + H2
2Al + 6H+ → 2Al3+ + 3H2
3 – العناصر ما فوق الهيدروجين تتفاعل مع بخار الماء و تفاعلاتها عكسية ، ففي طريقة لين مثلا يمرر بخار الماء الساخن على فلز الحديد الساخن لدرجة الأحمرار فيتأكسد الحديد مكونا أكسيد الحديد Fe3O4 .
3Fe (red hot) + 4H2O ⇋ Fe3O4 + 4H2
4 – العناصر ذات القيمة الموجبة لا يمكن أن تحل محل الهيدروجين مباشرة من البخار أو الحموض المخففة ، و تعرف بالفلزات الخاملة ، مثال النحاس ، الذهب و الفضة .
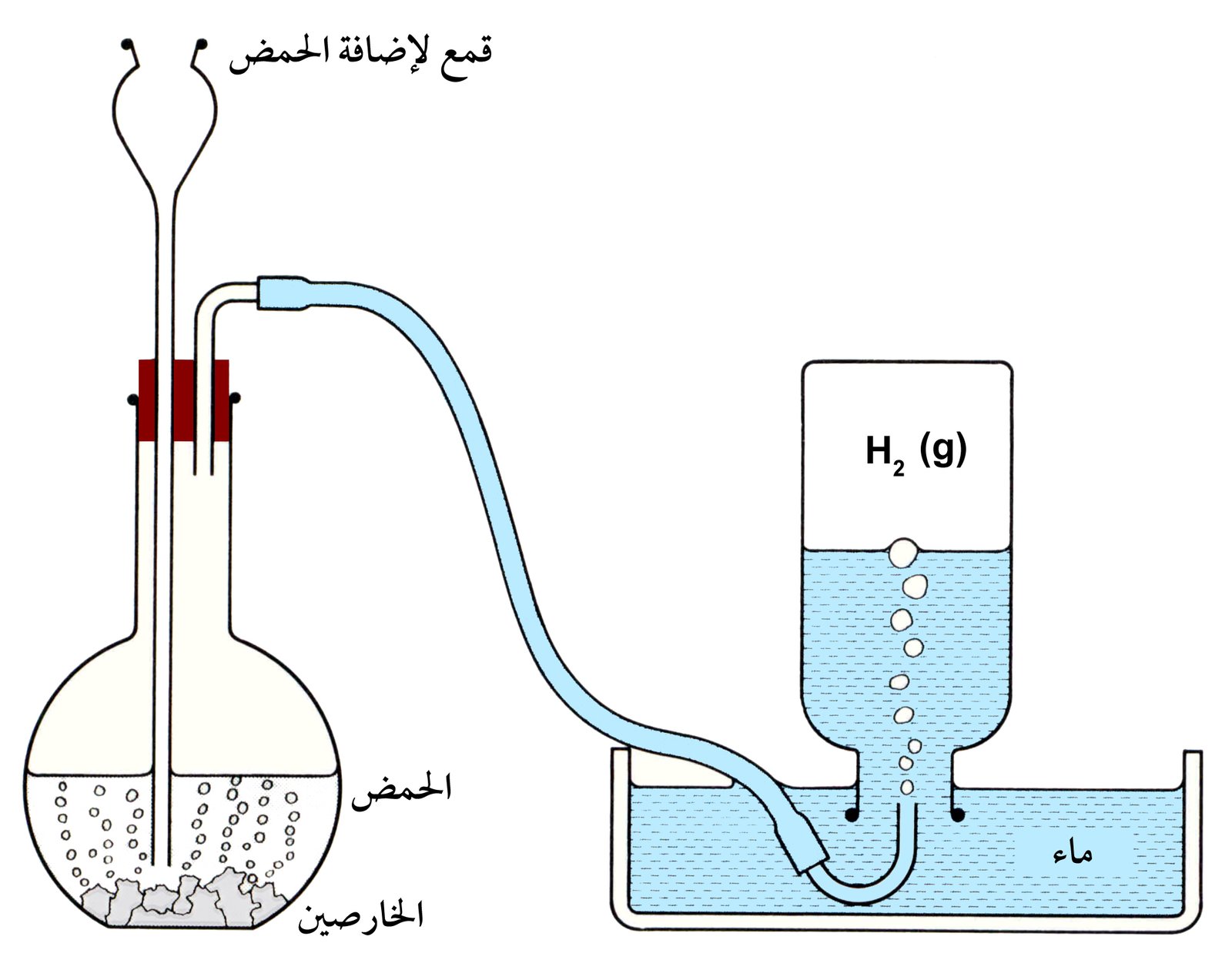
يمكن تحضير الهيدروجين في المختبر من خلال تفاعل أحد الفلزات مع حمض الهيدروكلوريك :
Zn + 2HCl → ZnCl2 +H2
غاز الهيدروجين الناتج غير نقي و يحتوي على الرطوبة و الزرنيخ AsH3 و الهيدروكربونات و غاز ثاني أكسيد الكبريت و و حمض الهيدروكلوريك و كبريتيد الهيدروجين و ذلك بسبب تفاعل غاز الهيدروجين المولَّد مع الشوائب مثل الزرنيخ و الكربون الموجودة في مسحوق الخارصين .
يمكن تنقية غاز الهيدروجين الناتج من خلال إمراره في محلول قوي من برمنجنات البوتاسيوم KMnO4 لإزالة الشوائب الحمضية و كذلك إمرار الغاز الناتج فوق نحاس ساخن لإزالة AsH3 و فوق كلوريد الكالسيوم CaCl2 لإزالة الرطوبة .
ب – طريقة استبدال ذرات الهيدروجين
يمكن استبدال ذرات الهيدروجين بتفاعل بخار الماء مع الحديد الساخن لدرجة الأحمرار عند درجة حرارة 800 درجة سيليزية و هذه الطريقة تستخدم لتحضير غاز الهيدروجين على النطاق التجاري.
3Fe(red hot) + 4H2O ⇋ Fe3O4 + 4H2
و في حالة الكربون فإن التفاعل يحدث عند درجة حرارة 1000 درجة سيليزية:
C(red hot) + H2O ⇋ CO + H2
يمكن إزالة أول أكسيد الكربون عن غاز الهيدروجين بالإسالة أي بتخفيض درجة الحرارة حيث يتم تسييل أول أكسيد الكربون أولا. أو يمكن لكلا الغازين أن يتفاعلا مع بخار الماء بوجود عامل مساعد و هو أكسيد الحديد (III) و من ثم إمرار الغازات الناتجة بماء الجير فيتم إزالة غاز ثاني أكسيد الكربون .
CO + H2+ H2O(steam) → CO2 + 2H2
2 – طريقة تفكيك مركبات الهيدروجين
يمكن تفكيك مركبات مثل يوديد الهيدروجين HI و الأرسين AsH3 و الأسيتيلين HC≡CH و الأمونيا NH3 و كبريتيد الهيدروجين H2S ، للحصول على غاز الهيدروجين .
2HI + Heat ⇋ H2 + I2
3NH3 + Heat ⇋ 3H2 + 2N2
3 – طريقة التحليل الكهربائي
تستخدم هذه الطريقة لتحضير غاز الهيدروجين بنقاوة عالية جدا .
أ – التحليل الكهربائي للماء H2O بوجود حمض الهيدروكلوريك المخفف HCl أو الكبريتيك المخفف H2SO4 كإلكتروليتات و استخدام قطب من البلاتين.
4H2O → 2H2 + O2
يجب تجنب كميات كبيرة من حمض الهيدروكلوريك المخفف HCl أو الكبريتيك المخفف H2SO4 لأن غاز الهيدروجين الناتج عند الكاثود يمكن أن يختزل من قبل حمض الهيدروكلوريك HCl إلى غاز الكلور Cl2 أو من قبل حمض الكبريتيك H2SO4 إلى كبريتيد الهيدروجين H2S . لذلك يمكن استخدام هيدروكسييد الصوديوم NaOH أو هيدروكسيد الباريوم Ba(OH)2 بدلا من حمض الهيدروكلوريك المخفف HCl أو الكبريتيك المخفف H2SO4 بدون الخوف من إنتاج اية غازات جانبية.
ب – يمكن استخدام التحليل الكهربائي الصودا الكاوية للتحضير غاز الهيدروجين بكميات تجارية باستخدام محلول كلوريد الصوديوم و الحديد كقطب كاثود و النيكل كقطب أنود .
2NaCl → 2Na+ + 2Cl_
2Na+ + 2H2O → 2NaOH + H2
4 – إعادة تشكيل الهيدروكربونات :
تتفاعل الهيدروكربونات مع البخار بوجود النيكل كعامل حفاز عند درجة حرارة تقريبا 800 درجة سيليزية ن فينتج الهيدروجين. التفاعل التالي يمثل إعادة تشكيل غاز الميثان ، و هذه الطريقة تعتبر الطريقة المثلى لإنتاج غاز الهيدروجين على النطاق الصناعي :
CH4 + H2O → CO + 3H2
5 – التفكك الحراري للهيدروكربونات
يمكن انتاج الهيدروجين كمنتج ثانوي عندما يتم تفكيك الهيدروكربونات الكبيرة حراريا (الألكانات) إلى ألكينات صغيرة .
الخصائص الفيزيائية للهيدروجين :
1 – أخف غاز معروف لحتى الآن ، فهو عديم اللون و الرائحة و الطعم .
2 – لغاز الهيدروجين خاصية الذوبان في الفلزات الصلبة بطريقة تعرف بالإطباق أو الإغلاق . فمثلا يمكن للبالاديوم أو النيكل تذويب غاز الهيدروجين 900 مرة أكبر من حجمها عند الضغط الجوي العادي ، لذلك في الكيمياء العضوية يستخدم النيكل المطحون عند درجة حرارة 300 درجة سيليزية لامتصاص غاز الهيدروجين و بالتالي يعمل النيكل كعامل مختزل .
H2C=CH2 → H3C_CH3
3 –نظائر الهيدروجين
يوجد للهيدروجين ثلاثة نظائر و هي البروتيوم 1H و الديوتيريوم 2H و التريتيوم 3H و يعتبر البرونيوم هو الأكثر انتشارا من بينها ، مع العلم بأن الهيدروجين الطبيعي يحتوي ما يقارب 0.02 % من الديوتيريوم.
إن النظائر الثلاثة السابقة متشابهة من الناحية الكيميائية ألا أنها تختلف بمعدلات تفاعلاتها ، و هذا الاختلاف في معدلات التفاعل يساعد في انتاج الديوتيريوم . فعند التحليل الكهربائي للماء فإن غاز الهيدروجين المنتج يكون غنيا بالبروتيوم 1H ، بينما الماء المتخلف يكون غنيا بالنظير الأثقل و الأبطأ تفاعلا و هو الديوتيريوم 2H .
التريتيوم :
ينتج نظير التريتيوم 3H عند قصف النيتروجين 14N بالأشعة الكونية في طبقات الغلاف الجوي العليا ، أو عند قصف الليثيوم بالنيوترونات في المفاعل النووي:
6Li + n → 3H + 4He
يعتبر ثاني أكسيد الديوتيريوم D2O و ثاني أكسيد التريتيوم T2O مصدرين هامين للديوتيريوم و التريتيوم . يمكن تحضير المركبات الديوتيريومية أو المركبات التريتيومية من خلال التفاعلات المباشرة مثل تفاعل تحضير ديوتروبنزين C6D6 أو كبريتات الديوتيريوم D2SO4 .
3CaC2 + 6D2O → 3DC ≡ CD [+3Ca(OD)2] → C6D6
SO3 + D2O → D2SO4
جميع تلك النظائر متشابهة في عددها الذري و لكنها تختلف في عددها الكتلي . ونسبة وجودها في الطبيعة هي 107 و 103 و 1 .
الخصائص الكيميائية للهيدروجين :
1 – التفاعل مع الفلزات :
يتحد الهيدروجين بشدة مع بعض العناصر الكهرموجبية مثل الصوديوم Na ، البوتاسيوم K ، و الكالسيوم Ca لتكون الهيدريدات .
2Na + H2 → 2NaH
Ca + H2 → CaH2
عند تفاعل تلك الهيدريدات مع الماء H2O فإنه يتشكل الهيدروكسيد و يتصاعد غاز الهيدروجين .
CaH2 + H2O → Ca(OH)2 + H2
كما أنه يمكن للهيدروجين أن يتحد مع الفلزات الأدنى كهروموجبية مثل الزرنيخ As ناتجا عن ذلك هيدريدات غازية .
2As + 3H2 → 2AsH3
عناصر المجموعة العاشرة مثل النيكل Ni ، البالاديوم Pd و البلاتين Pt تعمل على امتصاص الهيدروجين.
2 – التفاعل مع اللافلزات:
2H2 + O2 → 2H2O
H2 + S → H2S
3H2 + N2 ⇋ 2NH3
H2 + F2 ⇋ 2HF
2H2+ C ⇋ CH4
3 – غاز الهيدروجين كعامل مختزلحيث أن الهيدروجين يتفاعل مع الأكسجين بسهولة مكونا الماء ، لذلك يمكن له أن يستعمل كعامل مختزل لإزالة الأكسجين من أكاسيد الفلزات التي هي أقل كهرموجبية من الهيدروجين .
CuO + H2 → Cu + H2O
Cu2+ + 2e_ → Cu
H2 → 2H+ + 2e_
Ag2O + H2 → 2Ag + H2O
Fe3O4 + 4H2 → 3Fe + 4H2O
أكاسيد الفلزات التي كهروموجبيتها عالية مثل Na2O و K2O يصعب جدا اختزالها بواسطة الهيدروجين.
الهيدروجين الوليد
هو الهيدروجين المولد في لحظته و يعتبر أكثر نشاطا كيميائيا من الهيدروجين العادي. فمثلا لا يمكن اختزال كلوريد الحديديك FeCl3 بالهيدروجين العادي ، و لكن إذا ما تمت إضافته إلى خليط من الخارصين و حمض الكبريتيك المركز ، فإن الهيدروجين الوليد الناتج من تفاعل الخارصين مع حمض الكبريتيك سوف يعمل على اختزال FeCl3 بسرعة إلى كلوريد الحديدوز FeCl2 .
FeCl3 + H → FeCl2 + HCl
KClO3 + 6H → KCl + 3H2O
الهيدريدات
تعرف المركبات التي تنتج من اتحاد الهيدروجين مع أي عنصر باسم الهيدريدات. و في الغالب عند اتحاد الهيدروجين مع عناصر القطاع p تتكون الهيدريدات التساهمية و مع القطاع s ( ما عدا البيريليوم و المغنيسيوم) تتكون الهيدريدات الأيونية ، بينما مع الفلزات الإنتقالية و اللانثنيدات تتكون الهيدريدات الفلزية ، حيث مظهرها يكون مشابها للفلزات و موصلة للتيار الكهربائي و لكنها تختلف عن الفلزات في كونها هشة .
الهيدريدات الأيونية
ينتج عن تفاعل أحد فلزات المجموعتين الأولى أو الثانية مع غاز الهيدروجين هيدريدات عديمة اللون تحتوي على أيونات –H . فعندما تكون قيمة الكهرسالبية للفلز أقل من 1.2 فإن الهيدريد الناتج عن اتحاده مع الهيدروجين يكون من نوع الأيوني . و بخلاف الهاليدات الأيونية المستقرة في الماء ، فإن الهيدريدات الأيونية قابلة للذوبان في الماء .
H– + H2O → H2 + OH–
الهيدريدات التساهمية
يمكن للهيدروجين أن يُكوِّن الهيدريدات التساهمية مع بعض العناصر الأخرى ذات الكهرسالبية أقل من 1.5من خلال مشاركة إلكترونها الوحيد معها. و غالبا تكون هيدريدات عناصر القطاع p عوامل مختزلة و البعض منها مثل SiH4 قابلة للاشتعال تلقائيا في الهواء ، بينما الأخرى مثل CH4 تحتاج إلى شرارة لبدء تفاعل الاشتعال. يمكن تحضير الهيدريدات التساهمية بعدة طرق منها :
أ – الإتحاد المباشر
2H2 + O2 → 2H2O
H2 + Cl2 → 2HCl
ب – الاختزال : اختزال الهاليد أو الأكسيد ، و هذه الطريقة تعتبر الأكثر شيوعا لانتاج الهيدريدات التساهمية
SiCl4 + LiAlH4 → SiH4 + LiAlCl4
ج – التميؤ : أي تميؤ الفوسفيدات أو الكربيدات أو البوريدات..إلخ .
Ca3P2 + 6H2O → 2PH3 + 3Ca(OH)2
الهيدريدات الفلزية
يمكن للعديد من العناصر الانتقالية أو الأكتنيدات أو اللانثنيدات أن تمتص الهيدروجين بدرجات متفاوتة مما ينتج عن ذلك الهيدريدات الفلزية و التي تتميز بالعديد من الصفات و الخصائص التي تتميز بها الفلزات مثل الصلابة و توصيل التيار الكهربائي و البريق . كما تتميز أيضا الهيدريدات الفلزية بكونها غير متناسبة (أي وجود نسب غير متناسبة من أيونات الفلز إلى أيونات الهيدروجين) مثل PdH0.6 و VH1.6 ، حيث يوجد الهيدروجين في أطراف شكل رباعي الأوجه في الشبكة البلورية الفلزية المتراصة.
استخدامات الهيدروجين :
1 – تكوين غاز الأمونيا NH3 .
2 – تكوين الميثانول CH3OH .
3 – هدرجة الزيوت باستخدام قطع النيكل للحصول على الدهون .
4 – الدخول في عملية اللحام .
5 – يستخدم في وقود الصواريخ .
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :