بورون
Posted in :
عنصر شبه فلز رمزه الكيميائي B ، هشّ، عدده الذري 5. يقع البـورون في المجموعة الثالثة عشر من الجدول الدوري . فقد عرفت مركّبات البـورون، وخصوصا البوراكس ( البورق ) منذ وقت مبكّر و تحتاجه النباتات بكميات قليلة جدا لعمليات النمو و لكن الكميات الزائدة منه سامه. و البحوث الحديثة أثبتت أيضا بأنه مهم من الناحية الغذائية لصحة العظام في البشر و الحيوانات الفقارية.
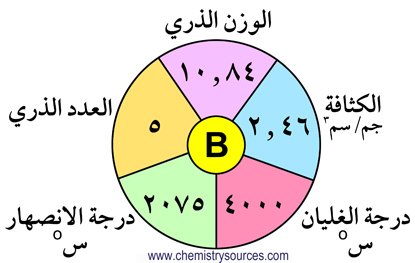
يوجد البـورون بشكلين متآصلين و هما البـورون اللا بلوري. والبـورون البلوري و الذي يمكن تحضيره عن طريق تذويب البـورون اللابلوري في الالومنيوم المصهور والتبريد ببطء. يمكن إزالة الألومنيوم عن طريق تذويبه في حمض الهيدروكلوريك.الوزن الذري للبـورون 10.81 و.ك.ذ؛ درجة انصهار البـورون 2075 درجة سيليزية و درجة الغليان 4000 درجة سيليزية و كثافته 2.46 جرام/سم3 .
البـورون لا يتفاعل مع ماء أو حمض الهيدروكلوريك و لا يتأثر بالهواء عند درجات الحرارة عند تسخينه لدرجة الأحمرار فإنه يتحد مباشرة مع النيتروجين ليكون نيتريد البـورون (BN)، و مع الأكسجين ليكون أكسيد البورون (B2O3). مع الفلزات يكون البـورون ما يعرف باسم البوريدات ، مثل بوريد المغنيسيوم (Mg3B2) و يكون البـورون مع الهيدروجين الهيدريدات أو ما يعرف بالبورانات و هي عبارة عن سوائل أو غازات عديمة اللون تتأكسد بسهوله و تطلق كمية كبيرة من الحرارة و تستعمل في وقود الصواريخ و كمواد حافزة أثناء صناعة المبلمرات و تغطية الفلزات بالبـورون .
المصادر الأساسية لمركّبات البـورون كانت معادن البوراكس وحمض البوريك. من خامات البـورون الأكثر أهمية هي الأوليكسايت NaCaB5O9.8H2O، والكوليمانايت (Ca2B6O11.5H2O)، والكيرنايت (Na2B4O7.4H2O)؛ والبوراسايت (Mg7Cl2B16O30).
ترتيب البـورون هو الثامن و الثلاثون من بين العناصر الموجودة طبيعيا في القشرة الأرضية . على الرغم من أن البـورون تكافؤه 3 وموقعه في الجدول الدوري قد يشير إلى علاقتة الوثيقة بالألومنيوم، إلا انه في الحقيقة يشابه الكربون و السيليكون من ناحية الخواص الكيميائية .
في مركباته يسلك البـورون سلوك اللافلزات و لكنه و على غير أغلب اللافلزات فإن البـورون النقي موصل للتيار الكهربائي مثل الفلزات و مثل (الكربون) الجرافيت. البـورون البلوري مشابه للألماس في الشكل و الخصائص و قساوته تشابه قساوة الألماس .
من بين مركبات البورون التي لها أهميتها من الناحية الصناعية هي البوراكس Na2B4O7.10H2O وحمـض البوريك H3BO3 و كربيد البورون B4C. يدخـل البوراكس في صناعة المنظـفات و الزجاج والسيراميك والمخصّبات والورق و الدهانات . يستعمل حمض البوريك في المجالات الطبـية أما كربيد بـورون مستعمل كمادة حاكّة و يدخل في صناعة بعض السـبائك. للبورون عدة تطبيقات في مجال الطاقـة الذرية نظرا لامتصاصه العالي للنيوترونات .
الخصائص الشاذة للبورون
يمكن تلخيص الخصائص الشاذة للبورون عن باقي عناصر المجموعة بالتالي :
1 – البورون عنصر لا فلزي.
2 – يكون فقط مركبات تساهمية.
3 – يظهر البورون علاقة قطرية مع السيليكون.
4 – لا يستطيع البورون أن يزيح الهيدرووجين من الحموض.
5 – أكسيد البورون B2O3 أكسيد حمضي .
6 – هيدروكسيد البورون B(OH)3 أو H3BO3 حمضي.
7 – يكوِّن البورون هيدريدات تساهمية مستقرة تعرف باسم البورانات .
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :