
تحديد فيتامين (ج) عن طريق معايرة اليود : فيتامين (ج) (حمض الأسكوربيك) هو أحد مضادات الأكسدة و التي تعتبر ضرورية لتغذية الإنسان، و يمكن أن يؤدي نقص فيتامين (ج) إلى مرض يسمى الإسقربوط ، والذي يتميز بوجود خلل في العظام والأسنان. فالعديد من الفواكه والخضروات تحتوي على فيتامين (ج) و لكن الطبخ يدمر الفيتامينات ، لذا فإن ثمار الحمضيات النيئة وعصائرها هي المصدر الرئيس لحمض الأسكوربيك بالنسبة لمعظم الناس.
تحديد فيتامين (ج) من خلال المعايرة اليودية
إن طريقة الوحيدة لتحديد كمية فيتامين (ج) في الغذاء هي استخدام معايرة الأكسدة و الاختزال (الأخسدة). و عادة ما يكون تفاعل الأكسدة والاختزال أفضل من المعايرة الحمض-القاعدة نظرًا لوجود حموضا إضافية في العصير ، لكن القلة منها تتداخل مع أكسدة حمض الأسكوربيك بواسطة اليود.
و اليود غير قابل للذوبان نسبيًا في الماء ، ولكن يمكن تحسن ذلك من خلال تكوين أيون معقد لليود مع يوديد ليشكل ثلاثي اليوديد:
I2 + I– ↔ I3–
يعمل ثالثي اليوديد على أكسدة فيتامين (ج) لتشكيل حمض الاسكوربيك منزوع الهيدروجين
C6H8O6 + I3– + H2O → C6H6O6 + 3I– + 2H+
و لطالما أن فيتامين (ج) موجود في المحلول ، يتم تحويل ثلاثي اليوديد إلى أيون اليوديد بسرعة كبيرة. ومع ذلك ، عندما يتأكسد كل فيتامين (ج) ، سيظهر اليود و ثلاثي اليوديد ، والذي يتفاعل مع النشا لتشكيل معقد أزرق-مسود. فاللون الأزرق المسود هو نقطة نهاية المعايرة.
و تعتبر عملية المعاير هذه مناسبة لاختبار كمية فيتامين (ج) في أقراص فيتامين (ج) والعصائر والفواكه والخضروات الطازجة أو المجمدة أو المعبأة. و يمكن إجراء المعايرة باستخدام محلول اليود فقط وليس محاول اليودات و لكن في المقابل يعتبر محلول اليودات أكثر استقرارًا ويعطي نتيجة أكثر دقة.
خطوات تحديد فيتامين (ج)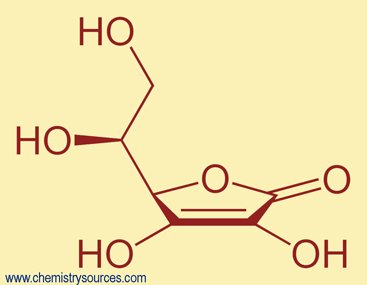
هدف التجربة:
إن الهدف من هذه التجربة هو تحديد كمية فيتامين ج في العينات ، مثل عصير الفاكهة.
الخطوات
الخطوة الأولى هي إعداد المحلول. فما يهم هو أن تعرف تركيز المحلول و الأحجام التي تستخدمها.
تحضير المحاليل:
تحضير دليل النشا تركيز 1%
أضف 0.50 جرام من النشا القابل للذوبان إلى 50 مليلتر من الماء المقطر قريب من درجة الغليان. أخلط جيدا و اسمح للمحلول ليبرد قبل أن تستخدمه . (ليس شرطا أن يكون تركيز دليل النشا 1٪ ؛ فالتركيز 0.5٪ يعتبر مناسبا أيضا ).
محلول اليود
– ذوب 5.00 جرامات من يوديد البوتاسيوم (KI) و 0.268 غرام من يودات البوتاسيوم (KIO3) في 200 مليلتر من الماء المقطر.
– اضف إلى المحلول السابق 30 مل من حمض الكبريتيك تركيز 3 مول/لتر.
– انقل هذا المحلول إلى دورق حجمي سعة 500 مليلتر وقم بتخفيف المحلول بإضافة الماء لحد الوصول إلى العلامة إي إلى الحجم النهائي و الذي يساوي 500 مليلتر .
– أخلط المحلول جيدا .
– انقل المحلول إلى كأس زجاجي سعة 600 مليلتر. و قم بإلصاق ملصق على الكأس كمحلول اليود.
محلول فيتامين (ج) القياسي
– ذوب 0.250 غرام من فيتامين C (حمض الأسكوربيك) في 100 مل ماء مقطر.
– ضع المحلول في دورق حجمي سعة 250 مليلتر و من ثم خفف المحلول بالماء المقطر لحد العلامة ، أي للوصول إلى محلول حجمه 250 مليلتر. و قم بإلصاق ملصق على الدورق كمحلول فيتامين (ج) القياسي.
معايرة المحاليل:
– أضف 25.00 مل من محلول فيتامين (ج) القياسي إلى دورق مخروطي سعة 125 مليلتر.
– إضافة 10 قطرات من محلول النشا 1 ٪.
– قم بغسل السحاحة بكمية صغيرة من محلول اليود ثم قم بملئها بالكامل لحد العلامة. و سجل الحجم الأولي.
– عاير المحلول حتى يتم الوصول إلى نقطة النهاية. و ستكون نقطة النهاية عندما ترى الإشارة الأولى للون الأزرق و التي تستمر بعد 20 ثانية من تقليب المحلول.
– سجل الحجم النهائي لمحلول اليود. فالحجم المطلوب هو الحجم الأولي ناقص الحجم النهائي.
– كرر المعايرة مرتين على الأقل. يجب أن تتوافق النتائج في حدود 0.1 مليلتر.
معايرة فيتامين ج
يمكنك معايرة العينات تمامًا كما فعلت مع المحلول القياسي. قم بتسجيل الحجم الأولي والأخير من محلول اليود المطلوب لإنتاج تغيير اللون عند نقطة النهاية.
معايرة عينات العصير
– أضف 25.00 مل من عينة عصير إلى الدورق المخروطي سعة 125 مليلتر.
– عاير حتى يتم الوصول إلى نقطة النهاية. (أضف محلول اليود حتى تحصل على لون يستمر لفترة أطول من 20 ثانية.)
– كرر المعايرة حتى يكون لديك ثلاثة قياسات على الأقل تتوافق في حدود 0.1 مليلتر.
معايرة الليمون الحقيقي
يعد الليمون الحقيقي رائعا في الاستخدام لأن المصنع عادة ما يدرج نسبة تركيز فيتامين C ، بحيث يمكنك مقارنة القيمة التي حصلت عليها مع القيمة المكتوبة على العبوة. و يمكنك استخدام عصير الليمون أو الليمون المعبأ ، شريطة أن يتم سرد كمية فيتامين C على العبوة. ضع في اعتبارك أن الكمية يمكن أن تتغير (تقل) بمجرد فتح العبوة أو بعد تخزينها لفترة طويلة.
– أضف 10.00 مل من الليمون الحقيقي في دورق مخروطي سعة 125 مليلتر.
– عاير حتى يكون لديك ثلاثة قياسات على الأقل تتوافق مع بعضها البعض ضمن 0.1 مليلتر من محلول اليود.
العينات الأخرى
حبوب فيتامين (ج)
– ذوب القرص في 100 مليلتر الماء المقطر.
– أضف المزيد الماء من المقطر حتى تحصل على محلول حجمه 200 مليلتر من المحلول .
عصير الفواكه الطازج
صفي العصير من خلال ورق ترشيح (أو فلتر القهوة) و تاكد خلو المحلول من البذور و الألياف.
عصير الفواكه المعبأ
قد يتطلب ذلك أيضًا الخلط الجيد و الترشيح.
الفواكه والخضروات :
أخلط عينة حجمها 100 غرام مع حوالي 50 مل من الماء المقطر بالخلاط. رشح الخليط و ثم قم بغسل المرشح (الفلتر) ببضع مليلترات من الماءالمقطر. و أضف المزيد من الماء المقطر للوصول إلى المحلول النهائي في دورق حجمي سعته 100 مليلتر.
عاير جميع تلك العينات بنفس الطريقة التي استخدمتها لمعايرة عينة العصير الموضحة أعلاه.
كيفية حساب فيتامين (ج)
حسابات المعايرة
– حساب الحجم المستهلك من المادة المعايرة و الذي تم استهلاكه لكل قارورة.
خذ القياسات التي حصلت عليها و احسب الحجم المتووسط.
متوسط الحجم = الحجم الكلي / عدد التجارب
– تحديد حجم المادة التي تم معايرتها و الذي كان مطلوبا للمحلول القياسي.
فإذا كنت بحاجة إلى 10.00 مل من محلول اليود للتفاعل مع 0.250 جرام من فيتامين C (القياسي) ، فيمكنك تحديد مقدار فيتامين C في العينة بالجرامات.
فمثلا : إذا كنت بحاجة إلى 6.00 مليلتر لتفاعل عصيرك:
10.00 مل محلول اليود / 0.250 جم من فيتامين (ج) = 6.00 مل من محلول اليود / X مل من فيتامين (ج)
40.00 X = 6.00X = 0.15 g Vitamin C in that sample
ضع في اعتبارك أيضا حجم العينة ، بحيث يمكنك إجراء حسابات أخرى ، مثل غرام لكل لتر. بالنسبة لعينة عصير 25 مل ، على سبيل المثال:
0.15 g / 25 ml = 0.15 g / 0.025 L = 6.00 g/L of vitamin C in that sample
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة