ثنائي الكلوريد ثنائي الكبريت Disulfur Dichloride S2Cl2
Posted in :
ثنائي الكلوريد ثنائي الكبريت Disulfur Dichloride : يعرف أيضا باسم أحادي كلوريد الكبريت Sulfur monochloride وهو سائل برتقالي محمر سام و صيغته الكيميائية S2Cl2 ، وزنه الجزيئي 135.04 ، كثافته 1.678 جرام/سم3 ، درجة انصهاره -80 درجة سيليزية و درجة غليانه 136 درجة 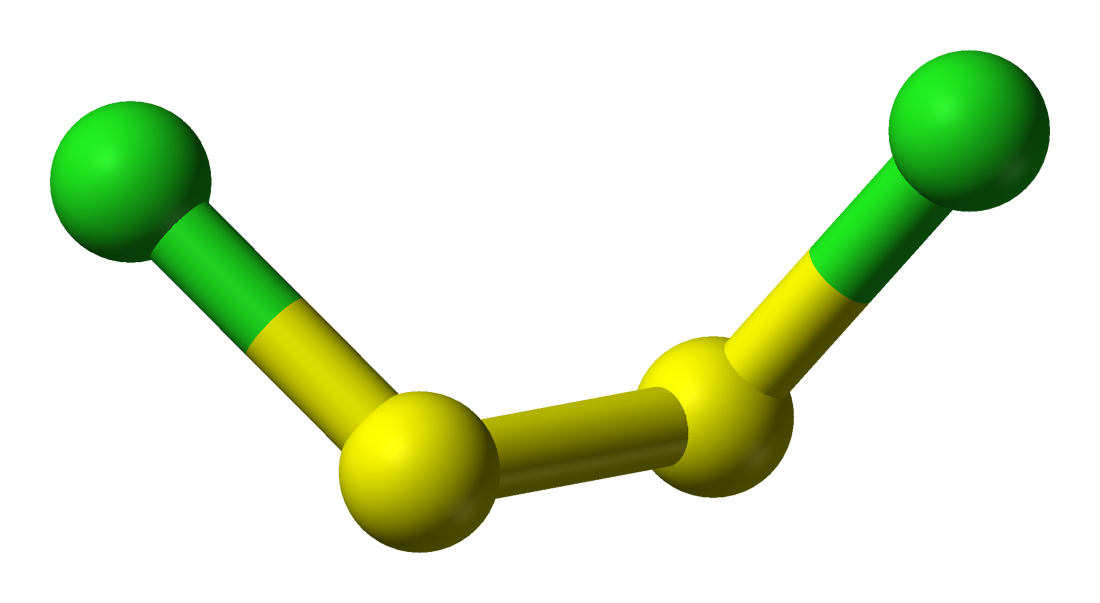
وثنائي كلوريد ثنائي الكبريت النقي هو سائل أصفر يُدخَّن في الهواء بسبب تفاعله مع الماء:
2 S2Cl2 + 2 H2O → SO2 + 4 HCl + 3/8 S8
تحضير ثنائي الكلوريد ثنائي الكبريت
يتم تصنيعه بواسطة الكلورة الجزئية للكبريت الفلزي. و يحدث التفاعل بمعدلات معقولة في درجة حرارة الغرفة. و في المختبر يتم امرارغاز الكلور إلى قارورة تحتوي على الكبريت الفلزي و عند تكوين ثنائي كلوريد ثنائي الكبريت تصبح المحتويات سائل ذات لون اصفر ذهبي :
S8 + 4 Cl2 → 4 S2Cl2 ΔH = −58.2 kJ/mol
ينتج الكلور الزائد ثنائي كلوريد الكبريت الذي يتسبب في أن يصبح لون السائل أقل صفارا وأكثر برتقالية :
S2Cl2 + Cl2 ↔ 2 SCl2 ΔH = −40.6 kJ/mol
و التفاعل قابلاً للانعكاس حيث يقوم SCl2 بإطلاق الكلور للعودة إلى ثنائي كلوريد ثنائي الكبريت. و لثنائي كلوريد ثنائي الكبريت القدرة على إذابة كميات كبيرة من الكبريت ، وهو ما يعكس جزئياً تكوين متعدد السلفانات:
S2Cl2 + n S → S2+nCl2
يتم الحصول على ثنائي كلوريد ثنائي الكبريت النقي عن طريق تقطير السائل الأصفر البرتقالي بوجود زائد من الكبريت.
كما يمكن تحضير ثنائي كلوريد ثنائي الكبريت من كلورة CS2 كما هو الحال في تصنيع الثيوفوسجين.
استخدامات ثنائي الكلوريد ثنائي الكبريت
تم استخدام ثنائي الكلوريد ثنائي الكبريت لإدخال روابط C-S في المركبات الكيميائية في وجود كلوريد الألومنيوم (AlCl3) ،فمثلا يتفاعل ثنائي الكلوريد ثنائي الكبريت مع البنزين لانتاج كبريتيد ثنائي الفينيل:
S2Cl2 + 2 C6H6 → (C6H5)2S + 2 HCl + 1/8 S8
يتفاعل الأنيلين مع ثنائي الكلوريد ثنائي الكبريت في وجود هيدروكسيد الصوديوم من خلال تفاعل يعرف باسم تفاعل هرتز لإنتاج أورثو أمينوفينولات و هذه المركبات تعتبر الاساس لصناعة أصباع الإنديجو المكبرت. كما يستخدم لإعداد غاز الخردل الكبريت عن طريق التفاعل مع الإيثيلين عند درجة حرارة 60 درجة سيليزية (عملية ليفينشتاين):
S2Cl2 + 2 C2H4 → (ClC2H4)2S + 1/8 S8
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :