حمض (حامض) Acid


أي مادة تحرر أيونات الهيدروجين +H عند تفاعلها مع الماء. و الحمض مادة إذا أذيبت في الماء توصل التيار الكهربائي و لها طعم لاذع و تحول لون ورق تـباع الشمس الأزرق إلى أحمر . و هي تتفاعل مع بعض الفلزات لتعطي الهيدروجين و تتفاعل مع القواعد لتعادلها .
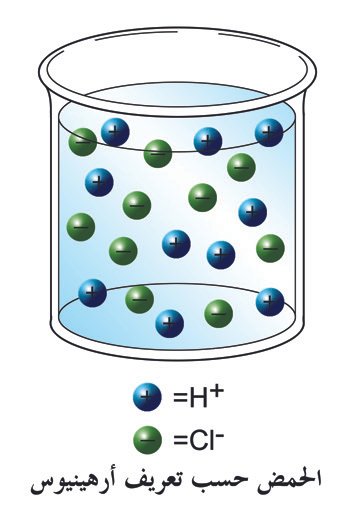
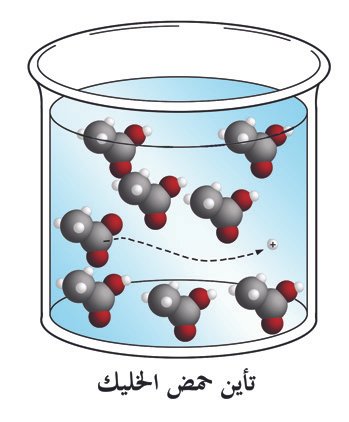
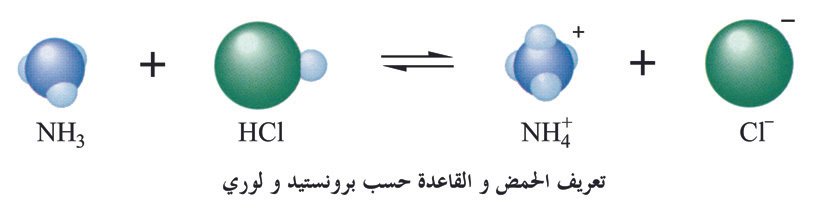
عرف أرهينيوس الحمـض بأنه مركب إذا أذيب في الماء أعطى أيونات الهيدرونيوم (+H3O). و يعرف الحمـض وفقا لتعريف برونستيد و لوري بأنه المادة التي لها القدرة على منح البروتون لـمادة أخرى .
أما لويس فقد عرف الحمـض بأنه كل مادة تستطيع أن تتقبل زوجـا أو أكثر من الإلكترونات .
المحاليل الحمـضية لها رقم هيدروجيني pH أقل من 7 ، و يكون فيها تركيز أيونات الهيدروجين +H عال. من أشهر الحموض التي تتوفر في المختبرات الكيميائية حمض النيتريك HNO3 و حمـض الهيدروكلوريك HCl و حمـض الكبريتيك H2SO4 . جميع تلك الحموض خطرة جدا و كاوية للجلد و الأسطح و يجب التعامل معها بكل حذر.
تتميز الحموض بالخصائص التالية :
1 – تغير لون تباع الشمس الأزرق إلى اللون الأحمر .
2 – عند تفاعلها مع الكربونات ينتج غاز ثاني أكسيد الكربون .
3 – عند تفاعلها مع بعض الفلزات يتصاعد غاز الهيدروجين
4 – عند تفاعلها مع القلويات يحدث تفاعل التعادل.
انظر أيضا قوة الحموض و القواعد .
تعريف أرهينيوس للحموض (للأحماض) : مفهوم أرهينيوس ( أرينيوس) للحموض و القواعد Arrhenius definition of acids and bases
للحصول على الجدول الدوي بدقة عالية و جاهز للطباعة أضغط على الرابط :لوحة الجدول الدوري باللغة العربية بدقة عالية1 Arabic periodic table
لمعلومات أكثر عن الجدول الدوري و العناصر أضغط على الرابط الآتي : خصائص الجدول الدوري و أسماء عناصر الجدول الدوري بالعربي Arabic Periodic Table
تجارب كيميائية سهلة و شيقة و ممتعة (10) Amazing Chemistry Experiments
المصدر :
- الموسوعة العلمية الكيميائية للأستاذ أكرم العلي
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play و من بينها تطبيق ملصقات الجـدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصـر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir