خلية إلكتروليتية Electrolytic Cell : أيّ أداة يتم فيه تحويل الطاقة الكيميائية إلى طاقة كهربائية أو العكس .
مكونات الخلية إلكتروليتية Electrolytic Cell
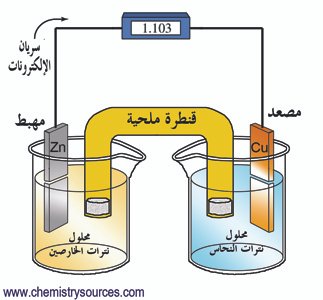
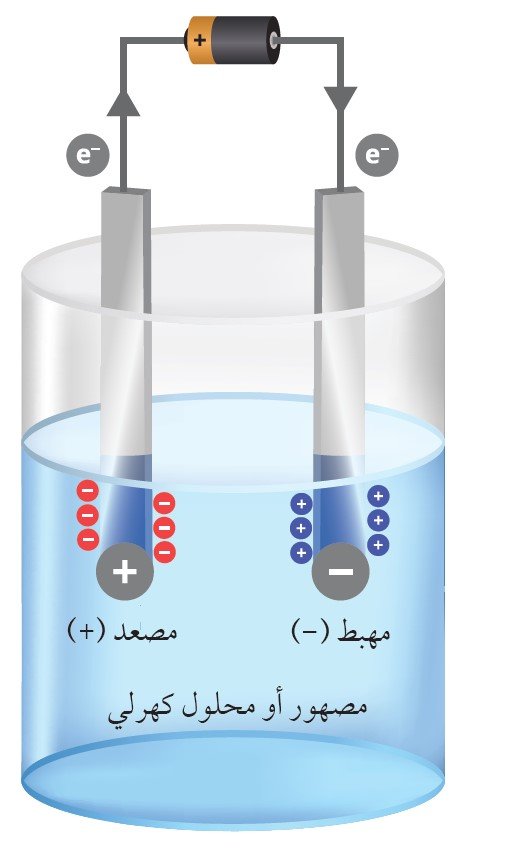
تتكون هذه الخلية من موصلين فلزيين او كهربائيين ( الأقطاب الكهربائية) توضع على بعد مسافة من بعضها البعض و تكون متصلة مع الإلكتروليت و الذي عادة ما يكون مركّب أيوني مذوّب أو مصهور. فتوصيل الأقطاب الكهربائية بمصدر للتيار المياشر يجعل أحدها يشحن بشحنة سالبة و الآخر يشحن بشحنة موجبة . فالأيونات الموجبة في الإلكتروليت تسير نحو قطب الكاثود أي القطب السالب و هناك تتحد مع إلكترون او أكثر مما يفقدها جزء أو جميع شحنتها و بالتالي تصبح أيومات جديدة لديها شحنة أقل أو تصبح ذرات او جزيئات متعادلة ؛ في نفس الوقت تسير الأيونات السالبة إلى القطب الكهربائي الموجب ( الأنود) و تمنح إلكترونا أو اكثر إليه و بالتالي تصبح أيونات جديدة أو جزيئات متعادلة . و نتيجة لانتقال الالكترونات من الايونات السالبة إلى الأيونات الموجبة يحدث تفاعل كيميائي يعرف بتفاعل الاكسدة و الإختزال.
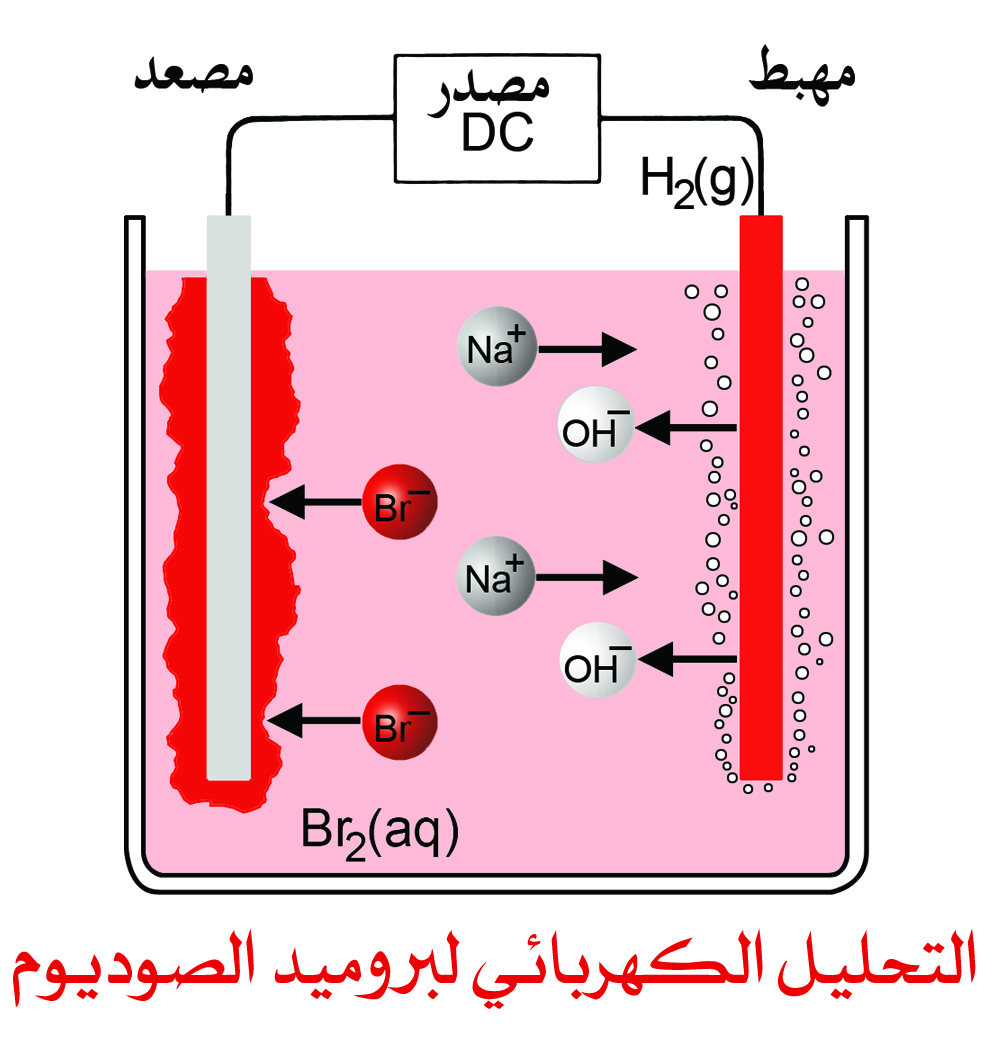
و المثال هنا التحليل الكهربائي لبروميد الصوديوم (ملح الطعام)، حيث يتكون عنصر الصوديوم و البروم؛ فالطاقة اللازمة لاتمام التفاعل يحصل عليها من خلال التيار الكهربائي.
و في حالة المواد التي تولّد الطاقة، بدلا من إستهلاكها، فعندما تتفاعل مع بعضها البعض ، فإن بعض أو كلّ هذه الطاقة يمكن أن تحوّل إلى الكهرباء إذا أمكن للتفاعل أن ينقسم إلى أكسدة و اختزال و التي تحدث عند الاقطاب المنفصلة. فبطارية المركم الرصاص مثلا تتكون من قطب من الرصاص الأسفنجي ( عامل مختزل ) و قطب آخر من ثاني أكسيد الرصاص ( عامل مؤكسد ) و ترتب هذه الأقطاب بصورة متبادلة تفصل بينها صفائح عازلة و تغمر في محلول حمض الكبريتيك المخفف و عندما يعمل المركم الرصاص يحدث تفاعل أكسدة للرصاص فيتكون كبريتات الرصاص و الماء و في نفس الوقت يحدث اختزال لثاني اكسيد الرصاص ليتكون ايضا كبريتات الرصاص و الماء و عند اعادة شحن المركم الرصاص تحدث تفاعل عكسي حيث تحول كبريتات الرصاص إلى رصاص و ثاني أكسيد الرصاص .
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي