مجموعة البورون – عناصر المجموعة الثالثة ( المجموعة 13)
ملاحظة هامة حول مجموعة البورون – عناصر المجموعة الثالثة ( المجموعة 13) : إذا كنت تبحث عن ملف بوربوينت powerpoint فأرجو التوجه إلى المقال الآتي : سلايدات بوربوينت powerpoint كيمياء المجموعة الرئيسة – المجموعة الثالثة (13) – مجموعة البورون
مقدمة
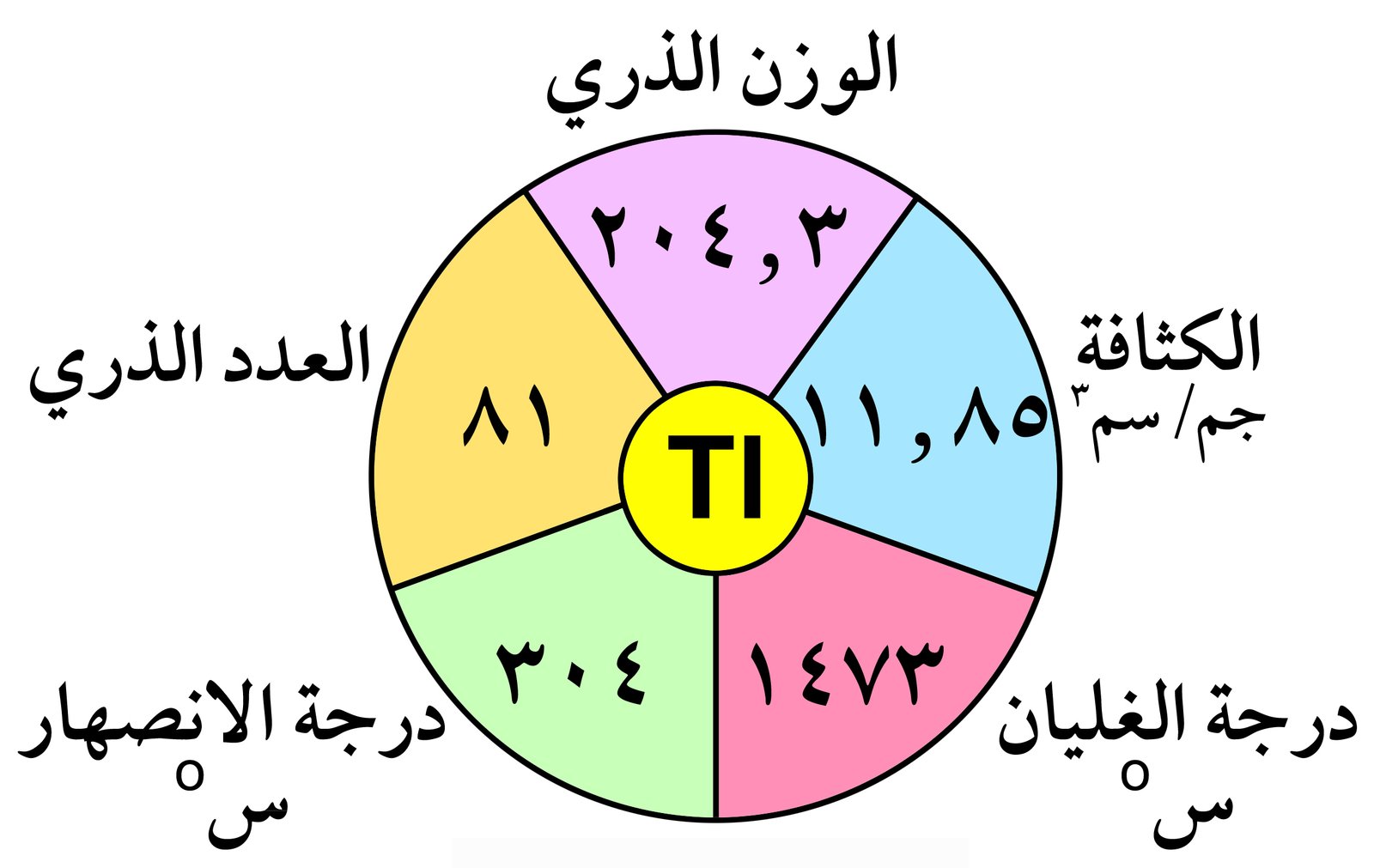
تحتوي المجموعة الثالثة عشر (13) على العناصر التالية : البورون (B) ،الألومنيـوم (Al)، الجاليوم (Ga) ، الإنديوم (In) ، الثاليوم (Tl) . و تتميز هذه 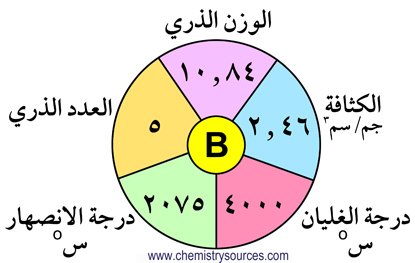
لايوجد البورون حرا في الطبيعة و لكنه يوجد على شكل حمض البوريك . كما يعتبر الألومنيوم من العناصر الأكثر وفره في القشرة الأرضية فهو يحتل المركز الثالث وفرة بعد الأكسجين و السيليكون و هو بذلك يشكل 7.28 % من القشرة الأرضية . يوجد الألومنيوم على شكل أكاسيد أو فلوريد أو سيليكات. أما العناصر الأخرى الجاليوم و الإنديوم و الثاليوم فإنها توجد بكميات 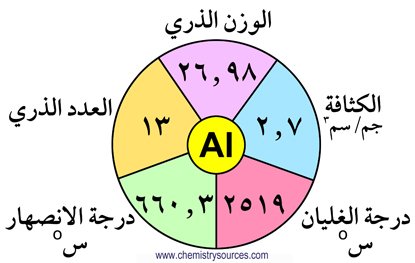
الخصائص العامة
1 – مدارها الأخير يحتوي على ثلاثة إلكترونات .
2 – البورون لا فلز ، بينما الألومنيوم و الجاليوم و الإنديوم فلزات .
3 – طاقات تأينها مرتفعة و لكنها أكبر من تلك للمجموعتين الأولى و الثانية .
4 – الخصائص الفلزية تزداد كلما نزلنا إلى أسفل المجموعة .
5 – أحجامها الذرية صغيرة و لكن شحنتها الذرة عالية . و هنا يلاحظ بأن الحجم الذري للألومنيوم و الجاليوم متشابهة تقريبا بسبب التأثير الضعيف لإلكترونات الفلك d في الجاليوم .
6 – تزداد الكثافة في المجموعة كلما انتقلنا فيها من أعلى لأسفل.
7 – درجة انصهار البورون مرتفعة بسبب تواجده على شكل مبلمر تساهمي في كلا الحالتين الصلبة و السائلة.
8 – يوجد الجاليوم بالحالة السائلة عند درجة حراة 29.7 درجة سيليزية.
9 – أكثر عناصر المجموعة كهرموجبية هو الألومنيوم.
الخصائص الكيميائية
تعتبر عناصر المجموعة الثالثة أقل نشاطا مقارنة بعناصر المجموعتين الأولى والثانية .
1 – التفاعل مع الماء
البورون عنصر خامل لذلك لا يتفاعل مباشرة مع الماء أو الهواء . لكنه يمكن أن يتفاعل إلى حد ما مع الهواء إذا ما تم تسخينه . و لكن يبقى البورون خاملا مع الماء الساخن أيضا.
يتفاعل الألومنيوم مع الماء عند درجات الحرارة العادية . عند تفاعل الألومنيوم مع الماء فإنه يكوِّن طبقة من الأكسيد تحمي الألومنيوم من المزيد من التفاعل .
2Al + 6H2O → 2 Al(OH)3 + 3H2
يتفاعل الثاليوم مع الهواء الجاف مكونا أكسيد الثاليوم ، بينما يتفاعل مع الهواء الرطب مكونا هيدروكسيد الثاليوم.
2 – التفاعل مع الحموض
يتفاعل البورون فقط مع حمض النيتريك مكوِّنا حمض البوريك ، بينما يذوب الألومنيوم و الجاليوم و الإنديوم مكونا أيونات ثلاثية التكافؤ. تفاعل الجاليوم و الألومنيوم مع حمض النيتريك يتباطأ بالتدريج نتيجة تكوُّن طبقة واقية من الأكسيد. أما الثاليوم فإنه يذوب في الحموض ناتجا عن ذلك تكوُّن أيونات أحادية التكافؤ . و لكن تفاعل الثاليوم مع حمض الهيدروكلوريك يصبح أقل فعالية مع مرور الوقت نتيجة تكون كلوريد الثاليوم الذي لا يذوب في الماء .
3 – التفاعل مع القلويات
يذوب البورون فقط في القلويات المصهورة ، و لكن يذوب الألومنيوم والجاليوم في القلويات المصهورة و في المحاليل المائية للقلويات . و في المقابل لا يتأثر الإنديوم بالقلويات .
2B + 6NaOH (fused) → 2Na3BO3 + 3H2
2Al + 2NaOH +2H2O → 2NaAlO3 + 3H2
4- التفاعل مع الهالوجينات و النيتروجين
تتفاعل عناصر المجموعة الثالثة مع الهالوجينات مكونة الهاليدات ، أما التفاعل مع النيتروجين فهو محصور فقط على البورون و الألومنيوم ، فهما يتفاعلان مع النيتروجين و يكوِّنان النيتريدات.
2Al + 3Cl2 → 2AlCl2
5 – البوريدات
عندما يتم تسخين البورون مع أغلب الفلزات ، فإنه تتشكل البوريدات الفلزية، و في هذه النقطة بالذات يلاحظ بأن البورون يظهر تشابها مع الكربون والسيليكون حيث كلاهما يشكلان الكربيدات و السيليدات على التوالي .
ويعتمد التركيب البنائي لهذه البوريدات على نسبة الفلز -إلى-البورون ، وتحتوي على ذرات بورون مفردة أو مزدوجة أو متسلسلة أو صفائحية. فالمركبات التي لها تركيب M2B مثل Fe2B لها ذرات بورون مفردة بينما تلك التي لها نسبة 1:1 مثل FeB لها سلاسل مفردة من ذرات البورون تمر خلال الشبكة البلورية. بينما في المركبات ذات الصيغة MB2 مثل MgB2 و TiB2 فإن لتلك المواد تركيب صفائحي و لكن في المركبات التي لها تركيب صيغته MB6 مثل MgB6 فإن لها تركيب سداسي من ذرات البورون محصورة ضمن مكعب من ذرات الفلز من النوع كلوريد السيزيوم . و أخيرا المركبات من نوع MB12 مثل AlB12 فإن ذرات البورون تشكل بناء هندسي من 12 ذرة بورون.
6 – الهاليدات:
عند دراسة هاليدات عناصر المجموعة الثالثة عشر نلاحظ بأنها تميل إلى تشكيل هاليدات من نوع MX3 ما عدا يوديد الثاليوم ، و هي تعتبر حموض لويس قوية تميل إلى تشكيل متراكبات إضافية من نوع MX3L.
فهاليدات البورون الثلاثية BX3 تتميز بتركيب مثلث مستوي يحتوي على فلك p فارغ عمودي على مستوى الجزيء . و بينما أن جميع ثلاثي هاليدات البورون BX3 مونوميرات ، ألا أن التركيب البنائي للمركبات AlX3 تعتمد على طبيعة الهاليد. فمثلا يلاحظ بأن المركب AlF3 هو مركب صلب مبلمر .
7 – هيدريدات العناصر الأخرى في المجموعة الثالثة عشر
بخلاف البورون ، يعرف القليل من الهيدريدات للعناصر الأخرى. فمثلا يعرف للألومنيوم هيدريد واحد مستقر و هو الألان AlH3)x) . بينما للجاليوم فإنه عند تفاعل H2GaCl]2] مع[Li[GaH4 فإنه يتشكل الجالان GaH3]n]. ويلاحظ من الناحية الكيميائية بأن الجالان يتشابه كيميائيا من البوران أكثر من الآلان لأن الكهرسالبية للجاليوم 1.8 و للألومنيوم 1.5 بينما للبورون 2 .
8 – الأكاسيد
يمكن تحضير الأكاسيد من نوع M2O3 من خلال تسخين الفلز مع الأكسجين. فعند دراسة أكاسيد عناصر المجموعة الثالثة عشر فإنه يلاحظ بأن أكسيد البورون B2O3 حمض ضعيف حيث عند تميؤه يتكون حمض البوريك و هو حمض ضعيف أيضا ، و يمكن لحمض البوريك أن يتفاعل مع الكحولات لتشكل البوراتات:
B(OH)3 + 3MeOH → B(OMe)3 + 3H2O
أما أكسيد الألومنيوم Al2O3 فهو أكسيد متردد و يوجد ضمن شكلين و هما الشكل الألفا ذو درجات الانصهار العالية و الآخر الجاما ذو درجات الانصهار المنخفضة.
أما أكسيد الجاليوم Ga2O3 فهو أكسيد متردد ، بينما أكسيد الإنديوم In2O3 قاعدة ضعيفة و أكسيد الثاليوم Tl2O3 أكسيد قاعدي .
9 – المركبات مع عناصر المجموعتين الخامسة عشر و السادسة عشر
عند تسخين عناصر المجموعة الثالثة عشر مع عنصر الكبريت أو السيلينيوم أو التيلوريوم فإنها تشكل مركبات تعرف باسم الكالجوجينيدات و صيغتها العامة M2E3 حيث M عنصر من المجموعة الثالثة عشر و E عنصر من المجموعة السادسة عشر. أما المركبات مثل InP و GaAs فتعتبر مركبات شبه موصلة هامة و تستخدم في الصناعات الإلكترونية .
المركبات مع النيتروجين
عند تفاعل ثنائي البوران مع الأمونيا فإنه يتكون مركب سائل عديم اللون يعرف باسم البورازين ، صيغته الكيميائية B3H6N3 ، و وزنه الجزيئي 80.50 و درجة انصهاره -58 درجة سيليزية و درجة غلياتنه 161 درجة سيليزية و كثافته 0.81 جرام/سم3.
3B2H6 + 6NH3 → 2B3H6N3 + 12H2
و نتيجة لوجود زوج إلكتروني حر على ذرة النيتروجين فإن المركب يشابه في شكله حلقة البنزين، ومع ذلك فإن المركب لا يتمتع بصفة عطرية. بسبب هذا التشابه اقترح الكيميائي الألماني نيلز فيبرغ تسميتة باسم البنزين اللاعضوي، ولذلك فإن للبورازين اسم آخر هو البورازول .
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :