مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
Posted in :
مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions : ملاحظة هامة: هذا المقال عبارة عن مختصر للفصل السادس من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
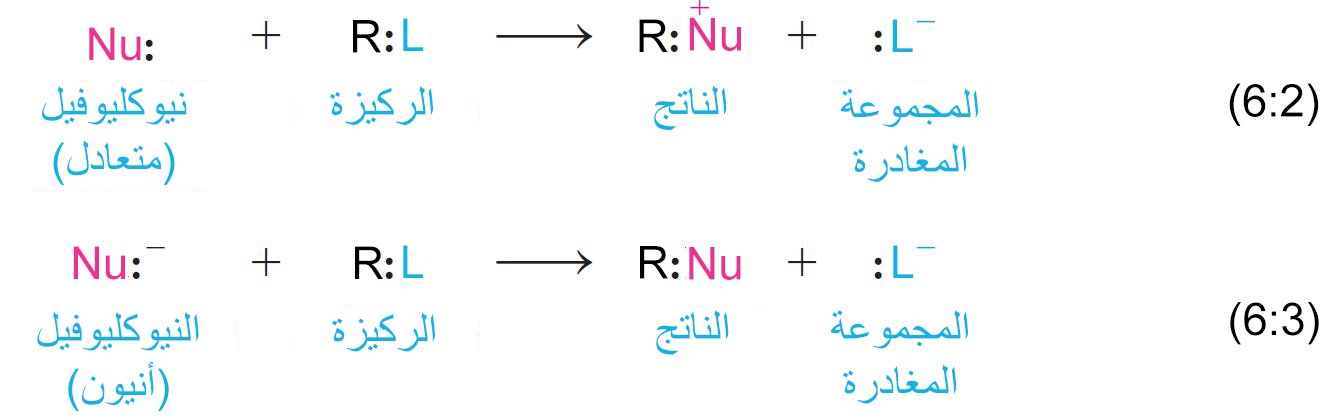
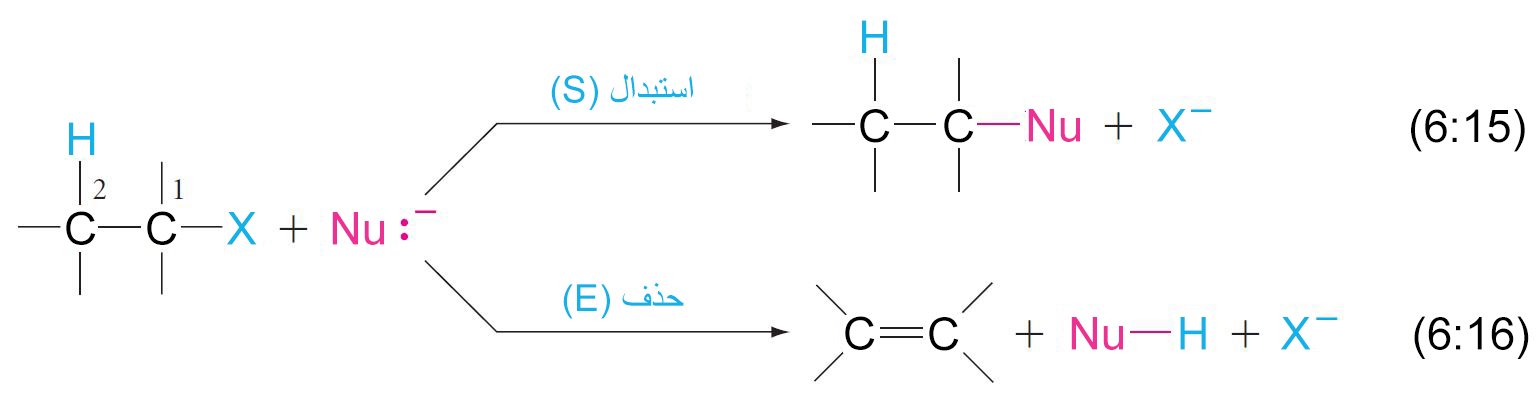
1 – الاستبدال النيوكليوفيلي Nucleophilic Substitution
- تخضع هاليدات الألكيل لتفاعلات الاستبدال النيوكليوفيلي، حيث يزيح النيوكليوفيل مجموعة الهاليد المغادرة من ركيزة هاليد الألكيل.
- إذا كانت النيوكليوفيل والركيزة محايدين (المعادلة 6.2) ، فإن الناتج سوف يكون موجب الشحنة.
- إذا كانت النيوكليوفيل أيون سالب و الركيزة متعادلة (المعادلة 6.3) ، فإن الناتج سيكون متعادلا.
- في كلتا الحالتين ، يقوم زوج إلكترون غير المشترك على النيوكليوفيل بتزويد الإلكترونات للرابطة التساهمية الجديدة.
2 – أمثلة على الاستبدال النيوكليوفيلي Examples of Nucleophilic Substitutions
- يمكن أن تصنف النيوكليوفيلات طبقا لنوع الذرة التي تُشكل الرابطة التساهمية الجديدة. فمثلا أيون الهيدروكسيد في المعادلة 6.1 هو نيوكليوفيل أكسجيني.
- إن أكثر النيوكليوفيلات شيوعا هي الاكسجين و النيتروجين و الكبريت و الهالوجين و الكربون.
- تحدث تفاعلات الاستبدال النيوكليوفيلي في هاليدات الألكيل بحيث يكون الهاليد مرتبطا بذرة الكربون ذات التهجين sp3 ولكن في حالة هاليدات الأريل و هاليدات الفينيل و التي يكون فيها الهاليد مرتبطا بذرة الكربون ذات التهجين sp2 فإنها لا تميل إلى تفاعلات الاستبدال النيوكليوفيلي.
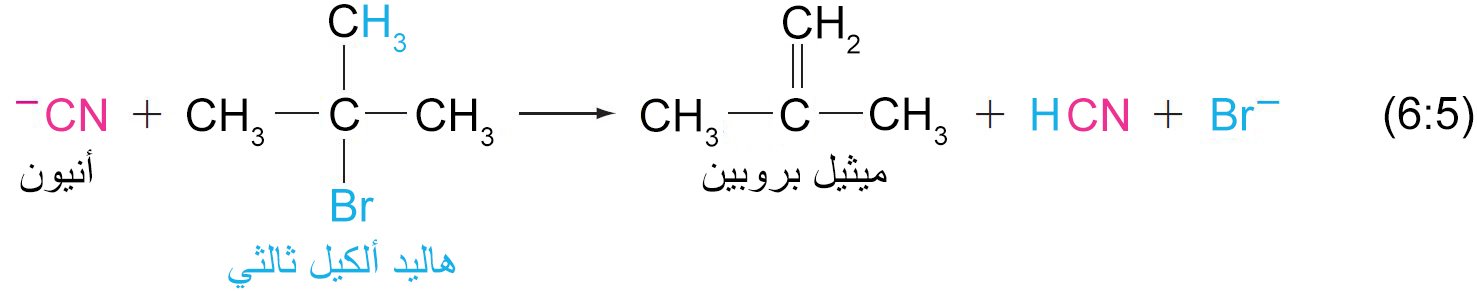
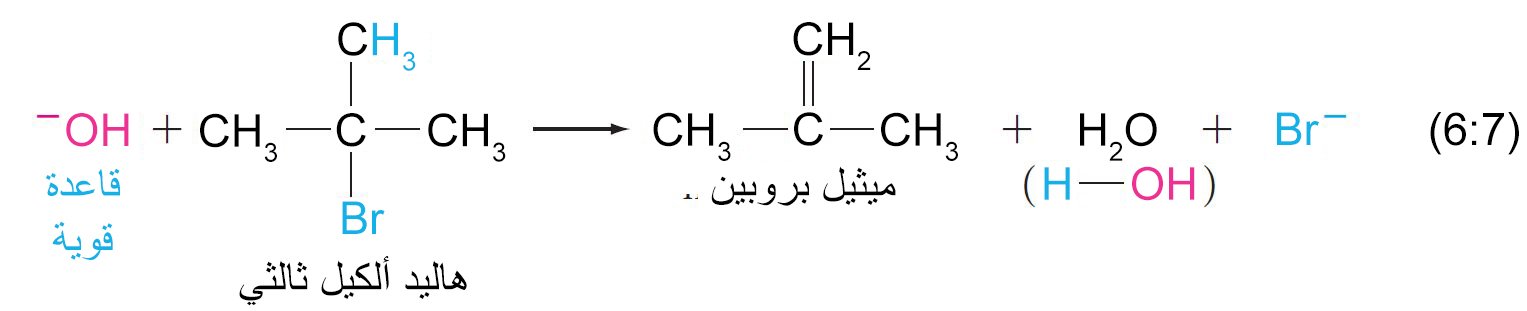
- هناك سلبية أخرى لتفاعلات الاستبدال النيوكليوفيلي عندما يكون النيوكليوفيل أنيون أو قاعدة أو كلاهما ، على سبيل المثال:
3 – ميكانيكيات (آليات) الاستبدال النيوكليوفيلي Nucleophilic Substitutions Mechanisms
- تحدث تفاعلات الاستبدال النيوكليوفيلي بأكثر من آلية.
- تعتمد الآلية التي تم ملاحظتها في حالة معينة على تركيب النيوكليوفيل وهاليد الألكيل والمذيب ودرجة حرارة التفاعل و العوامل أخرى.
- هناك آليتان رئيسيتان للاستبدال النيوكليوفيلي SN2 و SN1. و يقصد بـ SN في كل منهما إلى “الاستبدال النيوكليوفيلي”.
4 – ميكانيكية (آلية) SN2
The SN2 Mechanism
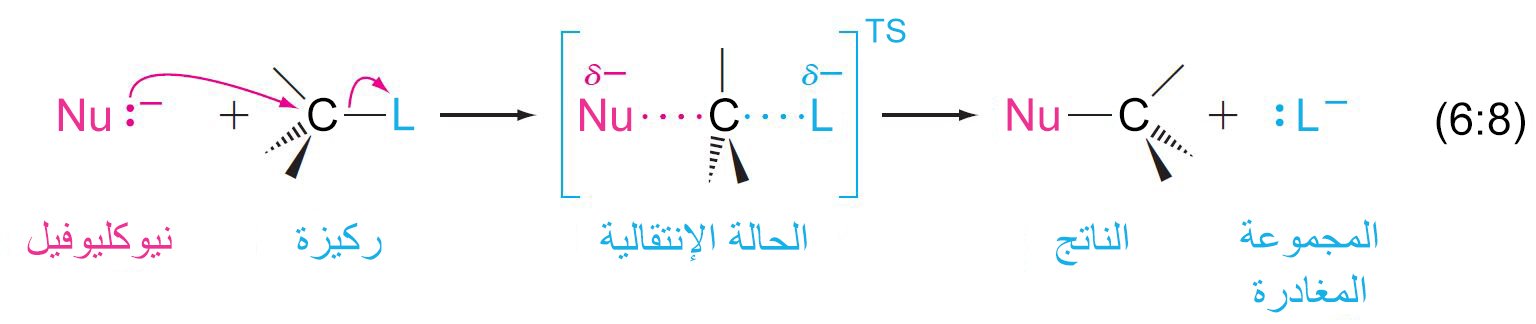
- إن ميكانيكية SN2 هي تفاعل من خطوة واحدة ، بحيث يتم كسر الرابطة الخاصة بالمجموعة المغادرة في نفس الوقت الذي يتم فيه تشكيل رابطة للنيوكليوفيل المضاف.
- أثناء رحيل المجموعة المغادرة بزوج الإلكترونات الخاصة بها ، يعمل النيوكليوفيل على منح زوجا من الإلكترونات إلى ذرة الكربون.
- يقصد بالرقم 2 لوصف الميكانيكية أن هذا التفاعل ثنائي الجزيئ، أي أن هناك جزيئان يدخلان في مكانيكة التفاعل ذو الخطوة الوحيدة.
- علامات على حدوث ميكانيكية SN2 :
- أ – معدل التفاعل يعتمد على تراكيز كل من النيوكليوفيل و الركيزة.
- ب – كل ميكيانيكية SN2 يصاحبها عكس في التشكيل.
-
- ج – يصبح التفاعل سريعا إذا كانت الركيزة مجموعة ميثيل أو أولية و تصبح أبطأ إذا كانت ثلاثية. أما ألكيلات الهاليد الثانوية فمعدل سرعة التفاعل تكون ما بين و بين.
- الخلاصة: تحدث ميكانيكة التفاعل من نوع SN2 في خطوة واحدة و تكون مفضلة لهاليدات الميثيل و الهاليدات الأولية، و تحدث ببطء في الهاليدات الثانوية و عادة لا تحدث في الهاليدات الثلاثية. يصاحب ميكانيكية SN2 انقلاب في تشكيل الجزيء ، و يعتمد معدل سرعة التفاعل على تركيز كل من النيوكليوفيل و الركيزة (هاليد الألكيل).
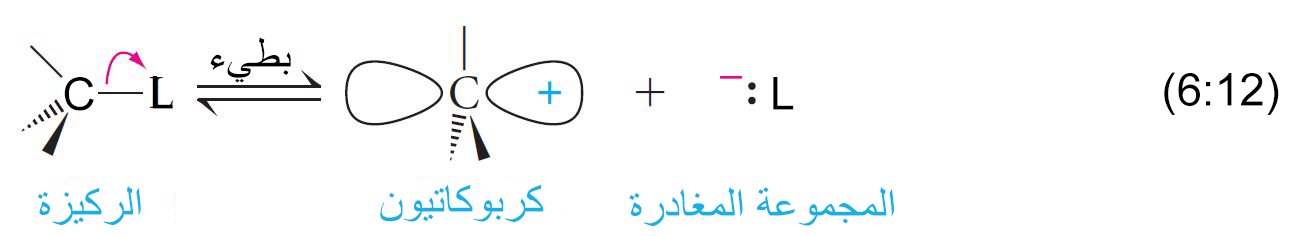
5 – ميكانيكية (آلية) SN1
The SN1 Mechanism
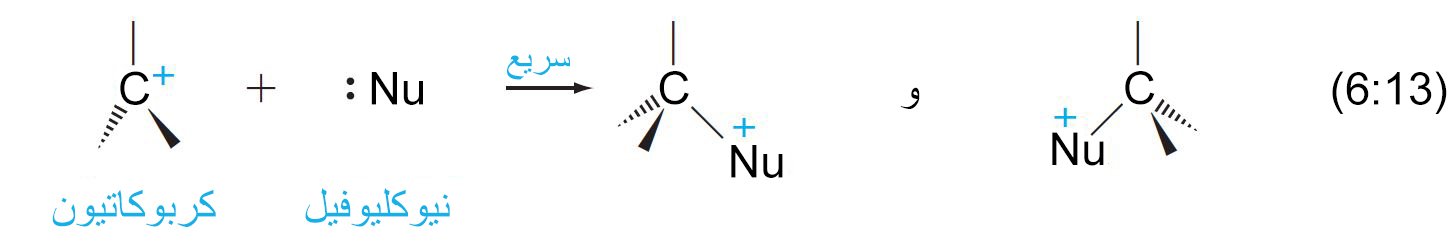
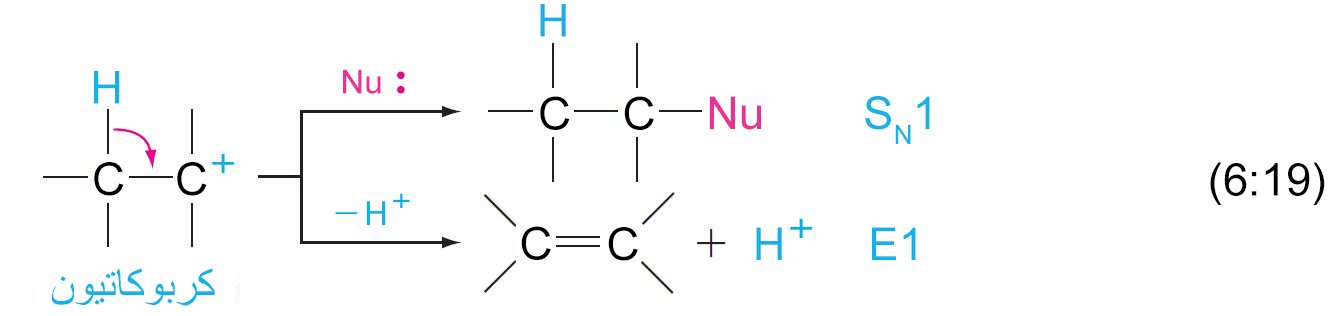
- تتكون ميكانيكية التفاعل من نوع SN1 من خطوتين. ففي الخطوة الأولى و التي هي بطيئة تنكسر الرابطة بين الكربون و المجموعة المغادرة، و يتكون الكربوكاتيون.
- في الخطوة الثانية و التي هي سريعة يتحد الكربوكاتيون مع النيوكليوفيل لتكوين الناتج.
- يقصد بالرقم 1 لوصف الميكانيكية لأن التفاعل بطيئا أو لأن الخطوة المحددة لسرعة التفاعل تعتمد على متفاعل واحد ألا وهو الركيزة.
- علامات على حدوث ميكانيكية SN1 :
- أ – معدل سرعة التفاعل لا يعتمد على تركيز النيوكليوفيل.
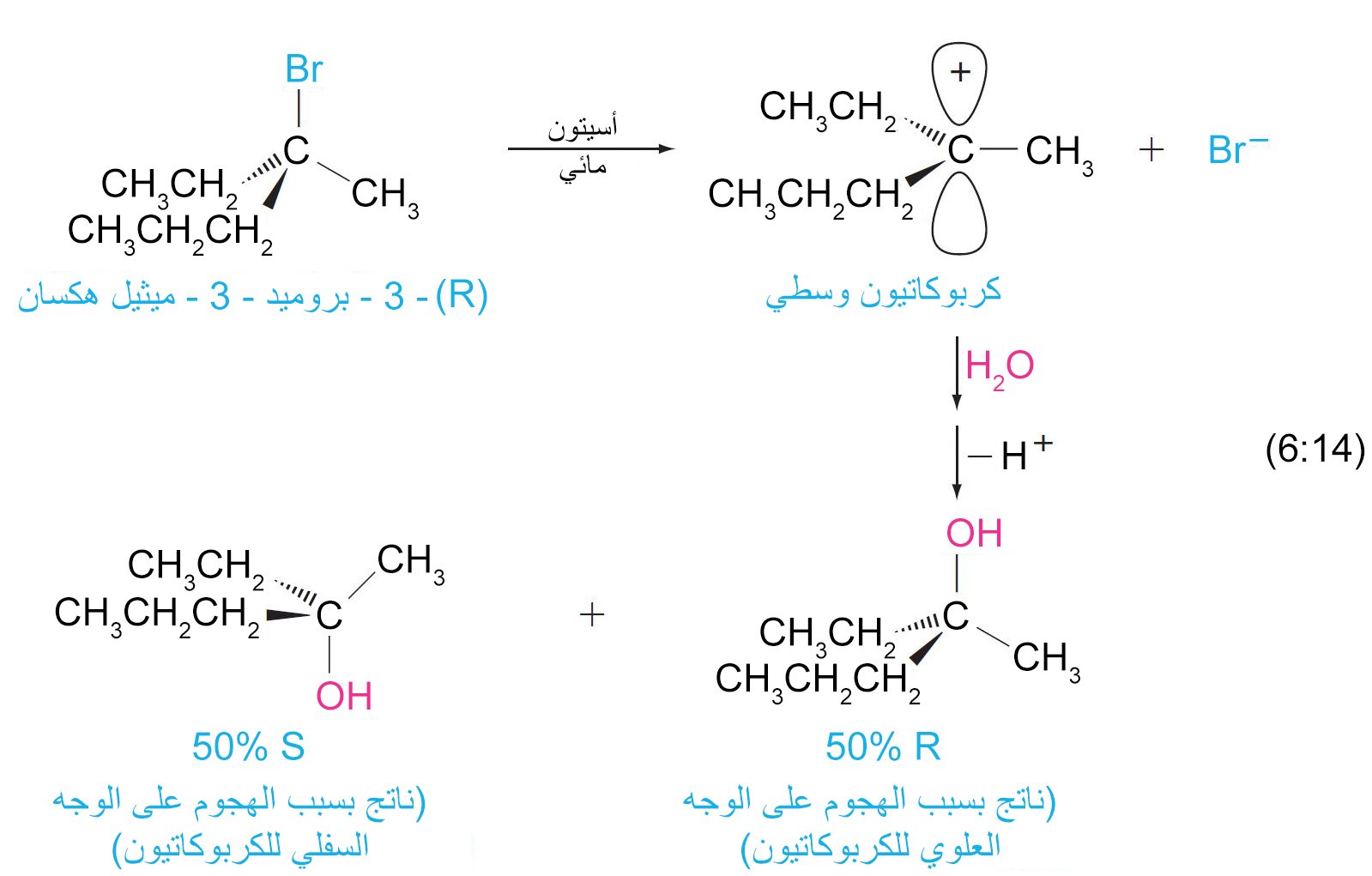
- ب – تحدث ميكيانيكية SN1 مع فقدان للفعالية البصرية أي مع حدوث مراسمة.
-
- ج – يصبح التفاعل سريعا إذا كانت الركيزة مجموعة ألكيل ثلاثية ، و يصبح التفاعل بطيئا إذا كانت مجموعة الألكيل أولية.
- الخلاصة: تحدث ميكانيكة التفاعل من نوع SN1 في خطوتين واحدة و تكون مفضلة للهاليدات الثلاثية. يصاحب ميكانيكية SN1 مراسمة و معدل التفاعل لا يعتمد على تركيز النيوكليوفيل.
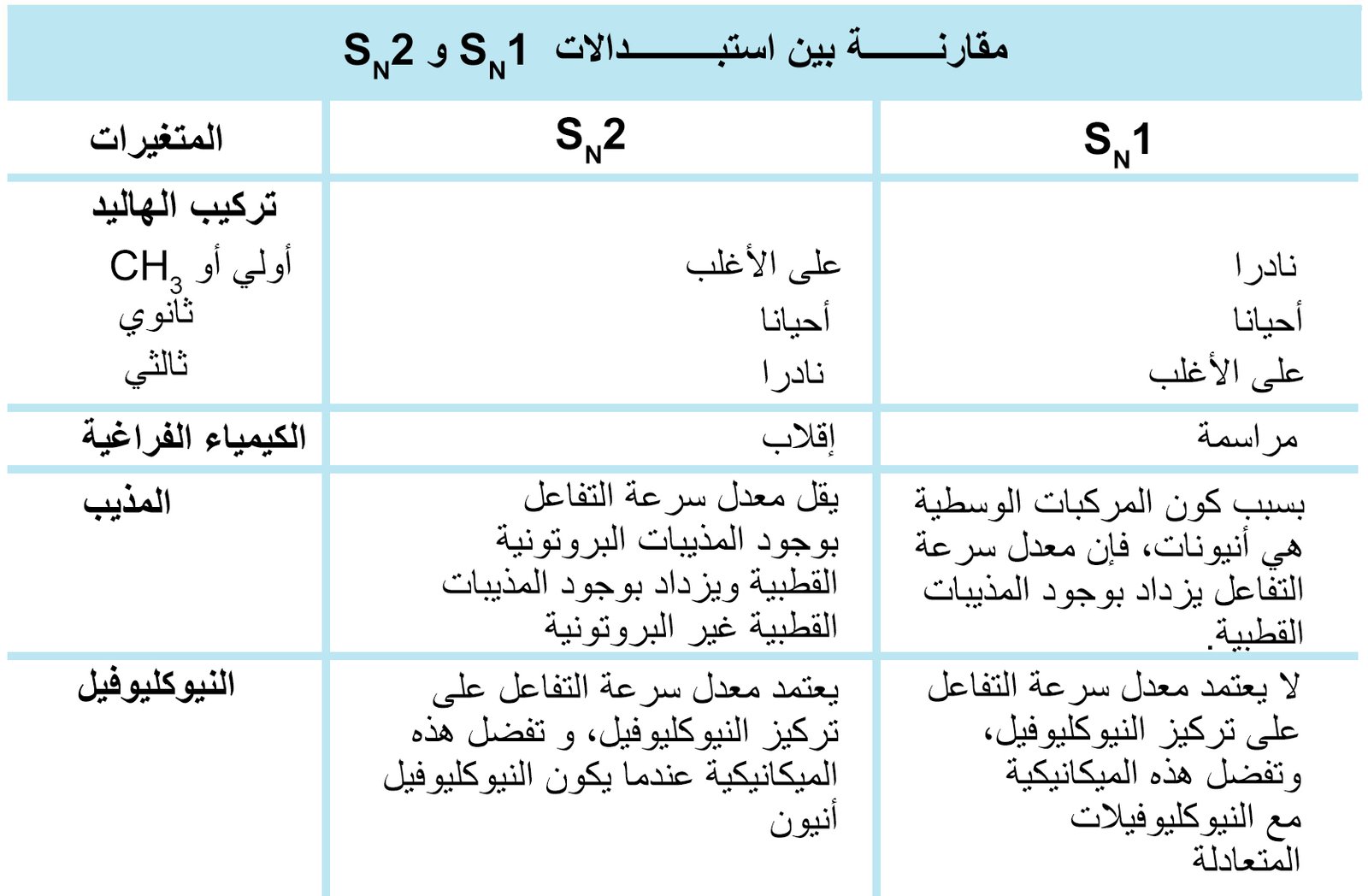
6 – مقارنة بين ميكانيكية (آلية) SN1 و SN2
The SN1 and SN2 Mechanism Compared
- يمكن أن تساعد المذيبات القطبية البروتونية على التحكم في ميكانيكية التفاعل.
- المذيبات القطبية البروتونية هي مذيبات مانحة للبروتونات مثل الماء و الكحولات.
- يُعزز معدل تفاعل ميكانيكية SN1 بوجود المذيبات القطبية البروتونية.
- أما المذيبات القطبية اللابروتونية (مثل: الأسيتون و ثنائي ميثيل السلفوكسايد أو ثنائي ميثيل الفورمامايد) فإنها تعزز من ميكانيكية التفاعلات من نوع SN2 .
- إذا كان النيوكليوفيل قويا فإن ميكانيكية التفاعل المفضلة هي من نوع SN2.
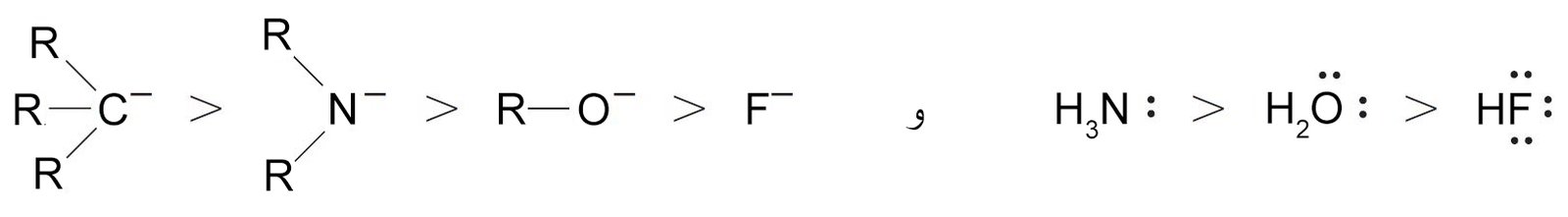
- الأيونات السالبة تكون أكثر نيوكليوفية مقارنة مع الجزيئات المتعادلة المقابلة لها ، لذلك:
- العناصر التي توجد أسفل المجموعة الواحدة في الجدول الدوري تكون أكثر نيوكليوفيلية من تلك العناصر التي تعلوها ضمن نفس المجموعة.
- ضمن الدورة الواحدة، فإن العناصر ذات الكهروسالبية العالية تميل لأن تكون أقل نيوكليوفيلية، لذلك:
7 – إزالة هاليد الهيدروجين، تفاعل الإزالة، ميكانيكية E2 و E1 .
Dehydrohalogenation, an Elimination Reaction; the E2 and E1 Mechanisms
- في تفاعلات الإزالة (إزالة هاليد الهيدروجين) في هاليدات الألكيل، فإن ذرة الهيدروجين على ذرة الكربون و ذرة الهالوجين التي على ذرة الكربون المجاورة لها يتم إزالتهما و يتكون رابطة ثنائية بين ذرتي الكربون.
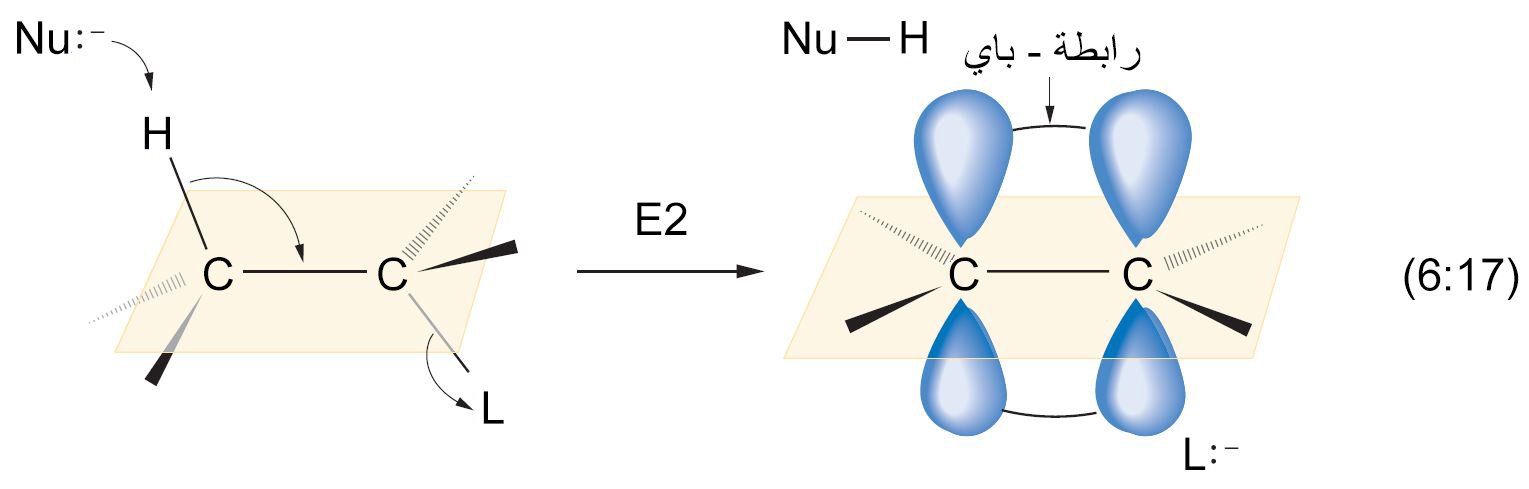
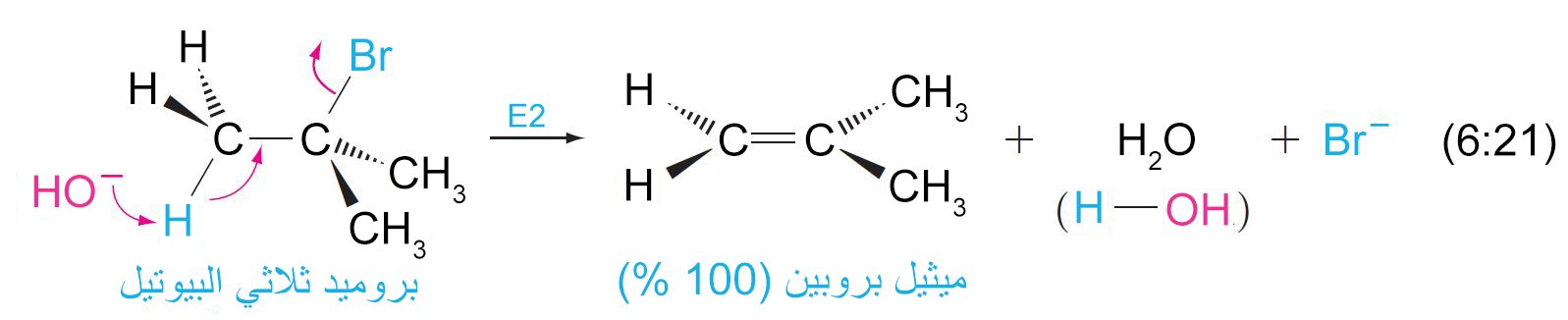
- هناك ميكانيكيتان (آليتان) لتفاعلات الإزالة و هما E2 و E1 .
- إن ميكانيكية E2 مكونة من خوة واحدة بحيث تتم إزالة HX و تكوين الرابطة الثنائية C=C في نفس الخطوة.
- تتكون ميكانيكية E1 من خطوتين، بحيث تكون الخطوة الأولى مشابهة تماما لتفاعل SN1 .
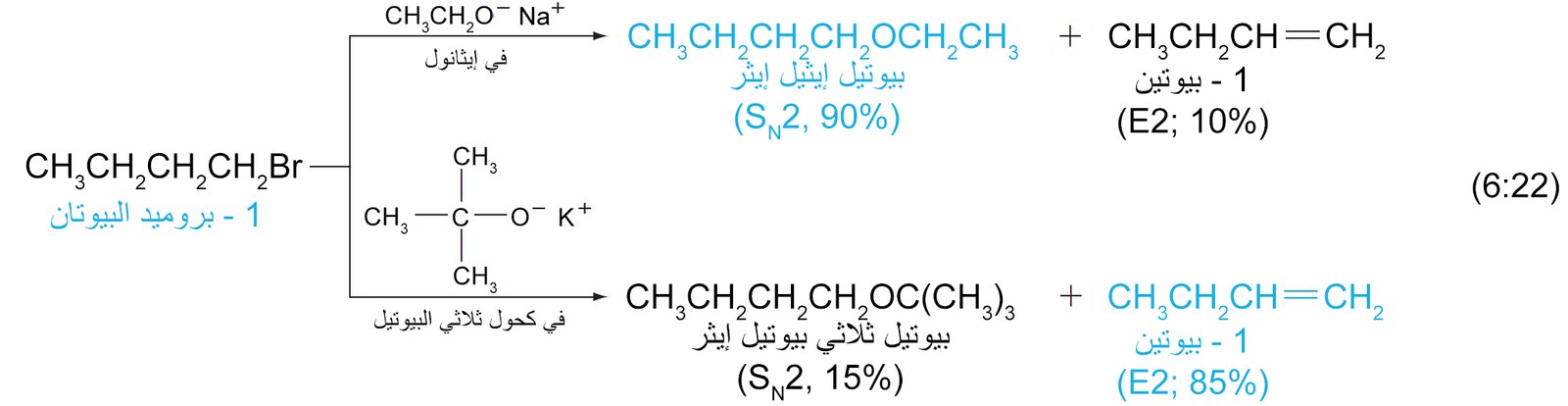
8 – التنافس بين الاستبدال و الإزالة Substitution and Elimination in Competition
8. أ الهاليدات الثلاثية Tertiary Halides
- في حالة الهاليدات الثلاثية، فإن الميكانيكية المتاحة للاستبدال هي من نوع SN1 ، بينما ميكانيكة الإزاحة المتاحة هي أما E1 أو E2 .
- فإذا استخدمنا نيوكليوفيل قوي و مذيب قطبي ضعيف فإن الميكانيكية المفضلة تكون من نوع E2 .
8. ب الهاليدات الأولية Primary Halides
- في حالة الهاليدات الأولية، فإن الميكانيكية المتاحة هي فقط من نوع SN2 و E2 .
- مع أغلب النيوكليوفيلات فإن الهاليدات الاولية تعطي نواتج استبدال بميكانيكية SN2 .
8. ج الهاليدات الثانوية
- في حالة الهاليدات الثانية، فإن الميكانيكيات الأربعة SN2 و E2 بالإضافة إلى SN1 و E1 تكون متاحة
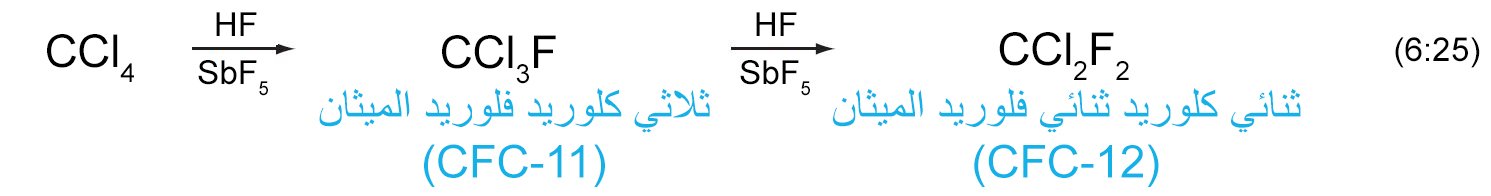
9 – المركبات الأليفاتية متعددة الهالوجينات Polyhalogenated Aliphatic Compounds
- يتم إنتاج الميثانات المكلور بواسطة كلورة الميثان ، على سبيل المثال رباعي كلوريد الكربون (CCl4) ، الكلوروفورم (CHCl3) ، وكلوريد الميثيلين (CH2Cl2) وجميعها غير قابلة للذوبان في الماء، ولكنها مذيبات فعالة للمركبات العضوية.
- تستخدم ثلاثي كلوريد الإيثيلين و رباعي كلوريد الإيثيلين في التنظيف الجاف وكعوامل إزالة الشحوم في تصنيع المعادن والنسيج.
- رباعي فلوريد الإيثيلين هي المادة الخام لـلتيفلون، وهو بوليمر مرتبط بمتعدد الإيثيلين ولكن تم فيه استبدال جميع ذرات الهيدروجين بذرات الفلور.
- إن الكلوروفلوروكربونات (المعروفة أيضا باسم الفريونات CFC’s) هي مثال على المركبات متعدد الهالوجينات و التي تحتوي على الفلور و الكلور. أما إذا احتوى هذا النوع من المركبات على البروم (بدلا من الكلور)فإنه في هذه الحالة سوف يطلق عليها اسم الهالونات.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
2 thoughts on “مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions”
Leave a Reply Cancel reply
This site uses Akismet to reduce spam. Learn how your comment data is processed.





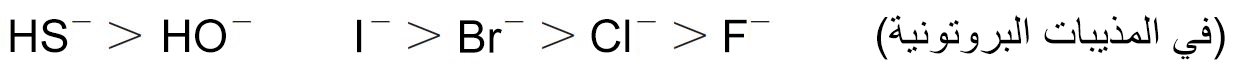





السلام عليكم
ممكن مصدر هذا الموضع بصيغة الوورد او pdf
أرجو إرسال بريدكم الإلكتروني
هذا الفصل من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart