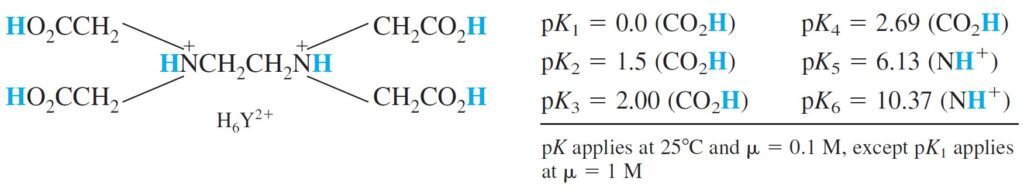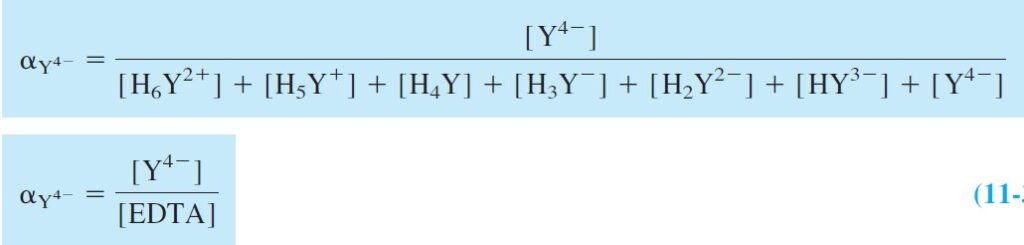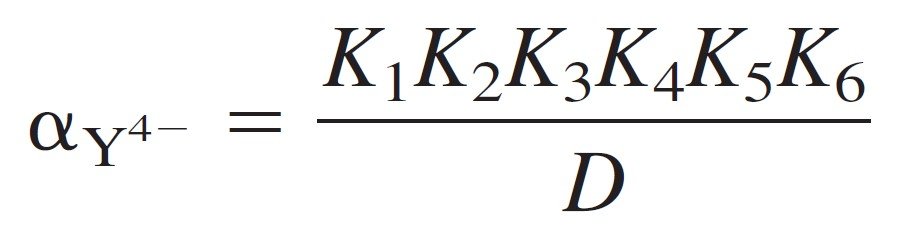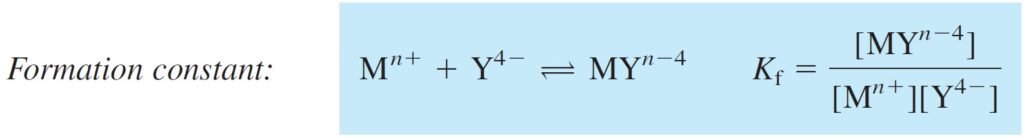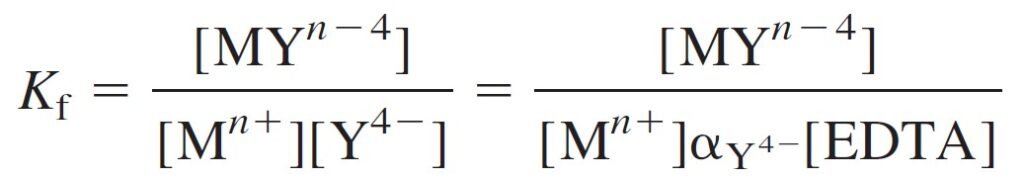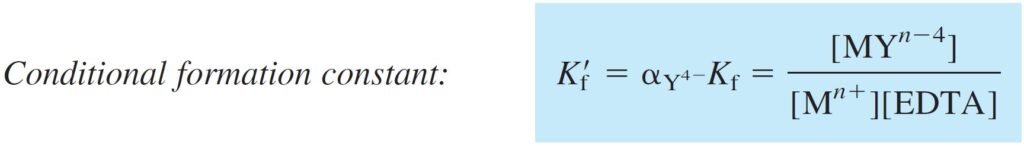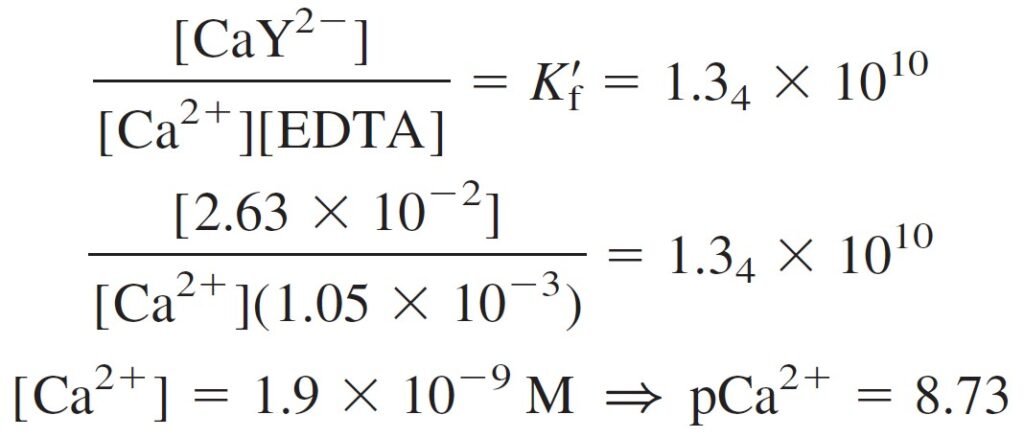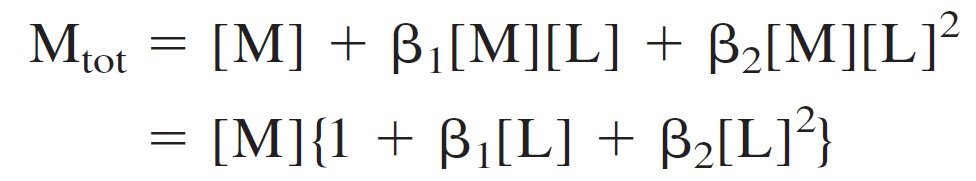معايرات إيثيلين ثنائي الأمين رباعي حمض الخليك EDTA
EDTA Titration
( Sections 11.1-11.3 &11.5-11.6 , Quantitative Chemical Analysis by Daniel C. Harris, 8th Edition )
( التحليل الكيميائي النوعي – دانيال هاريس )
EDTA is abbreviation for ethylenediaminetetraacetic acid, a compound that forms strong complexes with most metal ions and finds wide use in quantitative analysis.
الـ EDTA هو اختصار لمادة إيثيلين ثنائي الأمين رباعي حمض الخليك و هي مادة يمكن لها أن تشكل المعقدات مع أغلب أيونات الفلزات و التي لها تطبيقاتها الهامة قي التحليل الكمي .
EDTA plays a larger role as a strong metal-binding agent in industrial processes and in products such as detergents, cleaning agents, and food additives that prevent metal-catalyzed oxidation of food.
يلعب الـ EDTA دورًا هاما كعامل ربط قوي بالفلزات في العمليات الصناعية وفي صناعة المنتجات مثل المنظفات وعوامل التنظيف والمضافات الغذائية التي تمنع أكسدة الطعام المحفز بالفلزات.
11 – 1 معقدات الفلز- الكُلّاب
11 – 1 Metal-Chelate Complexes
Metal ions are Lewis acids, accepting electron pairs from electron-donating ligands that are Lewis bases.
أيونات الفلزات هي حموض لويس بحيث يمكنها استقبال زوجا من الإلكترونات من اللواقط أو الربيطات المانحة للإلكترونات و التي تُعدّ قواعد لويس .
Cyanide (CN–) for example is a monodentate ligand because it binds to a metal ion through only one atom (the carbon atom).
يُعدّ السيانيد (CN-) مثلا أحادي الربيطة أو لاقط أحادي لأنه يرتبط بأيون فلزي عن طريق ذرة واحدة فقط (ذرة الكربون).
A ligand that attaches to a metal ion through more than one ligand atom is said to be multidentate (“many toothed”), or a chelating ligand.
أما اللواقط او الربيطات التي ترتبط مع أيون الفلز عن طريق أكثر من ذرة رابطة واحدة تعرف بأنها متعددة الكلاليب (متعددة السن) أو ربيطة كلابية متعددة السن.
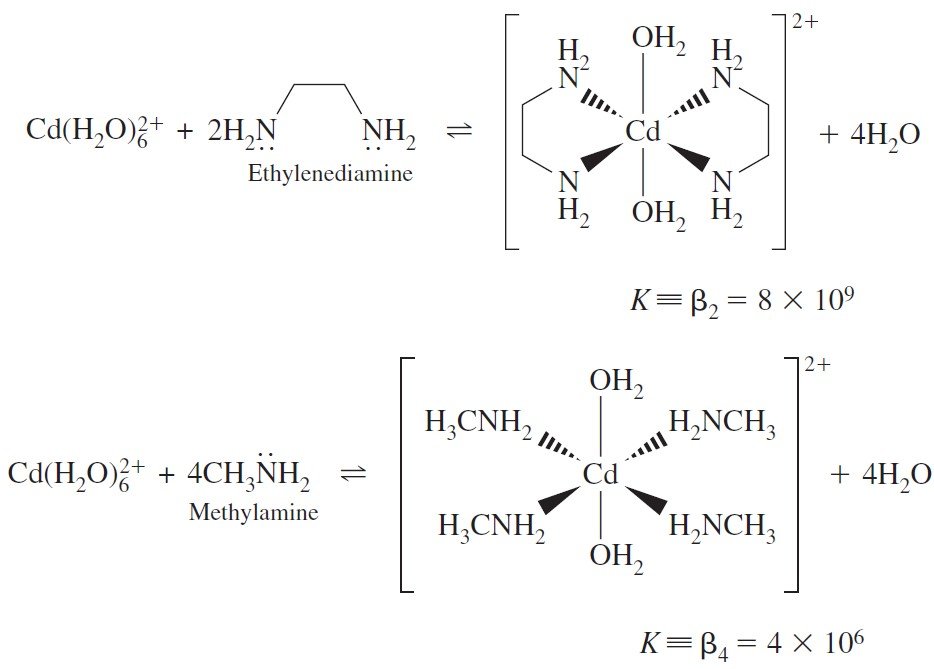
Ethylenediamine is a bidentate because it binds to the metal through two ligand atoms.
إن إيثيلين ثنائي الأمين يعد ثنائي السن أو ثنائي الكُلّاب لأنه يرتبط مع أيون الفلز عن طريق ذرتين رابطتين .
The chelate effect is the ability of multidentate ligands to form more stable metal complexes than those formed by similar monodentate ligands.
التأثير الكلابي هو قدرة الربيطات أو اللواقط عديدة السن لتكوين معقدات فلزية أكثر استقرارا من تلك المشابه لها و التي تتكون بوجود ربيطة أو لاقطة واحدة .
from the above figure we noticed that 2 ethylenediamine molecules binds tighter than 4 methylamine molecules. For multidentate ligand K value is larger (Chelate increase the stability of complex.)
من الشكل أعلاه نلاحظ أن جزيئين من إيثيلين ثنائي الأمين (ثنائي السن) أكثر ارتباطا من أربعة جزيئات ميثيل أمين (أحادي السن) . كما أن قيمة K للرابيطة متعدد السن تكون أعلى (تعمل الروابط الكلابية على زيادة استقرارية المعقد) .
An important tetradentate ligand is adenosine triphosphate (ATP), which binds to divalent metal ions (such as Mg2+, Mn2+, Co2+, and Ni2+) through four of their six coordination positions.
واحد من الربيطات أو اللواقط رباعية السن الهامة هو ثلاثي فوسفات الأدينوسين (ATP) ، والذي يرتبط بأيونات الفلزات ثنائية التكافؤ (مثل +Mg2 + و +Mn2 + و +Co2 و +Ni2) من خلال أربعةٍ من أوضاع التنسيق الستة الخاصة بها.
A titration based on complex formation is called a complexometric titration.
المعايرات التي تعتمد على تكوين معقد تعرف باسم معايرات تكوين المعقدات .
11 – 2 EDTA
EDTA is the most widely used chelator in analytical chemistry.
يُعد الـ EDTA الكُلّاب الاكثر استخداما في الكيمياء التحليلية.
Acid-Base Properties الخصائص الحمضية-القاعدية
EDTA is a hexaprotic system, designated H6Y2+. The “blue” acidic hydrogen atoms are the ones that are lost upon metal-complex formation. The neutral acid of EDTA is tetraprotic, with the formula H4Y.
إن الـ EDTA نظام يحوي ستة بروتونات ، و يرمز للـ EDTA بالرمز +H6Y2 ، و الشكل أدناه يُبيّن البروتونات الستة باللون الازرق التي يمكن للـ EDTA أن يمنحها عندما يشكل مع أيون الفلز المركب المعقد. أما الشكل المتعادل من EDTA فهو رباعي البروتون و صيغته العامة H4Y .
H4Y can be dried at 140 C for 2 h and used as a primary standard. It can be dissolved by adding NaOH solution from a plastic container. NaOH solution from a glass bottle should not be used because it contains alkaline earth metals leached from the glass. Reagent-grade Na2H2Y . 2H2O is used in EDTA titrations.
يمكن تجفيف H4Y عند 140 درجة سيليزية لمدة ساعتين واستخدامه طكادة قياسية أساسية. و يمكن إذابة H4Y بإضافة محلول هيدروكسيد الصوديوم محفوظ في عبوة بلاستيكية. فلا ينبغي استخدام محلول هيدروكسيد الصوديوم محفوظ في عبوة زجاجية لأنه في هذه الحالة سيحتوي على فلزات أرضية قلوية تم تسريبها من الزجاج. فالكاشف المستخدم لمعايرات EDTA هو Na2H2Y.2H2O.
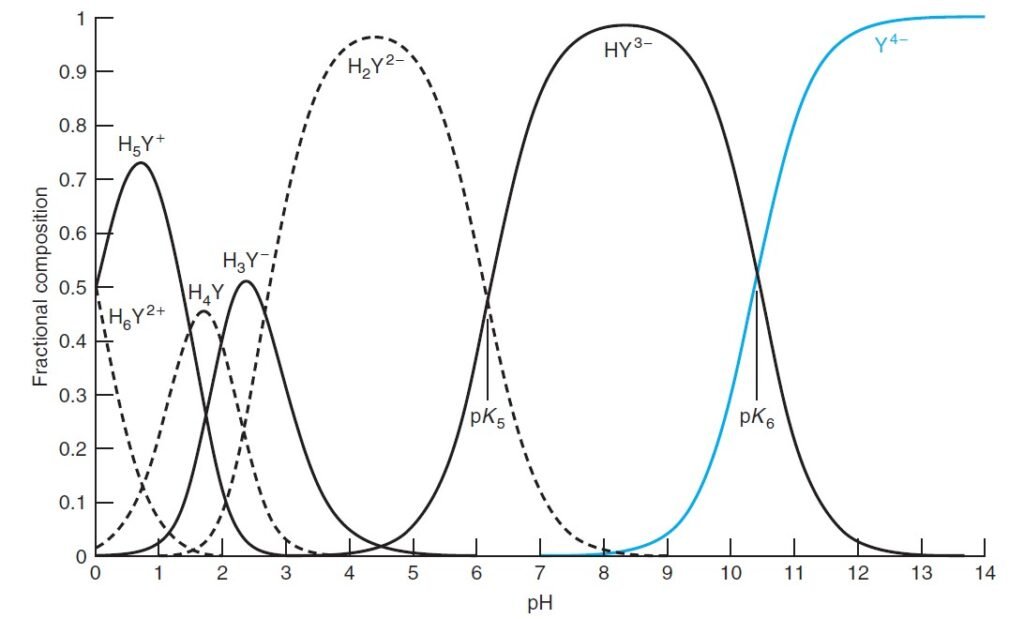
EDTA exists in up to 7 different acid-base forms depending on the solution pH.
يوجد الـ EDTA في سبعة أشكال حمض-قاعدة و ذلك اعتمادا على قيمة الرقم الهيدروجيني للمحلول.
The most basic form (Y4-) is the one which primarily reacts with metal ions.
الشكل الأكثر قاعدية –Y4 هو المهم فيما بينها و القادر على التفاعل مع أيونات الفلز.
Fractional composition diagram for EDTA shown below .
يظهر الشكل أدناه التركيب التجزيئي لـ EDTA .
We can define alpha (α) for each species as the fraction of EDTA in that form. For example, αY4- is defined as:
كما يمكننا تحديد كسر (α) كل جسيم ككسر لـ EDTA في تلك الهيئة. فمثلا يمكن حساب –αY4 كما يأتي:
where [EDTA] is the total concentration of all free EDTA species in the solution.
حيث [EDTA] هو التركيز الكلي لجميع جسيمات EDTA الحرة في المحلول .
where D = [H+]6 + [H+]5K1 + [H+]4K1K2 + [H+]3K1K2K3 + [H+]2K1K2K3K4 +[H+]K1K2K3K4K5 + K1K2K3K4K5K6.
The following Table gives values for αY4- as a function of pH.
الجدول الآتي يبين قيم –αY4 كدالة للرقم الهيدروجيني pH .
EDTA Complexes EDTA معقدات
The basic form of EDTA (Y4-) reacts with most metal ions to form a 1:1 complex.(Other forms of EDTA will also chelate with metal ions)
إن الشكل القاعدي للـ EDTA و هو (–Y4) يمكن له أن يتفاعل مع أغلب أيونات الفلز لتشكيل معقد بنسبة 1:1 (أشكال EDTA الأخرى سوف ترتبط أيضا مع أيونات الفلز)
The equilibrium constant for the reaction of a metal with a ligand is called the formation constant, Kf , or the stability constant:
إن ثابت الإتزان لتفاعل الفلز مع الربيطة يعرف باسم ثابت التكوين (ثابت التشكيل) Kf أو ثابت الاستقرار :
Note that Kf for EDTA is defined in terms of the species Y4– reacting with the metal ion. The equilibrium constant could have been defined for any of the other six forms of EDTA in the solution.
لاحظ هنا أنه قد تم تعريف Kf للـ EDTA في العلاقة السابقة بناء على تفاعلات الجسيمات –Y4 مع أيون الفلز . كما يمكن تعريف ثابت الإتزان مع أي من جسيمات الـEDTA الستة السابقة الموجودة في المحلول.
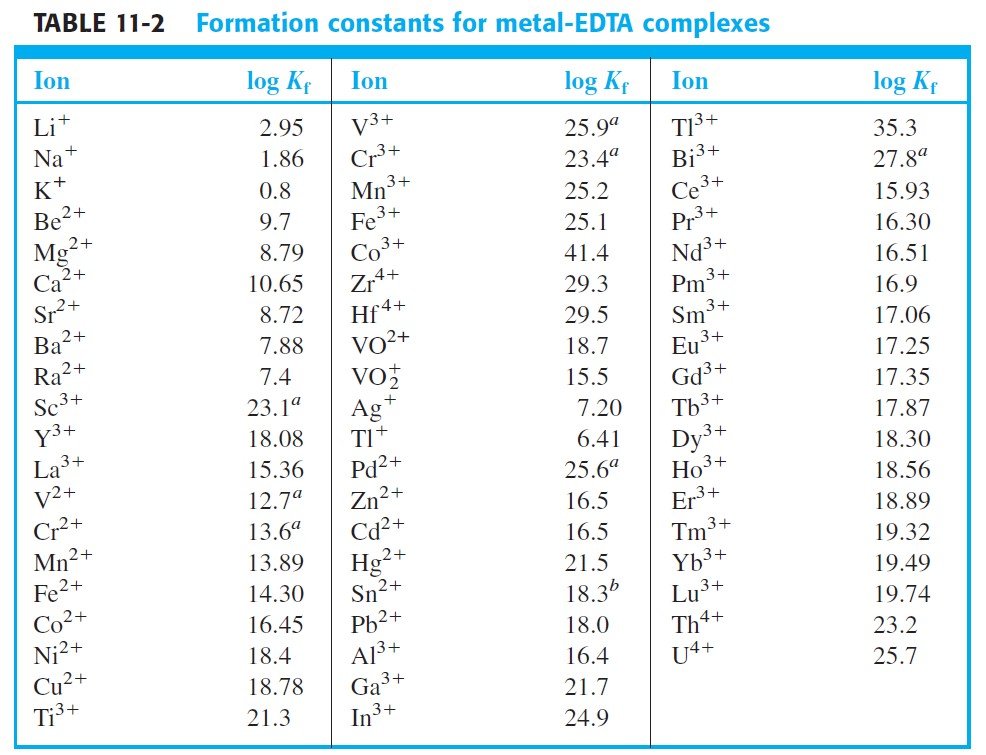
the following table shows that formation constants for most EDTA complexes are large and tend to be larger for more positively charged cations.
يوضح الجدول الآتي أن ثوابت التكوين (ثوابت التشكسل) لمعظم معقدات EDTA كبيرة وتميل إلى أن تكون أكبر بالنسبة للكاتيونات الموجبة الشحنة.
Conditional Formation Constant ثابت التكوين الظرفي
The species HY3–, H2Y2–, and so on, predominate at below pH 10.37. From the definition αY4- = [Y4–]/[EDTA], we can express the concentration of Y4– as:
عندما يكون الرقم الهيدروجيني أقل من 10.37 فإن الجسيمات –HY3 و –H2Y2 و غيرها تكون موجودة أيضا، و من التعريف أن :
αY4- = [Y4–]/[EDTA]
فإنه يمكننا التعبير عن تركيز –Y4 كما يأتي :
Where [EDTA] is the total concentration of all EDTA species not bound to metal ion.
حيث [EDTA] التركيز الكلي لجميع جسيمات EDTA غير المرتبطة مع أيون الفلز.
The formation constant can now be rewritten as:
و يمكن إعادة كتابة ثابت التكوين كما يأتي :
If the pH is fixed by a buffer, then αY4- is a constant that can be combined with Kf:
فإذا تم تثبيت قيم الرقم الهيدروجيني من خلال محلول منظم، فإن الثابت –αY4 يمكن ربطه مع Kf فتصبح العلاقة كما يأتي:
The number Kf‘ = αY4– Kf is called the conditional formation constant, or the effective formation constant. It describes the formation of MYn– 4 at any particular pH.
تعرف القيمة Kf‘ = αY4– Kf باسم ثابت التكوين الظرفي أو ثابت التكوين الفعال ، و هي تفسر تكوين MYn– 4 عند أي قيمة محددة للرقم هيدروجيني pH .
The conditional formation constant allows us to look at EDTA complex formation as if the uncomplexed EDTA (Mn+) were all in one form:
تسمح لنا معادلة ثابت التكوين الظرفي بالنظر إلى تكوين معقد الـ EDTA كما لو كان الـEDTA الذي لم يدخل في تفاعل تكوين التعقيد (+Mn) كله في شكل واحد:
At any given pH, we can find αY4- and evaluate Kf‘.
فحسب العلاقة السابقة فإنه يمكننا حساب –αY4 و تقييم ‘Kf عند أي درجة pH .
11 – 3 منحنيات معايرة EDTA
11 – 3 EDTA Titration Curves
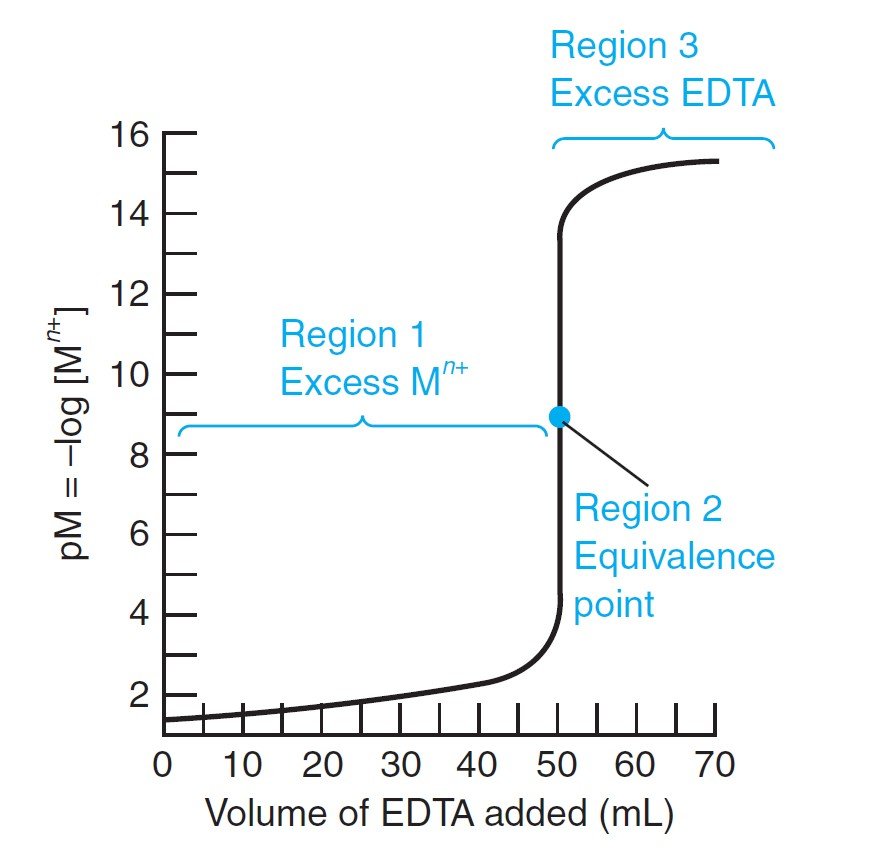
The titration curve is a graph of pM (= –log[Mn+]) versus the volume of added EDTA. There are three natural regions of the titration curve.
منحنى المعايرة هو رسم يمثل pM (= –log[Mn+]) مقابل حجم EDTA المضاف . و هناك ثلاثة مناطق طبيعية في منحنى المعايرة .
المنطقة 1: قبل نقطة التكافؤ Region 1: Before the Equivalence Point
In this region, there is excess Mn+ left in solution after the EDTA has been consumed. The concentration of free metal ion is equal to the concentration of excess, unreacted Mn+. The dissociation of MYn – 4 is negligible.
في هذه المنطقة ، يتبقى هناك فائض من +Mn في المحلول بعد استهلاك جميع EDTA. وفي هذه الحالة يكون تركيز أيون الفلز الحر يساوي تركيز +Mn الفائض غير المتفاعل. كما أنه يمكن تجاهل تفكك MYn – 4 .
المنطقة 2: عند نقطة التكافؤ Region 2: At the Equivalence Point
There is exactly as much EDTA as metal in the solution. We can treat the solution as if it had been made by dissolving pure MYn–4. Some free Mn+ is generated by the slight dissociation of MYn–4:
في هذه المنطقة كمية EDTA في المحلول تكون مساوية تماما لكمية الفلز ، و يمكن التعامل مع المحلول كما لو و كأنه قد تم تحضيره من تذويب MYn–4 النقي. تنتج بعض أيونات +Mn عن طريق التفكك المحدود لـ MYn–4 .
المنطقة 3: بعد نقطة التكافؤ Region 3: After the Equivalence Point
Now there is excess EDTA, and virtually all the metal ion is in the form MYn–4. The concentration of free EDTA can be equated to the concentration of excess EDTA added after the equivalence point.
في هذه المنطقة يوجد الآن فائض من الـ EDTA ، كما أن جميع الأيونات الفلزية تقريبًا في شكل MYn–4. يمكن معادلة تركيز EDTA الحر بتركيز EDTA الزائد المضاف بعد نقطة التكافؤ.
Titration Calculations حسابات المعايرة
Example. Construct the titration curve for 50.0 ml of a M Ca2+ solution (buffered at pH 10.00) with 0.0800 M EDTA.
مثال : قم برسم منحنى معايرة لمحلول يحتوي أيونات الكالسيوم +Ca2 حجمه 50 مل تم معايرته مع محلول EDTA تركيزه 0.0800 مول/لتر عند درجة حموضة تساوي 10.
Titration reaction: Ca2+ + EDTA → CaY2-
Solution: From Tables 11-1 and 11-2
Log Kf for Ca2+ = 10.65 , ∴ Kf = 4.46 × 1010 , αY4- = 0.3
Kf‘ = αY4-× Kf
Kf‘ = 4.46 × 1010 × 0.3 = 1.34 × 1010
Since Kf‘ is large, The reaction goes to completion with each addition of titrant.
The equivalence Volume =
M1 × V1 = M2 × V2
(0.0400 M) × (50.00) = (0.0800 M) × (V2)
V2 = 25.00 mL
Our goal to make a graph in which pCa2+ (=–log[Ca2+]) is plotted versus milliliters of added EDTA.
Region 1: Before the Equivalence Point
Consider the addition of 5.0 mL of EDTA. Because the equivalence point requires 25.0 mL of EDTA, one-fifth of the Ca2+ will be consumed and four-fifths remains.
افترض انه تم إضافة 5 مل من EDTA ، و حيث أن الوصول إلى نقطة التكافؤ يحتاج إلى 25 مل من EDTA ، فإنه باستطاعتنا القول بأن ما تم استهلاكه من +Ca2 هو الخمس و الأربعة أخماس الاخرى لا زالت موجودة في المحلول :
In a similar manner, we could calculate pCa2+ for any volume of EDTA less than 25.0 mL.
و بنفس الطريقة يمكن حساب +pCa2 لأي حجم مضاف من EDTA أقل من 25 مل .
Region 2: At the Equivalence Point
Virtually all the metal is in the form CaY2–, the concentration of CaY2– is equal to the original concentration of Ca2+.
فرضيا جميع أيونات الفلز تكون على شكل –CaY2 , كما يكون تركيز –CaY2 مساويا لتركيز +Ca2 الأصلي .
The concentration of free Ca2+ is small and unknown. We can write
إن تركيز أيونات +Ca2 الحرة قليل و مجهول . لذلك يمكننا أن نكتب :
Region 3: After the Equivalence Point
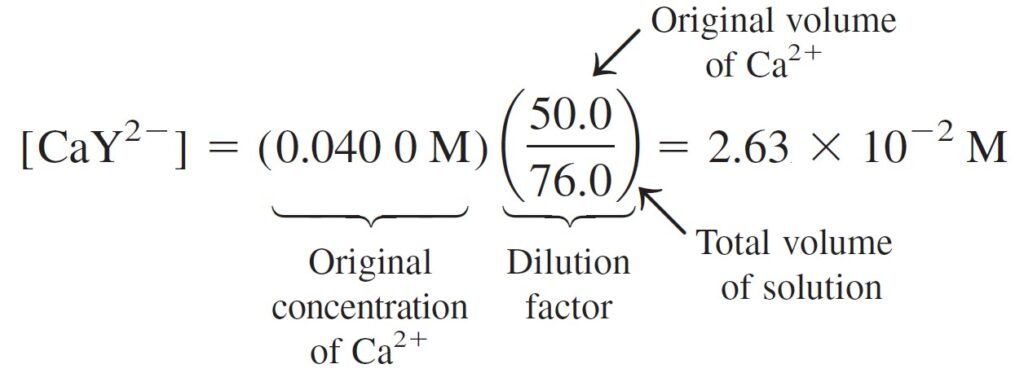
In this region, virtually all the metal is in the form CaY2–, and there is excess, unreacted EDTA. The concentrations of CaY2– and excess EDTA are easily calculated. For example, at 26.0 mL, there is 1.0 mL of excess EDTA.
فرضيا في هذه المنطقة جميع أيونات الفلز تكون على صورة –CaY2 و يكزن هناك كمية فائضة من EDTA غير متفاعلة . و هنا يمكن حساب تراكيز –CaY2 و الكمية الفائضة من EDTA بكل سهولة. فمثلا عند 26 مل فإن هناك مليلتر واحد فائض من EDTA .
The titration curve منحنى المعايرة
The above curve shows calculated titration curves for Ca2+ and Sr2+ .
الرسم البياني أعلاه يبين منحنى معايرة لكل من +Ca2 و +Sr2 .
The curve show a distinct break at the equivalence point, where the slope is greatest.
يُظهر المنحنى فاصلًا واضحًا عند نقطة التكافؤ ، حيث يكون الميل أكبر.
The equivalence point is sharper for Ca2+ than Sr2+ because CaY2– having larger αY4-Kf, than that of SrY2–.
تكون نقطة التكافؤ لـ +Ca2 أكثر وضوحًا من تلك لـ +Sr2 لأن قيمة الـ αY4-Kf لـ –CaY2 أكبر من تلك القيمة لـ -SrY2.
If the pH is lowered, the Kf‘ decreases (because αY4- decreases), and the end point becomes less distinct.
إذا تم تخفيض الرقم الهيدروجيني ، فإن Kf تنخفض أيضا (لأن –αY4 ينخفض) ، وتصبح نقطة النهاية أقل وضوحا.
11 – 5 عوامل التعقيد المساعدة
11 – 4 Auxiliary Complexing Agents
Auxiliary complexing agent is added to permit many metals to be titrated in alkaline solutions with EDTA, we use an auxiliary complexing agent.
يتم إضافة عامل التعقيد المساعد للسماح بمعايرة العديد من الفلزات في المحاليل القلوية باستخدام EDTA ، نستخدم عامل تعقيد مساعد.
Auxiliary Complexing Agents: a ligand can be added that complexes with Mn+ strong enough to prevent hydroxide formation.
عوامل التعقيد المساعدة: يمكن إضافة ربيطة أو لاقط بحيث تشكل مركب معقد قوي بما يكفي مع +Mn لمنع تكوين الهيدروكسيد.
This reagent is a ligand, such as ammonia, tartrate, citrate, or triethanolamine, that binds the metal strongly enough to prevent metal hydroxide from precipitating but weakly enough to give up the metal when EDTA is added.
و هذا العامل عبارة عن ربيطة أو لاقط ، مثل الأمونيا ، أو ترترات ، أو سترات ، أو ثلاثي إيثانول أمين triethanolamine ، و الذي يعمل على الارتباط بالفلز بقوة كافية لمنع هيدروكسيد الفلز من الترسب ولكنه بنفس الوقت ضعيف بما يكفي للتخلي عن الفلز عند إضافة EDTA.
Metal-Ligand Equilibria إتزان الفلز-الربيطة
Consider a metal ion that forms two complexes with the auxiliary complexing ligand L:
افترض أن لدينا أيون فلزي يمكنه تكوين مركبين معقدين مع لاقط أو ربيطة تعقيد مساعدة
The equilibrium constants, βi, are called overall or cumulative formation constants. The fraction of metal ion in the uncomplexed state, M, can be expressed as
تعرف ثوابت الإتزان βi بثوابت التكوين الكلية أو التراكمية. و يمكن التعبير عن جزء أيون الفلز في الحالة غير المعقدة ، M ، كما يأتي :
where Mtot is the total concentration of all forms of M (= M, ML, and ML2 in this case). Now let’s find a useful expression for αM. The mass balance for metal is:
حيث Mtot هو التركيز الكلي لجميع أشكال M ) = M و ML و ML2 في هذه الحالة) ، و الآن لنجد معادلة يمكن الاستفادة منها لـ αM . إن توازن الشحنة لهذا الفلز هو :
Mtot = [M] + [ML] + [ML2]
So we can say:
لذلك يمكننا القول بأن :
[ML] = β1[M][L] and [ML2] = β2[M][L]2
Therefore,
By substitution
معايرة EDTA مع عامل تعقيد مساعد
EDTA Titration with an Auxiliary Complexing Agent
In the presence of auxiliary complexing agents, we use a new conditional formation constant that incorporates the fraction of free metal ( Zn for example) at a fixed pH.
في وجود عوامل تعقيد مساعدة ، نستخدم ثابت تكوين ظرفي جديد يشتمل على جزء من الفلز الحر ( Zn مثلا) عند درجة pH ثابتة.
Kf” = αZn2+αY4–Kf
المصادر:
- Quantitative Chemical Analysis by Daniel C. Harris, 8th Edition
- الموسوعة العلمية الكيميائية للأستاذ أكرم العلي
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2