ملخص الفصل الثامن من كتاب الكيمياء -تشانج و أوفربي Chapter 8 Notes CHEMISTRY Chang & Overby
Posted in :
ملخص الفصل الثامن من كتاب الكيمياء -ريموند تشانج (شانج) و جاسون أوفربي Chapter 8 Notes CHEMISTRY Chang & Overby
ملاحظة: للحصول على ملخص للفصل الثالث من هذا الكتاب يرجى الضغط على : ملخص الفصل الثالث من كتاب الكيمياء -تشانج و أوفربي Chapter 3 Notes CHEMISTRY Chang & Overby
ملخص الفصل الرابع من هذا الكتاب تجده في الرابط الآتي:ملخص الفصل الرابع من كتاب الكيمياء – ريموند تشانج (شانج) و جاسون أوفربي Chapter 4 Notes CHEMISTRY Chang & Overby
ملخص الفصل التاسع من هذا الكتاب تجده في الرابط الآتي: ملخص الفصل التاسع من كتاب الكيمياء -تشانج (شانج) و أوفربي Chapter 9 Notes CHEMISTRY Chang & Overby
ملخص الفصل العاشر من هذا الكتاب تجده في الرابط الآتي: ملخص الفصل العاشر من كتاب الكيمياء – ريموند تشانج (شانج) و جاسون أوفربي Chapter 10 Notes CHEMISTRY Chang & Overby
Periodic Relationships Among the Elements
ملخص الفصل الثامن من كتاب الكيمياء -ريموند تشانج (شانج) و جاسون أوفربي: العلاقات الدورية بين عناصر الجدول الدوري
1.8 تطوّر الجدول الدوري Development of the Periodic Table
- في القرن التاسع عشر ، ابتكر الكيميائيون الجدول الدوري باستخدام معلوماتهم بالكتل الذرية للذرات.
- بدا ترتيب العناصر وفقًا لكتلها الذرية في جدول دوري أمرًا منطقيًا بالنسبة لهؤلاء الكيميائيين ، الذين شعروا أن السلوك الكيميائي يجب أن يرتبط بطريقة ما بالكتلة الذرية.
- لاحظ الكيميائي الإنجليزي نيولاندز أنه عندما يتم ترتيب العناصر حسب الكتلة الذرية ، فإن كل عنصر يتشابه في الخصائص مع العنصر الثامن بالنسبة له.
- قانون الثمانيات هو تعميم من قبل نيولاندز ينص على أنه إذا تم ترتيب العناصر الكيميائية وفقًا لزيادة الوزن الذري ، فإن العناصر ذات الخصائص الفيزيائية والكيميائية المتشابهة تتكرر بعد كل فاصل زمني من سبعة عناصر.
- كان نيولاندز من أوائل الذين اكتشفوا نمطًا دوريًا في خصائص العناصر والتطورات اللاحقة المتوقعة للقانون الدوري.
- اقترح الكيميائي الروسي ديمتري مندليف والكيميائي الألماني لوثار ماير بشكل مستقل جدولا أكثر شمولاً للعناصر بناءً على التكرار المنتظم والدوري للخصائص.
- كان لنظام تصنيف مندليف تحسنا كبيرا مقارنة بنظام تصنيف نيولاندز لسببين:
- جمع العناصر بدقة أكبر وفقا لخصائصها ؛
- جعل من الممكن التنبؤ بخصائص العديد من العناصر التي لم يتم اكتشافها بعد.
- الإصدارات الأولية من جدول مندليف احتوت على تناقضات. على سبيل المثال لم يتمكن من تفسير سبب وضع الأرجون (39.95 amu) قبل البوتاسيوم (39.10 amu) إذا تم ترتيب العناصر فقط وفقًا لزيادة الكتلة الذرية.
- في عام 1913 ، اكتشف موسلي تواترا بين ما أسماه العدد الذري و الأشعة السينية الناتجة عن قصف عنصر بإلكترونات عالية الطاقة.
- لاحظ موسلي أن ترددات الأشعة السينية المنبعثة من العناصر يمكن ربطها بالمعادلة
حيث ν هو تردد الأشعة السينية المنبعثة و a و b هما ثوابت متماثلة لجميع العناصر.
- وجد موسلي أن العدد الذري يزيد بنفس ترتيب الكتلة الذرية.
- نظرًا لأن العدد الذري للأرجون هو 18 و للبوتاسيوم هو 19 ، فإن ذلك ساعد العلماء على فهم سبب وجود البوتاسيوم خلف الأرجون في الجدول الدوري.
- العناصر الموجودة في الجدول الدوري مرتبة وفقًا لأعدادها الذرية.
- تساعد التوزيعات الإلكترونية للعناصر في تفسير تكرار الخواص الفيزيائية والكيميائية لها.
2.8 التصنيف الدوري للعناصر
Periodic Classification of the Elements
- وفقًا لنوع المستويات الفرعية التي يتم ملؤها ، يمكن تقسيم العناصر إلى فئات:
1 – العناصر الممثلة: هي العناصر الموجودة في المجموعات من 1A إلى 7A ، و تمتلك جميعها مستويات فرعية من نوع s و p غير ممتلئة و لها أعلى عدد كم رئيسي.
2 – الغازات النبيلة: هي العناصر التي تقع في المجموعة 18 أو 8A وجميعها لها مستويات فرعية ممتلئة بالكامل مع توزيع إلكتروني ns2np6 (ماعدا الهيليوم ذو التوزيع الإلكتروني 1s2) ، حيث n هو عدد الكمي الرئيس للمستوى الخارجي.
3 – العناصر الانتقالية (أو الفلزات الانتقالية) هي العناصر الموجودة في المجموعات 1B و 3B إلى 8B، والتي تحتوي على مستويات فرعية ممتلئة بشكل غير كامل ، أو أنها تُكوَّن بسهولة كاتيونات ذات مستويات d فرعية غير ممتلة بالكامل. يوضح الترقيم غير المتسلسل للفلزات الانتقالية في الجدول الدوري (أي 3B إلى 8B ، متبوعًا بـ 1B و 2B) بوجود تطابق بين التوزيع الإلكتروني الخارجي لهذه العناصر و ذلك للعناصر الممثلة. على سبيل المثال ، يحتوي كل من سكانديوم والجاليوم على ثلاثة إلكترونات خارجية و نظرًا لوجودها في أفلاك ذرية مختلفة، فقد تم وضع كلا العنصرين في مجموعتين مختلفتين (3B و 3A). كما لا تتوافق فلزات الحديد (Fe) والكوبالت (Co) والنيكل (Ni) مع هذا التصنيف و بناء عليه فقد تم وضعها جميعًا في المجموعة 8B. كما أن عناصر المجموعة 2B ، و هي Zn ، Cd ، و Hg تعتبر ليست فلزات ممثلة ولا فلزات انتقالية. أوصى الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) بترقيم الأعمدة بالتسلسل بالأرقام العربية من 1 إلى 18.
4 – اللانثانيدات والأكتينيدات: تسمى أحيانًا عناصر القطاع f الإنتقالية لأنها تحتوي على مستويات f فرعية غير رممتلئة بالكامل. - يتم تحديد التفاعل الكيميائي للعناصر إلى حد كبير من خلال إلكترونات التكافؤ (الإلكترونات الخارجية).
- يشار إلى جميع إلكترونات عدم التكافؤ في الذرة بالإلكترونات الأساسية.
- تعرف الإلكترونات الخارجية للذرة و التي تشارك في الترابط الكيميائي باسم إلكترونات التكافؤ.
- إن تشابه في التوزيع الإلكتروني لإكترونات التكافؤ هو ما يجعل العناصر في نفس المجموعة تشبه بعضها البعض في السلوك الكيميائي.
- تحتوي جميع الفلزات القلوية (عناصر المجموعة 1A) على توزيع إلكتروني لإلكترونات التكافؤ ns1 وجميعها تميل إلى فقد إلكترون واحد لتكوين الكاتيونات موجبة أحادية الشحنة.
- تحتوي جميع الفلزات القلوية الترابية (عناصر المجموعة 2A) على توزيع إلكتروني لإلكترونات التكافؤ ns2 ، وكلها تميل إلى فقدان إلكترونين لتكوين الكاتيونات موجبة ثنائية الشحنة.
- تحتوي جميع العناصر في المجموعة 4A على نفس تكوين إلكترون التكافؤ ns2np2 ، ولكن هناك تباينًا ملحوظًا في الخصائص الكيميائية بين العناصر: فالكربون عنصر فلزي ، والسيليكون والجرمانيوم عبارة عن أشباه فلزات ، و القصدير و الرصاص فلزات.
- كمجموعة ، تتصرف الغازات النبيلة بشكل مشابه جدًا. فعنصري الهيليوم والنيون يعتبران خاملان كيميائيًا تماما، ولكن هناك أمثلة قليلة لمركبات تكونت من الغازات النبيلة الأخرى. و يرجع هذا النقص في التفاعل الكيميائي إلى المستويات الفرعية المتلئة بالكامل ns و np.
- تتشارك جميع الفلزات الانتقالية في العديد من الخصائص التي تميزها عن العناصر الأخرى. والسبب هو أن جميع هذه المعادن لها مستويات d فرعية غير ممتلئة.
- تتشابه عناصر اللانثانيدات (والأكتينيدات) مع بعضها البعض لأنها جميعا تمتلك مستويات f فرعية غير ممتلئة.
تمثيل العناصر الحرة في المعادلات الكيميائية
- نظرًا لكون الفلزات لا توجد في وحدات جزيئية منفصلة ، فإننا نستخدم دائمًا صيغها التجريبية في المعادلات الكيميائية.
- الصيغ التجريبية هي نفس الرموز التي تمثل العناصر.
لا توجد قاعدة واحدة لللافلزات:
1 – بالنسبة للكربون ، نستخدم صيغته التجريبية (C) لتمثيل عنصر الكربون في المعادلات الكيميائية.
2 – بالنسبة للهيدروجين و النيتروجين والأكسجين والهالوجينات و التي توجد على شكل جزيئات ثنائية الذرة ، لذلك نستخدم صيغها الجزيئية (H2, N2, O2, F2, Cl2, Br2, I2 ) في المعادلات.
3 – الشكل المستقر لجزيء الفوسفور (P4) ، لذا نستخدم P4.
4 – بالنسبة للكبريت ، غالبًا ما يستخدم الكيميائيون الصيغة التجريبية (S) في المعادلات الكيميائية ، بدلاً من S8 ، وهي شكل مستقر أيضا للكبريت. و عليه، فبدلاً من كتابة معادلة احتراق الكبريت على النحو التالي:
S8(s) + 8 O2(g) → 8SO2(g)
نكتب عادة:
S(s) + O2(g) → SO2(g)
- الغازات النبيلة هي أحادية الذرة. لذلك نستخدم رموزها المجردة:He, Ne, Ar, Kr, Xe, و Rn
- يتم تمثيل الفلزات بصيغها التجريبية ، أي رموزها: B ، Si ، Ge وما إلى ذلك.
التوزيع الإلكتروني للكاتيونات و الأنيونات
- تتكون العديد من المركبات الأيونية من أنيونات وكاتيونات أحادية الذرة ، لذا من المفيد معرفة كيفية كتابة التوزيع الإلكتروني الإلكترون لهذه الكينونات الأيونية.
الأيونات المشتقة من العناصر الممثلة
- الأيونات المتكونة من ذرات أغلب العناصر الممثلة لها التوزيع الإلكتروني الخارجي للغاز النبيل ns2np6.
- عند تكوُّن كاتيون من ذرة عنصر ممثل ، تتم إزالة إلكترون واحد أو أكثر من أعلى مستوى n مشغول.
- فيما يلي التوزيعات الإلكترونية لبعض الذرات المتعادلة وكاتيوناتها المقابلة:
Na: [Ne]3s1 Na+: [Ne]
Ca: [Ar]4s2 Ca2+: [Ar]
Al: [Ne]3s23p1 Al3+: [Ne]
- عند تكوين الأنيون ، تتم إضافة إلكترون واحد أو أكثر إلى أعلى مستوى n مملوء جزئيًا. تأمل الأمثلة التالية:
H: 1s1 H−: 1s2 or [He]
F: 1s22s22p5 F−: 1s22s22p6 or [Ne]
O: 1s22s22p4 O2−: 1s22s22p6 or [Ne]
N: 1s22s22p3 N3−: 1s22s22p6 or [Ne]
- لاحظ أن −F و+Na و Ne (و +Al3 و −O2 و −N3 ) لها نفس التوزيع الإلكتروني ويقال عنها إنها متساوية الإلكترونات (أيزو إلكترونية) لأن لديها نفس عدد الإلكترونات ، وبالتالي نفس التوزيع إلكتروني في الحالة المستقرة. لذا فإن −H و He أيضًا متساوية الإلكترونات.
الكاتيونات المشتقة من الفلزات الانتقالية
- حيث أن الفلك 4s يتم ملؤه دائمًا قبل الفلك 3d كما في حالة Mn ، فإنه تتم إزالة الإلكترونات من فلك 4s عند تكوين +Mn2 لأن الفلك 3d أكثر استقرارًا من الفلك 4s في أيونات الفلزات الانتقالية.
- عندما يتشكل الكاتيون من ذرة معدن انتقالي ، يتم دائمًا إزالة الإلكترونات أولاً من الفلك ns ثم من الأفلاك n − 1)d ).
3.8 التغير الدوري للصفات الفيزيائية Periodic Variation in Physical Properties
- نظرًا لأن التوزيعات الإلكترونية للعناصر تُظهر تباينًا دوريًا مع زيادة العدد الذري ، فإن هناك أيضًا اختلافات دورية في السلوك الفيزيائي والكيميائي.
الشحنة النووية الفعالة
- الشحنة النووية الفعالة (Zeff) هي الشحنة التي يشعر بها الإلكترون عندما يؤخذ بالاعتبار كل من شحنة النواة الفعلية (Z) والتأثيرات التنافر من لإلكترونات الأخرى. و بشكل عام ، يتم حساب Zeff بواسطة:
Zeff = Z ‒ σ
حيث σ ثابت الحجب، و ثابت الحجب أكبر من الصفر ولكنه أصغر من Z.
- نظرًا لأن الإلكترونات الداخلية أقرب إلى النواة من إلكترونات التكافؤ ، فإن الإلكترونات الداخلية تحمي إلكترونات التكافؤ أكثر بكثير من إلكترونات التكافؤ التي تحمي بعضها البعض.
نصف القطر الذري
- نصف القطر الذري هو نصف المسافة بين نواتي ذرتين متجاورتين من الفلز أو في الجزيء ثنائي الذرة.
- نظرًا لأن الشحنة النووية الفعالة تزداد من اليسار إلى اليمين ، فإن إلكترون التكافؤ المضاف في كل خطوة ينجذب بقوة إلى النواة أكثر من السابق.
- في الدورة ، يتناقص نصف القطر الذري من اليسار إلى اليمين. و ضمن المجموعة المجموعة نجد أن نصف القطر الذري يزداد من أعلى إلى أسفل.
نصف القطر الأيوني
- نصف القطر الأيوني هو نصف قطر الكاتيون أو الأنيون و يمكن قياسه من خلات تقنية حيود الأشعة السينية (حيود أشعة X).
- إن لنصف القطر الأيوني تأثير على الخصائص الفيزيائية و الكيميائية للمركب الأيوني. فمثلا يعتمد البناء ثلاثي الأبعاد للمركب الأيوني على الأحجام النسبية لكاتيوناته و أنيوناته .
- إذا تحولت الذرة إلى أنيون ، فإن حجمها (أو نصف قطرها) يزداد لأن الإلكترون (الإلكترونات) الإضافي يزيد من نطاق الغيمة الإلكترونية.
أما إذا تحولت الذرة إلى كاتيون ، فإن حجمها (أو نصف قطرها) يقل لأن إزالة إلكترون واحد أو أكثر من ذرة يقلل من تنافر الإلكترون-الإلكترون وبالتالي تنكمش الغيمة الإلكترونية. - يزداد نصف القطر الأيوني ضمن المجموعة من الأعلى إلى الأسفل.
- يتناقص نصف القطر الأيوني ضمن الدورة من اليسار إلى اليمين.
- بالنسبة للأيونات الأيزوإلكترونية أو متساوية الإلكترون (أيونات تمتلك نفس عدد الإلكترونات) فإن الكاتيونات تكون أصغر حجما من الأنيونات. على سبيل المثال +Na أصغر من −F لكن Na بها بروتونات أكثر من F. و تتسبب شحنة +Na النووية الفعالة الأكبر في نصف قطر أقل.
- الأيونات ثلاثية الشحنة الموجبة(الأيونات التي تحمل ثلاث شحنات موجبة) أصغر من الأيونات ثنائية الشحنة الموجبة (أيونات تحمل شحنتين موجبتين)، والتي بدورها تكون أصغر من الأيونات أحادية الشحنة الموجبة (أيونات تحمل شحنة موجبة واحدة).
تباين الخصائص الفيزيائية عبر الدورة و خلال المجموعة
- من اليسار إلى اليمين عبر الدورة ، هناك انتقال من الفلزات إلى أشباه الفلزات إلى اللافلزات.
- ضمن عناصر الدورة الثالثة ، يعتبر الصوديوم معدنًا شديد التفاعل ، بينما الكلور مادة غير فلزية شديدة التفاعل.
- لكل من الصوديوم والمغنيسيوم والألمنيوم شبكات ذرية ثلاثية الأبعاد واسعة النطاق.
- السيليكون هو فلز و له هيكل ثلاثي الأبعاد عملاق حيث تتماسك ذرات السيليكون معًا بقوة.
- يوجد الفوسفور والكبريت والأرجون في وحدات جزيئية بسيطة ومنفصلة ذات درجات انصهار منخفضة و درجات غليان منخفضة أيضا.
- داخل المجموعة تختلف الخصائص الفيزيائية بشكل أكثر توقعًا.
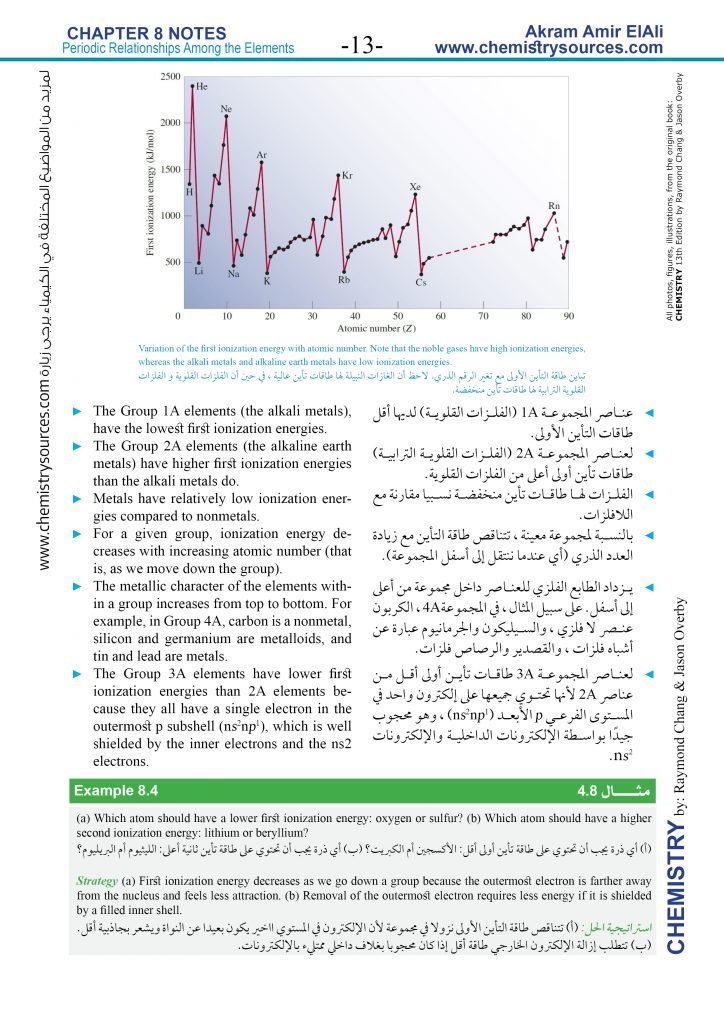
4.8 طاقة التأين Ionization Energy
- طاقة التأين (IE) هي الحد الأدنى من الطاقة (بوحدة كيلوجول/مول) المطلوبة لإزالة إلكترون واحد من ذرة غازية في حالتها المستقرة.
- كلما زادت طاقة التأين ، زادت صعوبة إزالة الإلكترون.
- بالنسبة لذرة متعددة الإلكترونات، فإن كمية الطاقة المطلوبة لإزالة الإلكترون الأول من الذرة في حالتها المستقرة ، تسمى طاقة التأين الأولى (IE1).
- كمية الطاقة المطلوبة لإزالة الإلكترون الثاني من الأيون الموجب تسمى طاقة التأين الثانية (IE2).
- عند إزالة الإلكترون من الذرة ، ينخفض التنافر بين الإلكترونات المتبقية، و نظرًا لأن الشحنة النووية تظل ثابتة ، فإنه سوف يكون هناك حاجة إلى مزيد من الطاقة لإزالة إلكترون آخر من الأيون موجب الشحنة. وبالتالي ، تزداد طاقات التأين دائمًا بالترتيب الآتي:
IE1 < IE2 < IE3 < . . .
- تزداد طاقات التأين الأولى للعناصر في دورة ما مع زيادة العدد الذري بسبب زيادة الشحنة النووية الفعالة من اليسار إلى اليمين.
- عناصر المجموعة 1A (الفلزات القلوية) لديها أقل طاقات التأين الأولى.
- لعناصر المجموعة 2A (الفلزات القلوية الترابية) طاقات تأين أولى أعلى من الفلزات القلوية.
- الفلزات لها طاقات تأين منخفضة نسبيا مقارنة مع اللافلزات.
- بالنسبة لمجموعة معينة ، تتناقص طاقة التأين مع زيادة العدد الذري (أي عندما ننتقل إلى أسفل المجموعة).
- يزداد الطابع الفلزي للعناصر داخل مجموعة من أعلى إلى أسفل. على سبيل المثال ، في المجموعة4A ، الكربون عنصر لا فلزي ، والسيليكون والجرمانيوم عبارة عن أشباه فلزات ، والقصدير والرصاص فلزات.
- لعناصر المجموعة 3A طاقات تأين أولى أقل من عناصر 2A لأنها تحتوي جميعها على إلكترون واحد في المستوى الفرعي p الأبعد (ns2np1) ، وهو محجوب جيدًا بواسطة الإلكترونات الداخلية والإلكترونات ns2.
5.8 الألفة الإلكترونية Electron Affinity
- تعرف الألفة الإلكترون (EA) ، بأنها التغير في طاقة ذرة غازية بالكيلوجول/مول عندما يضاف إليها إلكترون لتكوين أيون سالب.
F(g) + e− → F−(g) ΔH = −328 kJ/mol
- وهناك طريقة أخرى للنظر إلى الألفة الإلكترونية بزاوية أخرى على أنها مقدار الطاقة التي يجب توفيرها لإزالة الإلكترون من الأنيون. ففي حالة الفلور مثلا يمكننا أن نكتب
F−(g) → F(g) + e− ΔH = +328 kJ/mol
- لذلك يمكننا القول أن الألفة الإلكترونية ذات القيمة الكبير تعني أن الأيون السالب مستقر للغاية (أي أن الذرة لديها ميل كبير لاستقبال إلكترون) ، تمامًا كما هو الحال عندما تعني طاقة التأين العالية للذرة أن الإلكترون في الذرة مستقر للغاية.
- الاتجاه العام هو زيادة الميل لقبول الإلكترونات (تصبح قيم الألفة الإلكترونية موجبة أكثر) كلما انتقلنا في الدورة من اليسار إلى اليمين.
- الألفة الإلكترونية للفلزات و بشكل عام أقل من تلك في اللافلزات.
- تختلف قيم الألفة الإلكترونية قليلاً ضمن المجموعة الواحدة. لذلك تعتبر قيم الألفة الإلكترونية للهالوجينات (المجموعة 7A) أعلى قيم ألفة إلكترونية.
- الألفة الإلكترونية لعناصر المجموعة 2A أقل من تلك لعناصر المجموعة 1A المقابلة لها ، و أيضا الألفة الإلكترونية لعناصر المجموعة 5A أقل من تلك لعناصر المجموعة 4A المقابلة لها.
6.8 التفاوت في الخصائص الكيميائية للعناصر الممثلة.
Variation in Chemical Properties of the Representative Elements
- أن الخاصية الفلزية للعناصر تتناقص من اليسار إلى اليمين في الدورة، وتزداد من الأعلى إلى الأسفل في المجموعة.
اتجاهات عامة في الخصائص الكيميائية
- أن عناصر المجموعة الواحدة يشابه الواحد منها الآخر من حيث السلوك الكيميائي، لأنها تمتلك التوزيع الإلكتروني الخارجي نفسه، و لكن هناك استثناءات لهذا العبارة.
- يختلف أول فرد في المجموعة عن باقي أفراد مجموعته، فمثلا يظهر الليثيوم كثيراً من الخصائص التي تتميز بها الفلزات القلوية، ولكن ليس جميعها، ويعزى ذلك إلى الصغر غير العادي لحجم العنصر الأول من كل مجموعة.
- توجد علاقات قُطرية من حيث أوجه التشابه بين أزواج العناصر في مجموعات و دورات مختلفة من الجدول الدوري. إن سبب هذه الظاهرة هو التقارب في كثافة شحنة كاتيوناتها.
- تكون المقارنة بين خصائص العناصر في نفس المجموعة أكثر صحة إذا كنا نتعامل مع عناصر من نفس النوع فيما يتعلق بطابعها الفلزي و ينطبق هذا الدليل الإرشادي على العناصر الموجودة في المجموعتين 1A و 2A، التي جميعها فلزات ، وعلى العناصر الموجودة في المجموعتين 7A و 8A، والتي جميعها لافلزات.
الهيدروجين (1s1)
- مثل الفلزات القلوية، يمتلك الهيدروجين إلكتروناً تكافتياً واحداً من نوع s، ويكوِّن أيوناً موجبا أحادي الشحنة (+H).
- يكوِّن الهيدروجين أيضاً أيون الهيدرايد (−H) في المركبات الأيونية مثل Nail، و CaH2، و هو في هذا يماثل الهالوجينات، إذ إنها جميعاً تكوّن أيونات سالبة أحادية الشحنة (−F−, Cl−, Br, و −I) في المركبات الأيونية.
- تتفاعل الهيدريدات الأيونية مع الماء لتكوّن هيدروكسيدات الفلزات المقابلة، و تطلق غاز الهيدروجين:
2NaH(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
CaH2(s) + 2H2O(l) → Ca(OH)2(s) + 2H2(g)
عناصر مجموعة 1A ، المجموعة الأولى (ns1, n ≥ 2)
Group 1A Elements (ns1, n ≥ 2)
- كل عنصر هذه المجموعة لها طاقات تأين منخفضة وبالتالي ميل كبير لفقدان إلكترون تكافئها الوحيد.
- في مركباتها توجد على شكل أيونات موجببة أحادية أحادية الشحنة.
- هذه الفلزات شديدة التفاعل بحيث لا توجد أبدًا في صورتها النقية في الطبيعة.
- تتفاعل مع الماء لإنتاج غاز الهيدروجين وهيدروكسيد الفلز المقابل:
2M(s) + 2H2O(l) → 2MOH(aq) + H2(g)
حيث M تشير إلى الفلز القلوي.
- عند تعرضها للهواء فإنها تفقد مظهرها اللامع لدى، حيث تتحد مع الأكسجين لتكون الأكاسيد. فمثلا يكون الليثيوم أكسيد الليثيوم (يحتوي أيون −O2):
4Li(s) + O2(g) → 2Li2O(s)
- وتكوّن باقي الفلزات القلوية الأكاسيد والبيروكسيدات (فوق الأكاسيد) (تحتوي أيون −O22).
2Na(s) + O2(g) → Na2O2(s)
- ويكوّن أيضا كل من البوتاسيوم، والروبيديوم، والسيزيوم الأكاسيد العليا (تحتوي أيون −O2 ):
K(s) + O2(g) → KO2(s)
- ولأن هذه الأكاسيد جميعها مركبات أيونية، فإن ثباتها يعتمد على قوة جذب الكاتيونات والأفيونات لبعضها، فالليثيوم يميل إلى تكوين أكسيد الليثيوم على وجه العموم، لأن هذا المركب أكثر ثباتا من فوق أكسيد الليثيوم.
عناصر المجموعة 2A ، المجموعة الثانية (ns2, n ≥ 2)
- عناصر الفلزات القلوية الترابية إلى حد ما أقل نشاطا من الفلزات القلوية.
- تنخفض كل من طاقات التأين الأولى والثانية من البريليوم إلى الباريوم.
- الميل لتكوين أيونات +M2 و تزداد الخصائص الفلزية من أعلى إلى أسفل.
معظم مركبات البريليوم (BeH2 وهاليدات البريليوم، مثل BeCl2) وبعض مركبات المغنيسيوم (MgH2 ، على سبيل المثال) ذات طبيعة جزيئية. - تختلف تفاعلات الفلزات القلوية الترابية مع الماء بشكل ملحوظ.حيث لا يتفاعل البريليوم مع الماء. و يتفاعل المغنيسيوم ببطء مع البخار ؛ في حين أن الكالسيوم والسترونشيوم والباريوم نشطة بما يكفي لأن تتفاعل مع الماء البارد:
Ba(s) + 2H2O(l) → Ba(OH)2(aq) + H2(g)
- تزداد فعالية الفلزات القلوية الترابية نحو الأكسجين بدءاً من Be إلى Ba.
- يكوِّن البيريليوم و المغنيسيوم الأكاسيد BeO وMgO عند درجات حرارة مرتفعة فقط، في حين يتكون كل من CaO وSrO وBaO عند درجة حرارة الغرفة.
يتفاعل المغنيسيوم مع الحموض في المحلول الماء مطلقا غاز الهيدروجين: - يتفاعل أيضا كل من الكالسيوم، والسترونشيوم، والباريوم مع محاليل الحموض المائية لتكوين غاز الهيدروجين.
Mg(s) + 2H+(aq) → Mg2+(aq) + H2(g)
- السترونشيوم- 90 النظير المشع هو ناتج رئيس للتفجير الذرّي.
- يؤدي التعرض المتواصل للإشعاعات ذات الطاقة العالية الصادرة عن السترونشيوم- 90 إلى الأنيميا، واللوكيميا، وأمراض أخرى خطيرة.
عناصر المجموعة 3A ، المجموعة الثالثة (ns2np1, n ≥ 2)
Group 3A Elements (ns2np1, n ≥ 2)
- أول عنصر من عناصر المجموعة 3A هو البورون وهو شبه فلز، بينما باقي العناصر في المجموعة فلزات.
- لا يشكل البورون مركبات أيونية ثنائية ولا يتفاعل مع غاز الأكسجين والماء.
يكون الألومنيوم و بسهولة أكسيد الألومنيوم عندما يتعرض للهواء:
4Al(s) + 3O2(g) → 2Al2O3(s)
- إن الألمنيوم المغطى بطبقة واقية من أكسيد الألومنيوم أقل نشاطاً من عنصر الألومنيوم الحُرّ.
- يكون الألومنيوم أيونات موجبة ثلاثية الشحنة فقط، وهو يتفاعل مع حمض الهيدروكلوريك كالآتي:
2Al(s) + 6H+(aq) → 2Al3+(aq) + 3H2(g)
- تكوّن باقي عناصر المجموعة 3A المعدنية أيونات ثنائية وثلاثية موجبة. الأيونات الموجبة أحادية الشحنة أكثر استقرارا من الأيونات الموجبة الثلاثية الشحنة.
- تكون العناصر الفلزية في المجموعة 3A العديد من المركبات الجزيئية مثل AlH3 .
عناصر المجموعة 4A ، المجموعة الرابعة (ns2np2, n ≥ 2)
Group 4A Elements (ns2np2, n ≥ 2)
- إن أول عنصر من عناصر المجموعة 4A ، وهو الكربون و هو لافلزي، والعنصران التاليـان: السيليكون والجيرمانيوم و هما أشباه فلزات.
- العنصران الفلزان في هذه المجموعة، هما القصدير والرصاص و هما لا يتفاعلان مع الماء، لكنهما يتفاعلان مع الحمض (كحمض الهيدروكلوريك مثلاً) ليطلقا غاز الهيدروجين.
Sn(s) + 2H+(aq) → Sn2+(aq) + H2(g)
Pb(s) + 2H+(aq) → Pb2+(aq) + H2(g)
- تظهر عناصر المجموعة 4A كلا من حالات تأكسد +2 و+4.
- للكربون والسيلكيون، فإن حالة التأكسد +4 هي الأكثر ثباتاً.
- في مركبات الرصاص، فإن حالة التأكسد +2 هي الأكثر ثباتاً .
عناصر المجموعة 5A ، المجموعة الخامسة (ns2np3, n ≥ 2)
Group 5A Elements (ns2np3, n ≥ 2)
- في المجموعة 5A ، النيتروجين والفوسفور عنصران لافلزان ، والزرنيخ والأنتيمون أشباه فلزات ، والبزموت فلز.
- عنصر النيتروجين هو غاز ثنائي الذرة (N2). حيث يُكوِّن عددًا من الأكاسيد جميعها غازية ماعدا N2O5 فهو مادة صلبة.
- للنيتروجين ميل إلى اكتساب ثلاثة إلكترونات ليكون أيون النيتريد −N3 .
- أغلب النيتريدات الفلزية (مثل Li3N، و Mg3N2) مركبات أيونية.
يوجد الفوسفور على شكل جزيئات P4، ويكوّن أكسيدين من الأكاسيد الصلبة P4O6، و P4O10. - تتكوّن الحموض الأكسجينية المهمة HNO3 و H3PO4 عندما تتفاعل الأكاسيد الآتية مع الماء:
N2O5(s) + H2O(l) → 2HNO3(aq)
P4O10(s) + 6H2O(l) → 4H3PO4(aq)
- للزرنيخ، والأنتيمون، والبزموث بُنيات ثلاثية الأبعاد، والبزموث أقل فعالية بكثير من الفلزات الأخرى في المجموعات السابقة.
عناصر المجموعة 6A ، المجموعة السادسة (ns2np4, n ≥ 2)
Group 6A Elements (ns2np4, n ≥ 2)
- العناصر الثلاثة الأولى من المجموعة 6A (الأكسجين، والكبريت، والسيلينيوم) لافلزية. بينما يصنف كل من التيليريوم والبولونيوم على أنهما من أشباه فلزات.
- الأكسجين غاز ثنائي الذرّة، وللكبريت والسيلينوم الصيغة S8 و Se8 ، على التوالي، ولكل من التيليريوم والبولونيوم بُنيات ذات أبعاد ثلاثية كثيفة.
- البولونيوم عنصر مشع يصعب دراسته في المختبر.
- للأكسجين ميل لاكتساب إلكترونين مكوّنا أيون الأكسيد ( −O2) في كثير من المركبات الأيونية.
- كلا من الكبريت، والسيلينيوم، والتيليريوم تكوّن أيونات ثنائية سالبة ( −Se2− ،S2 ، و −Te2).
إن مركبات الكبريت المهمة فهي SO2 و H2S ، SO3. ويعتبر أهم مركب للكبريت على النطاق التجاري هو حمض الكبريتيك و يتكون عندما يتفاعل ثالث أكسيد الكبريت مع الماء:
SO3(g) + H2O(l) → H2SO4(aq)
عناصر المجموعة 7A ، المجموعة السابعة (ns2np5, n ≥ 2)
Group 7A Elements (ns2np5, n ≥ 2)
- جميع الهالوجينات لافلزات و لها صيغة عامة X2 ، حيث تشير X إلى عنصر الهالوجين.
- نظرا لشدة فاعلية الهالوجينات فإنها لا توجد أبداً في حالتها العنصرية في الطبيعة.
- الفلور بالغ النشاط إلى درجة أنه يهاجم الماء مولداً الأكسجين.
2F2(g) + 2H2O(l) → 4HF(aq) + O2(g)
- للهالوجينات طاقات تأين عالية، وألفة إلكترونية موجبة كبيرة.
- تعرف الأيونات السالبـة المشــــتقة من الهالوجيـنات (−F−, Cl , و − Br , و − I) بالهاليدات، وهي آيزوإلكترونية مع الغازات النبيلة الواقعة إلى يمينها مباشرة في الجدول الدوري.
- تتفاعل الهالوجينات مع الهيدروجين لتكون هاليدات الهيدروجين:
- تذوب هاليدات الهيدروجين بيخ الماء لتعطي الحموض الهيدروهاليكيه، فحمض هيدروفلوريك (HF) هو حمض ضعيف (أي إلكتروليت ضعيف)، لكن حموض الهيدروهاليك الأخرى (HCl ، HBr ، HI) جميعها حموضا قوية (إلكتروليتات قوية).
عناصر المجموعة 8A ، المجموعة الثامنة (ns2np6, n ≥ 2)
- جميع الغازات النبيلة أحادية الذرّة.
الأفلاك الفرعية ns ، و np لذراتها ممتلئة تماماً، ما يمنحها ثباتاً عالياً (للهيليوم 1s2 ). - طاقات التأين للمجموعة 8A من الأكثر ارتفاعاً بين العناصر كافة، ولا تميل هذه
- الغازات لاكتساب إلكترونات إضافية.
- لقد عُرفت هذه العناصر سنين طويلة بالغازات الخاملة، وكان ذلك حقاً و لكن الآن تم تحضير عدد من مركبات الزنون (XeF4, XeO3, XeO4, XeOF4) ومركبات الكربتون ( KrF2 ، مثلا).
مقارنة بين عناصر المجموعتين 1A و 1B .
Comparison of Group 1A and Group 1B Elements
- على الرغم من أن الفلزات في هاتين المجموعتين لها توزيعات إلكترونية خارجية متشابهة حيث وجود إلكترون واحد في الفلك الأبعد s ، إلا أن خصائصها الكيميائية مختلفة تمامًا.
- إن طاقات التأين الأولى للنحاس و الفضة و الذهب أكبر من طاقات التأين للفلزات القلوية ، وبالتالي ، فإن عناصر المجموعة 1B أقل تفاعلًا.
- تنتج طاقات التأين الأعلى لعناصر المجموعة 1B نتيجة للحجب غير الكامل للنواة بواسطة الإلكترونات d الداخلية ، وبالتالي فإن الإلكترونات الخارجية لهذه العناصر تنجذب بقوة أكبر بواسطة النواة.
- النحاس والفضة والذهب غير متفاعلة لدرجة أنها توجد عادة في حالة حرة في الطبيعة.
- إن خمول وندرة معادن النحاس والفضة والذهب تجعلها ذات قيمة في صناعة العملات المعدنية والمجوهرات ، لذلك يطلق عليها اسم “معادن صك العملات المعدنية”.
خصائص الأكاسيد ضمن الدورة Properties of Oxides Across a Period
- تشكل بعض العناصر في الدورة الثالثة (P و S و Cl) عدة أنواع من الأكاسيد.
- إن ميل الأكسجين إلى تكوين أيون الأكسيد يكون مفضلا عندما يتحد الأكسجين مع الفلزات ذات طاقات التأين المنخفضة ، أي تلك الموجودة في المجموعتين 1A و 2A ، بالإضافة إلى الألومنيوم.
- Na2O و MgO و Al2O3 هي مركبات أيونية ، كما يتضح من درجات الانصهار العالية و درجات الغليان، كما أن لها بُنيات ثلاثية الأبعاد واسعة النطاق.
- مع زيادة طاقات التأين للعناصر من اليسار إلى اليمين في الدورة ، تزداد كذلك الطبيعة الجزيئية للأكاسيد التي تتشكل.
- السيليكون هو فلز، لذلك يحتوي أكسيده (SiO2) أيضًا على شبكة ضخمة ثلاثية الأبعاد ، على الرغم من عدم وجود أيونات.
- أكاسيد الفوسفور والكبريت والكلور هي مركبات جزيئية تتكون من وحدات صغيرة منفصلة ، وبسبب عوامل الجذب الضعيفة بين هذه الجزيئات ، فإن لها درجات انصهار و درجات غليان منخفضة.
- يمكن تصنيف معظم الأكاسيد على أنها حمضية أو قاعدية اعتمادًا على ما إذا كانت تنتج أحماض أو قواعد عند إذابتها في الماء وبعض الأكاسيد مترددة (أمفوتيرية)، مما يعني أنها تظهر الخصائص الحمضية و القاعدية.
- إن أول أكسيدين من الدورة الثالثة ، Na2O و MgO، هما قاعديان. فمثلا يتفاعل Na2O مع الماء لتكوين القاعدة هيدروكسيد الصوديوم:
Na2O(s) + H2O(l) → 2NaOH(aq)
- أما أكسيد المغنيسيوم فهو غير قابل للتفاعل في الماء ، و لكن يتفاعل مع الحموض بأسلوب يشابه تفاعلات الحمض القاعدة:
MgO(s) + 2HCl(aq) → MgCl2(aq) + H2O(l)
- أكسيد الألومنيوم هو أكسيد متردد (أكسيد أمفوتيري)، فهو أيضا لا يتفاعل مع الماء و لكنه يظهر خصائص قاعدية عندما يتفاعل مع الحموض
Al2O3(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2O(l)
وأيضا خصائص حمضية عندما يتفاعل مع القواعد
Al2O3(s) + 2NaOH(aq) + 3H2O(l) → 2NaAl(OH)4(aq)
- من الأكاسيد المترددة أيضا أكسيد الخارصين ZnO وأكسيد البيرليوم BeO و أكسيد البزموث Bi2O3.
- ثاني أكسيد السيليكون SiO2 غير قابل للذوبان في ولا يتفاعل مع الماء و ذو خصائص حمضية و يمكن له أن يتفاعل مع القواعد المركزة:
SiO2(s) + 2NaOH(aq) → Na2SiO3(aq) + H2O(l)
- لا ينبغي تخزين المحاليل المائية المركزة مثل محلول هيدروكسيد الصوديوم المائي في الأواني الزجاجية من نوع Pyrex المصنوعة من SiO2.
- أكاسيد الدورة الثالثة المتبقية حمضية، فهي تتفاعل مع الماء لتكوين حامض الفوسفوريك (H3PO4) وحمض الكبريتيك (H2SO4) وحمض فوق الكلوريك (HClO4):
P4O10(s) + 6H2O(l) → 4H3PO4(aq)
SO3(g) + H2O(l) → H2SO4(aq)
Cl2O7(l) + H2O(l) → 2HClO4(aq)
- كلما قلت الخاصية الفلزية في الدورة من اليسار إلى اليمين فإن الخصائص الأكسيدية تتغير من قاعدية إلى مترددة ثم إلى حمضية.
- الأكاسيد الفلزية في الأغلب قاعدية و أغلب الأكاسيد اللافلزية حمضية.








بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرو في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :