ملاحظة هامة: هذا المقال عبارة عن مختصر للفصل الحادي عشر من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
1 – تصنيف و تركيب الأمينات Classification and Structure of Amines
- الأمينات هي مركبات قاعدية عضوية مشتقة من الأمونيا.
- تصنف الأمينات إلى أمينات أولية حيث يكون فيها مجموعة عضوية واحدة متصلة بذرة الهيدروجين، و أمينات ثانوية حيث مجموعتين متصلتين بذرة النيتروجين و أمينات ثالثية حيث ثلاث مجموعات متصلة بذرة النيتروجين.
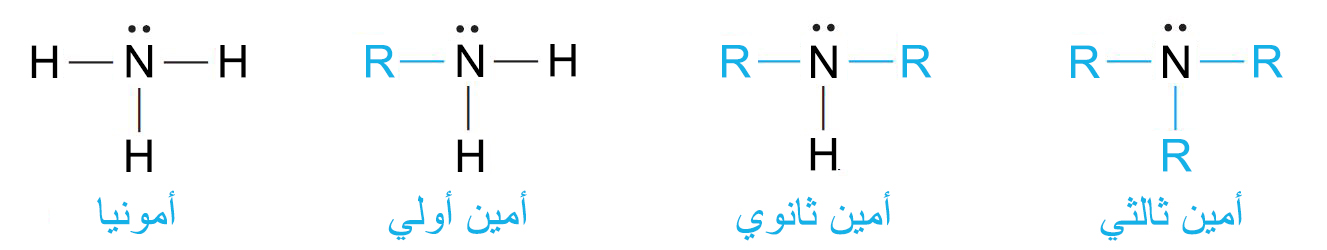
- إن ذرة النيتروجين في الأمينات ثلاثية التكافؤ و تحمل زوجا من الإلكترونات غير الرابطة.
- إن التهجين الحاصل في أفلاك ذرة النيتروجين من نوع sp3، و بالتالي يكون الشكل الهندسي هرمي.
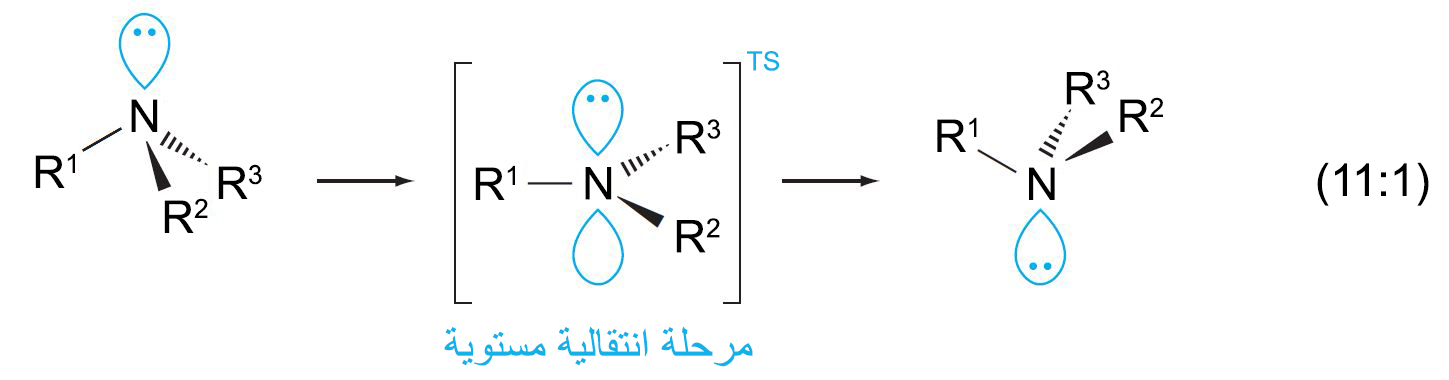
2 – تسمية الأمينات Nomenclature of Amines
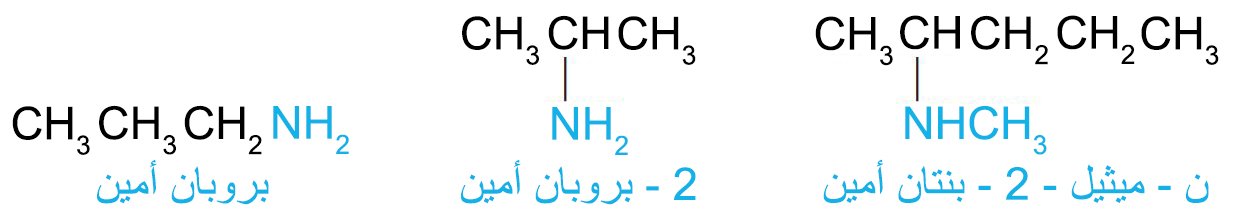
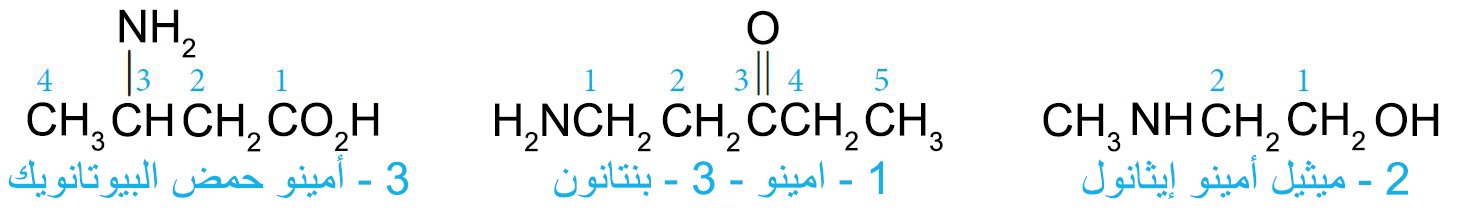
- تتم تسمية الأمينات البسيطة عن طريق تحديد مجموعات الألكيل المرتبطة بالنيتروجين وإضافة اللاحقة -أمين.

- في نظام الأيوباك ، يتم تسمية المجموعة الأمينية ، NH2 – ، كمجموعة بديلة.

- في هذا النظام ، تتم تسمية الأمينات الثانوية أو الثلاثية باستخدام بادئة تتضمن كل سلسلة الكربون ما عدا أطول سلسلة ،
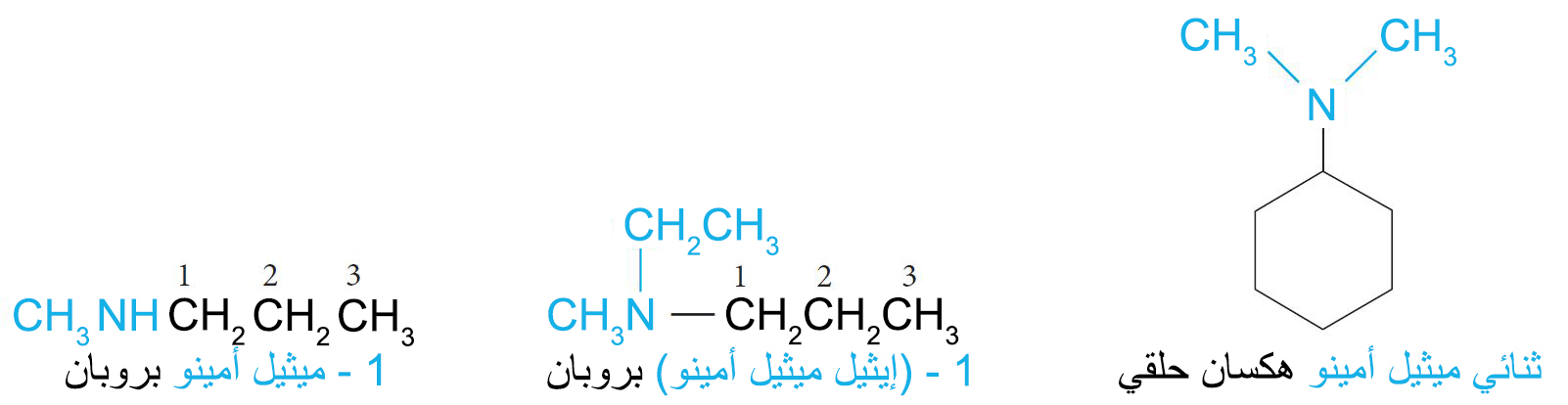
- في نظام المستخلصات الكيميائية (CA)، يستم تسمية الأمينات على صورة أمينات ألكانية، مثال:
- عندما توجد مجموعات وظيفية أخرى في المركب فإن مجموعة الأمين يتعامل معها كمجموعة بديلة.
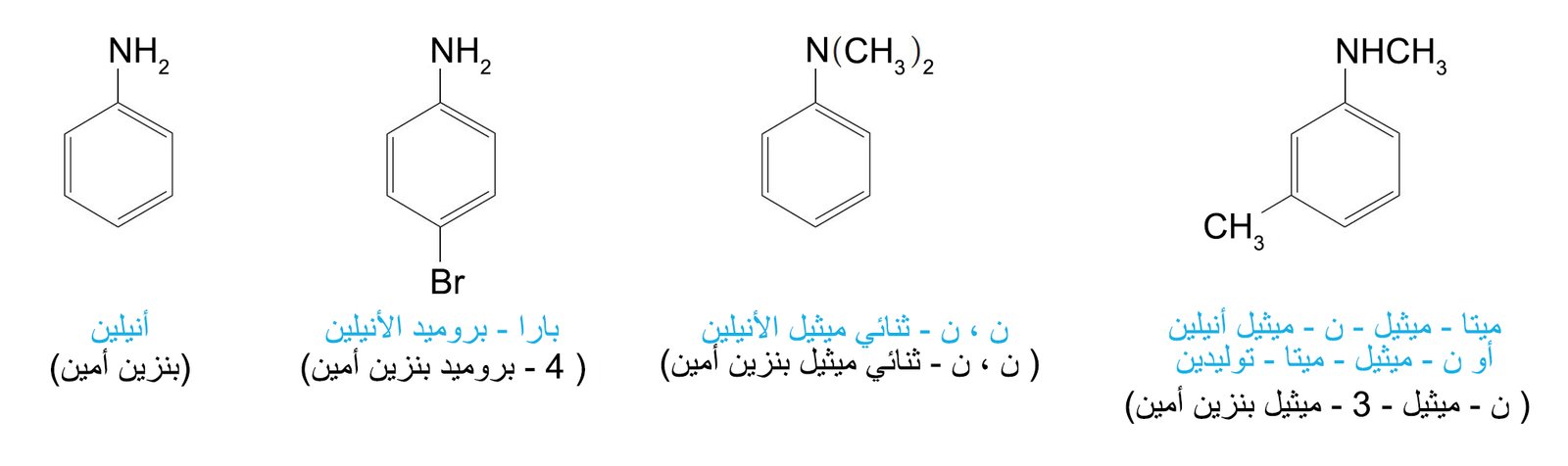
- تسمى الأمينات العطرية لمشتقات للأنيلين. أما في نظام المستخلصات الكيميائية فإن الأنيلين يسمى بنزين أمين، و هذه الأسماء مكتوبة بين القوسين.
3 – الخواص الفيزيائية و القوى بين الجزيئية للأمينات Physical Properties and Intermolecular Interactions of Amines
- ميثيل أمين و إيثيل امين غازات.
- الأمينات الأولية مع ثلاثة ذرات كربون أو أكثر هي السوائل.
- درجة غليان الأمينات الأولية أعلى بكثير من الألكانات المقابلة لها بالوزن الجزيئي ، ولكنها أقل من الكحولات المقابلة لها بالوزن الجزيئي.
- تعد القوى الربط الجزيئية N ‒ H · · N مهمة و تعمل على رقع درجات الغليان للأمينات الأولية والثانوية ولكنها ليست قوية مثل روابط O ‒ H · · O بالنسبة للكحولات. والسبب في ذلك هو أن النيتروجين ليس كهروسالبيا مثل الأكسجين.
- يمكن لأنواع الأمينات الثلاث أن تشكل روابط هيدروجينية مع مجموعة OH- من الماء ، وبالتالي ، فإن معظم الأمينات البسيطة التي تحتوي على ما يصل إلى 5 أو 6 ذرات كربون إما قابلة للذوبان في الماء بشكل كامل أو جيد.
4 – تحضير الأمينات؛ ألكلة الأمونيا و الأمينات Preparation of Amines; Alkylation of Ammonia and Amines
- تتفاعل الأمونيا مع هاليدات الألكيل لإنتاج الأميدات عن طريق عملية من خطوتين. الخطوة الاولى تشمل استبدال نيوكيوفيلي من نوع SN2 .
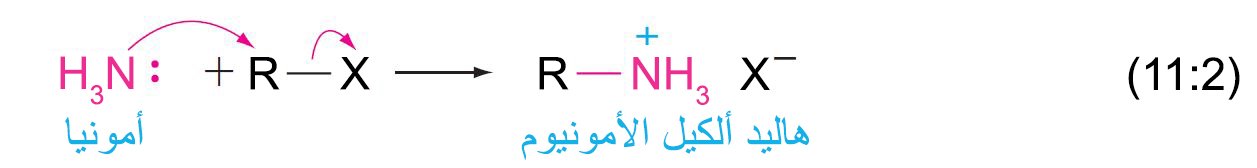
- يمكن بعد ذلك الحصول على الأمين الحر من ملحه عن طريق المعالجة بقاعدة قوية.

- كما يمكن ألكلة الأمينات الأولية و الثانوية و الثالثية بالمثل.
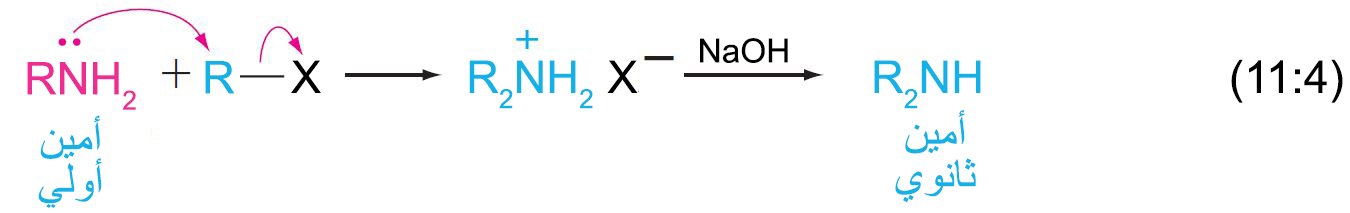


- غالبًا ما يتم الحصول على خليط من المنتجات في هذه التفاعلات لأن المادة البادئة للتفاعل سواء كانت أمونيا أو الأمين وأيون ألكيل الأمونيوم التي تكونت في خطوة SN2 يمكن أن تصبح في حالة اتزان ،

- عند تفاعل الأمونيا مع هاليد الألكيل ، يتم انتاج بعضا من الأمينات الأولية و الذي يمكن لاحقا ألكلته لإنتاج أمين ثانوي ، ومن خلال ضبط نسبة المواد المتفاعلة، يمكن الحصول على عائد جيد من الأمين المرغوب به.
- يمكن أن تكون الأمينات العطرية غالبًا انتقائية.

- كما يمكن أن تكون الألكلة ضمن الجزيء نفسه كما هو الحال في الخطوة النهائية في عملية تصنيع النيكوتين في المختبر.

5 – تحضير الأمينات؛ اختزال مركبات النيتروجين Preparation of Amines; Reduction of Nitrogen Compounds
- المركبات العضوية التي توجد فيها ذرة النيتروجين بأكثر من حالة تاكسد
- يمكن أن تختزل إلى أمينات بوجود عوامل اختزال مناسبة.
يمكن للأمينات الأولية العطرية أن تختزل إلى مركبات نيترو المقابلة لها.
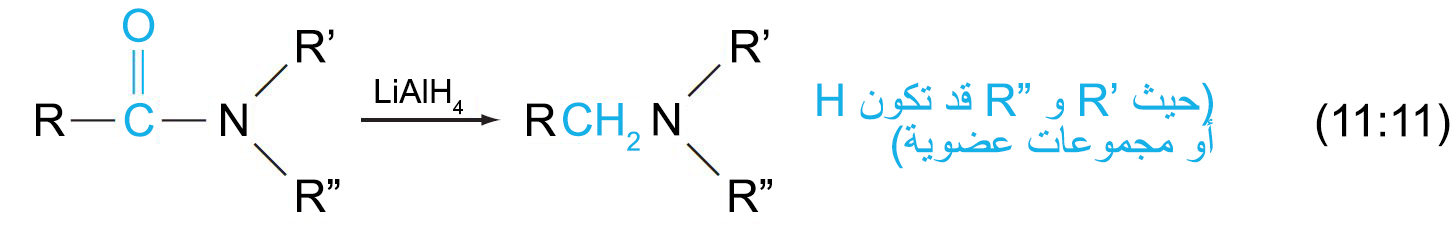
- يمكن للأميدات أن تختزل إلى أمينات عن طريق هيدريد الليثيوم الألومنيوم.
- اختزال النيتريلات (السيانيدات) يمكن أن ينتج الأمينات الأولية

- يمكن للألدهيدات أو الكيتونات أن تخضغ للأمنمة الاختزالية reductive amination عند معالجتها مع الأمونيا أو الأمينات الأولية أو الثانوية في وجود لإنتاج الأمينات الأولية أو الثانوية أو الثالثية على الترتيب.

6 – قاعدية الأمينات The Basicity of Amines
- بسبب وجود زوجا من الإلكترونات غير الرابطة على ذرة النيتروجين ، فإن الأمينات تعتبر قاعدية و نيوكليوفيلية في نفس الوقت.
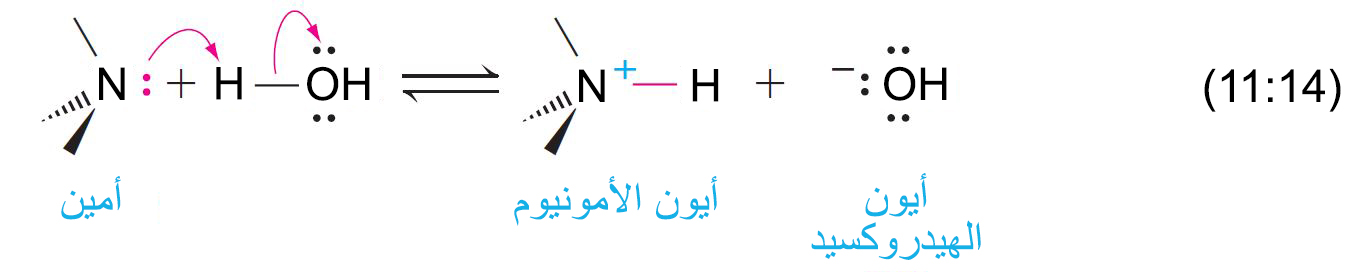
- يرتبط الأمين مع أيون الامونيوم الخاص به كقاعدة و حمضها المرافق.
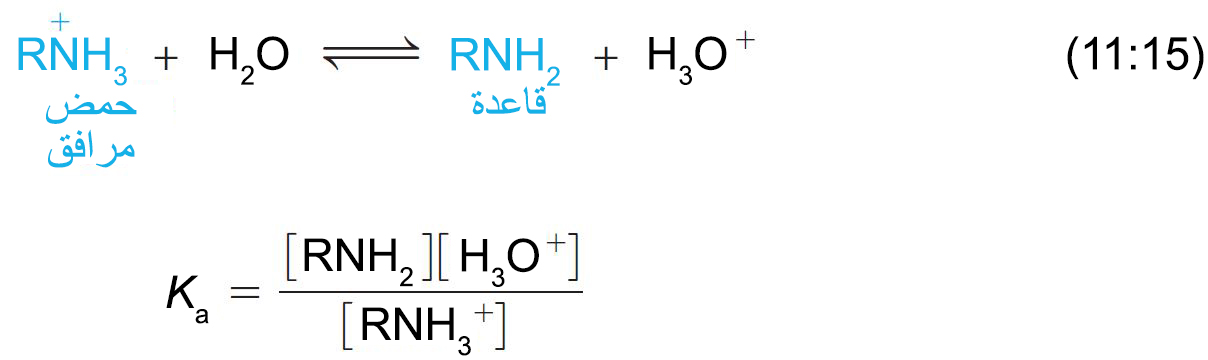
- كلما كانت قيمة Ka أكبر ( أو قيمة pKa أصغر) تزداد قوة RN+H3 كحمض. أو تقل قيمة RNH2 كقاعدة.
- إن المجموعات المانحة للإلكترونات تزيد من قاعدية الأمينات و المجموعات الجاذبة للإلكترونات تقلل من قاعديتها.
- الأمينات العطرية قواعد أضعف بكثير من الأمينات العطرية أو الأمونيا.

- يرجع السبب وراء ذلك الاختلاف الهائل في القاعدية إلى التنقل الرنيني لزوج الإلكترونات غير الرابطة و الذي ممكن حدوثه في الأنيلين، و لكن ذلك الأمر لايحدث في الهكسان الحلقي (لعدم وجود روابط ثنائية في حلقة الهكسان).

7 – مقارنة بين قاعدية و حمضية الأمينات و الأميدات Comparision of the Basicity and Acidity of Amines and Amides
- المحاليل المائية للأمينات قاعدية بينما المحاليل المائية للأميدات في الأساسا متعادلة، لأن في الأمين يكون زوج الإلكترونات غير الرابطة على الأغلب متمركز فوق ذرة النيتروجين بينما في حالة الأميدات ينتقل زوج الإلكترونات غير الرابطة إلى ذرة الأكسجين في مجموعة الكربونيل.
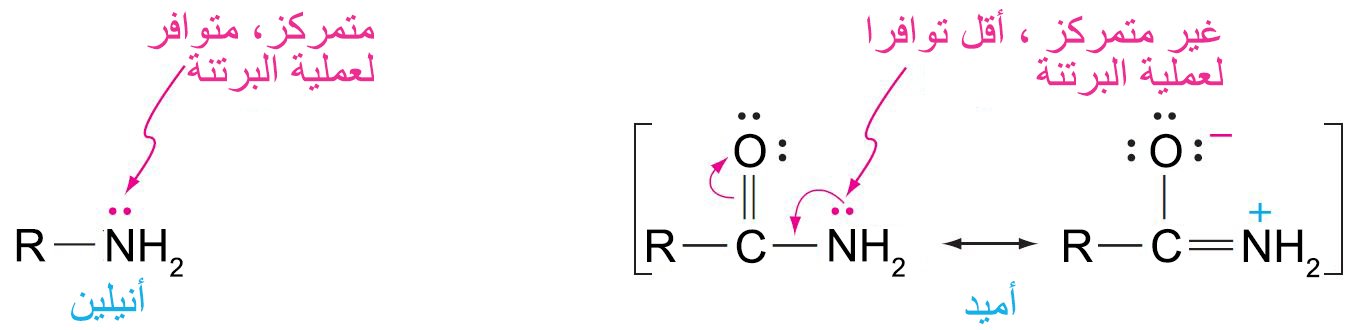

- الأمينات الأولية هي حموضا ضعيفة للغاية ، أضعف بكثير من الكحول. والسبب الرئيس لهذا الاختلاف هو أن كهروسالبية النيتروجين أقل بكثير من تلك للأكسجين وبالتالي لا يمكن استقرار الشحنة السالبة تقريبًا.
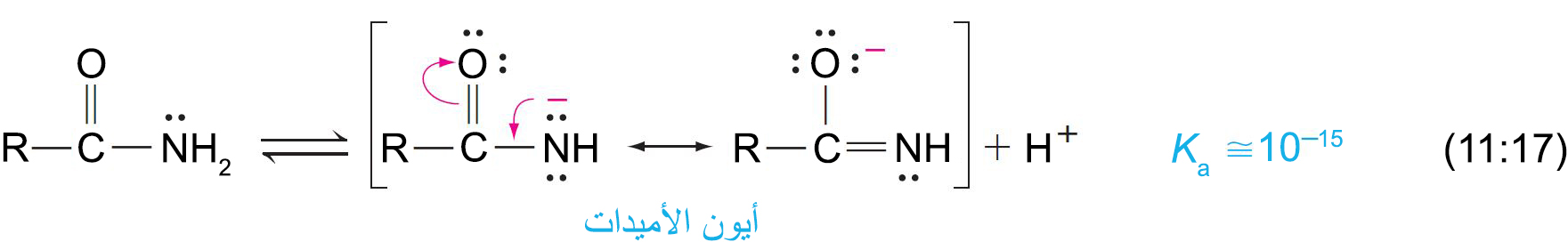
أما الأميدات فهي حموضا أقوى بكثير من الأمينات لأن الشحنة السالبة لأنيون الأميدات يمكن أن تتنقل عن طريق الرنين. - يتكون أنيون الأميدات عن طريق إزالة بروتون (+H) من نيتروجين الأميد.
8 – تفاعل الأمينات مع الحموض القوية؛ أملاح الأمين Reaction of Amines with Strong Acids; Amine salts
- تتفاعل الأمينات (ألكيلات الأمين) مع الحموض القوية و ينتج عن ذلك أملاح ألكيل الأمونيوم.

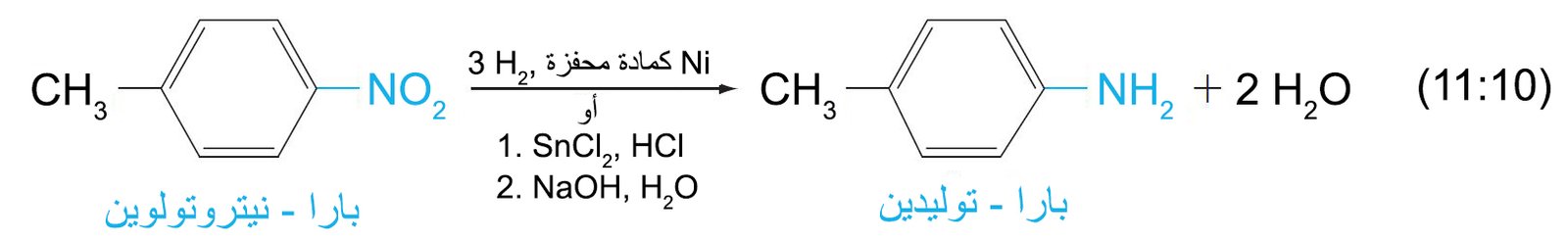
- يستخدم هذا النوع من التفاعلات لفصل أو استخراج الأمينات من المواد المتعادلة أو الحمضية غير القابلة للذوبان في الماء. على سبيل المثال ، يمكن فصل خليط من الباراتوليدين و البارانيتروتوليدين ، حيث يمكن فصل الأمين عن مركب النيترو عير المختزل بواسطة المخطط التالي:

9 – الأمينات الكيرالية كعوامل للفصل Chiral Amines as Resolving Agents
- يمكن للأمينات أن تشكل الأملاح مع الحموض العضوية. و يمكن أن يستخدم هذا التفاعل لفصل الحموض المتمارئة. كما هو الحال عن فصل حموض اللاكتيك اليمينية و اليسارية عن بعضها البعض باستخدام (يساري) – 1 – فينيل إيثيل أمين.

- الأملاح دياستيرية (لامتمارئة) و يمكن أن يتم فصلها بالطرق الاعتيادية مث الالتبلور التجزيئي ، و يمكن لاحقا لكل ملح أن يتفاعل مع حمض قوي مثل HCl لتحرير متماريء واحد من حمض اللاكتيك.

10 – أسيلة الأمينات مع مشتقات الحمض Acylation of Amines with Acid Derivatives
- حيث أن الأمينات تعتبر تيوكليوفيلات نيتروجينية، فإنها تتفاعل مع مجموعة الكربونيل في مشتقات الحموض الكربوكسيلية عن طريق الاستبدال الأسيلي النيوكليوفيلي.
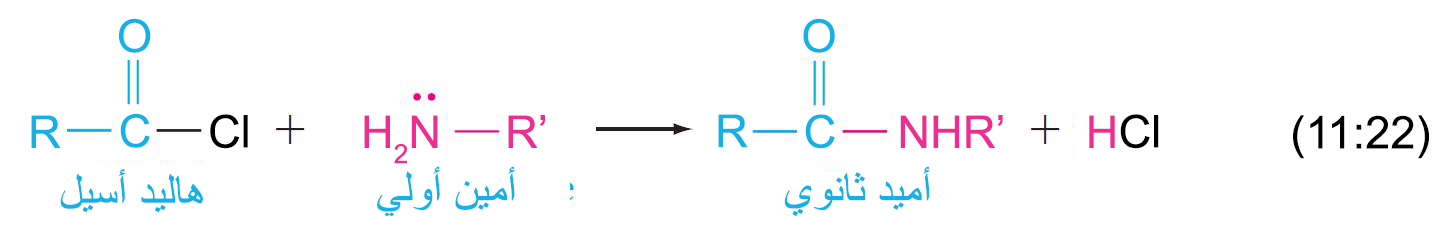
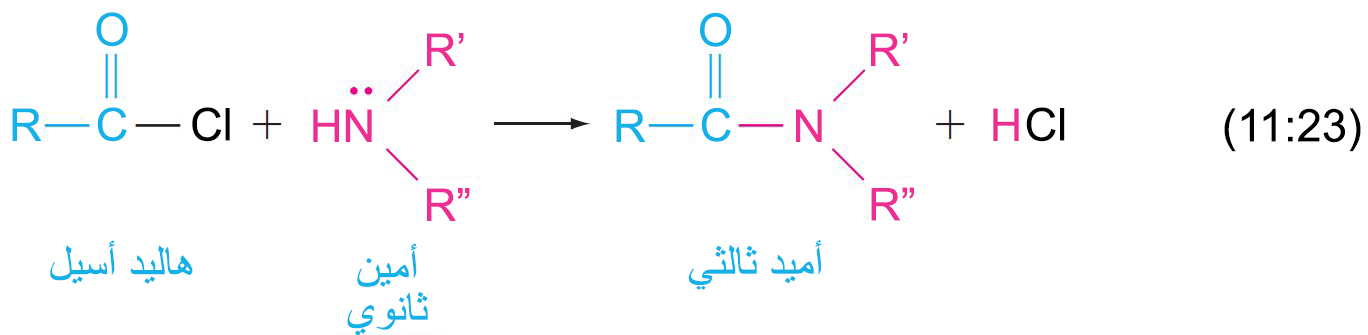
- و عادة ما يتم استغلال فكرة أسيلة الامينات من الناحية العملية. فمثلا طارد الحشرات أووف (OFF) هو أميد نتج عن تفاعل ميتا-تولويل الكلوريد و ثنائي إيثيل الأمين.

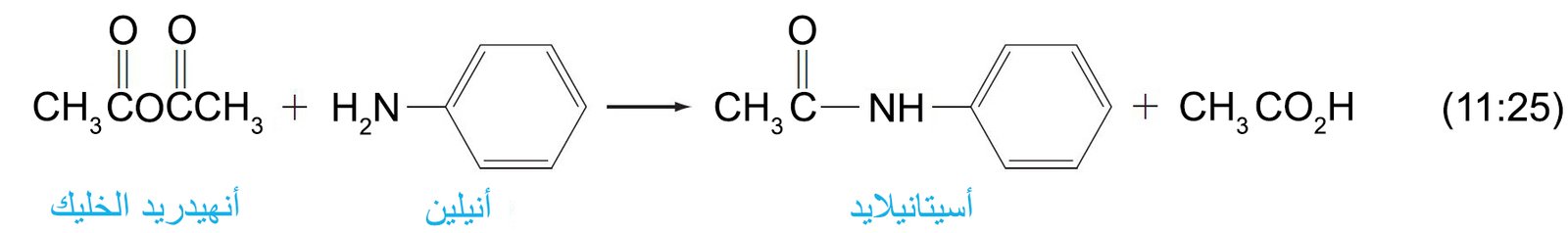
- كما يمكن تصنيع المادة الأميدية المخفضة للحرارة الأسيتانيليد من الأنيلين و أنهيدريد الخليك.
11 – مركبات الأمونيوم الرباعية Quaternary Ammonium Compounds
- عندما تتفاعل الأمينات الثالثية مع هاليدات الألكيل الأوليو أو الثانوية عن طريق ميكانيكية SN2 فإن الناتج يكون أملاح أمونيوم رباعية بحيث تستبدل جميع ذرات الهيدروجين في أيون الأمونيوم بمجموعات عضوية.

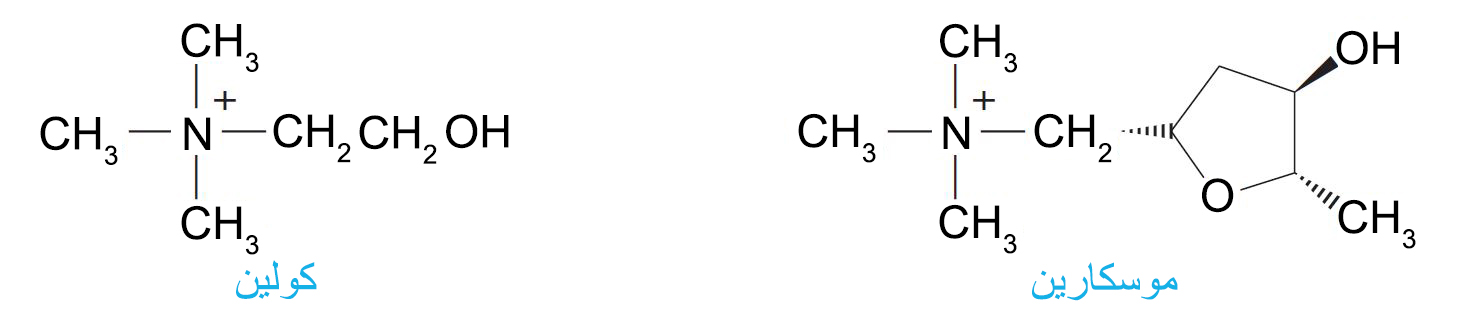
- يعتبر الأيونان الكولين و الأسيتيل كولين من أيونات الأمونيوم الرباعية الهامة في العمليات الحيوية.
12 – مركبات الديازونيوم (ثنائية النيتروجين) العطرية Aromatic Diazonium Compounds
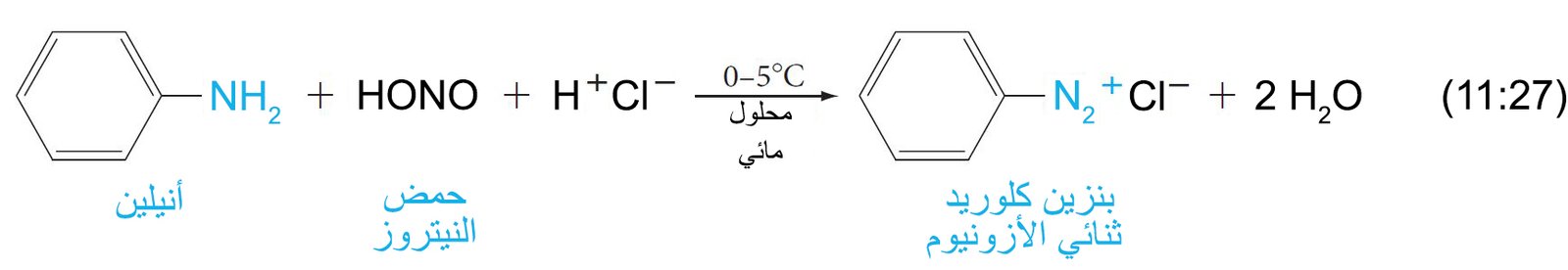
- تتفاعل الأمينات العطرية الأولية مع حمض النيتروز عند درجة حرارة صفر سيليزية و ينتج عن ذلك تكون أيونات الديازونيوم الأريلية، في عملية تعرف باسم الديزنة.
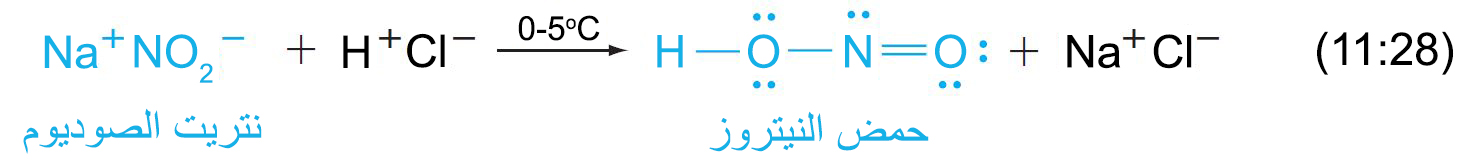
- نستطيع تحضير حمض النيتروز كلما لزمت الحاجة لأنه يتفكك بسرعة عند درجة حرارة الغرفة كما يلي:
- الدقائق النشطة في تفاعلات حمض النيتروز هي أيون النيتروزونيوم (+NO) و يمكن تحضيرها كما يلي:
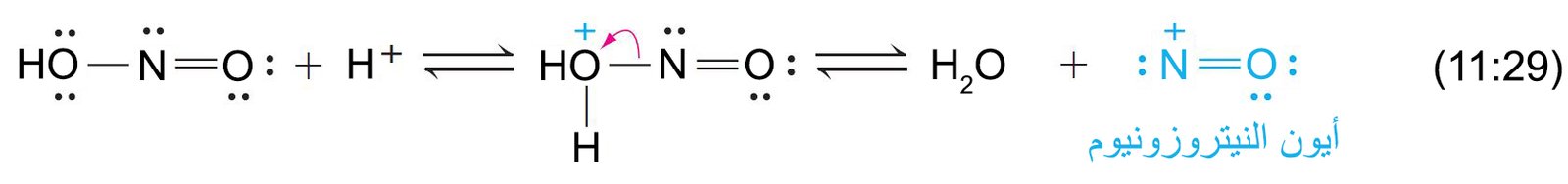
- ميكانيكية تفاعل الأمينات العطرية الأولية مع حمض النيتروز كما يلي:

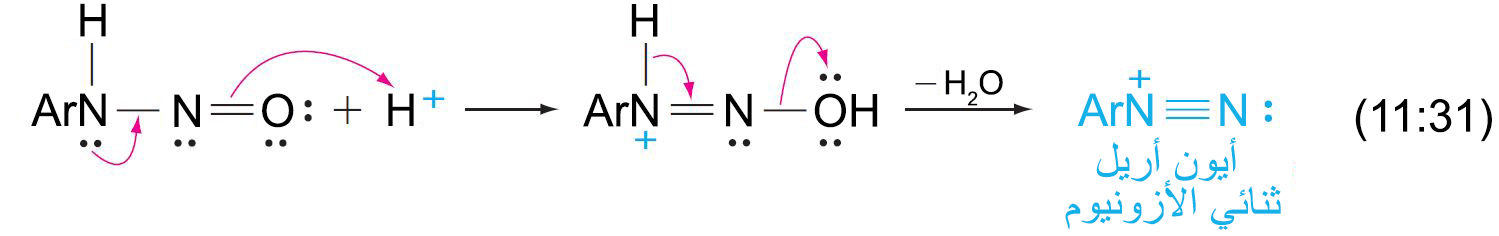

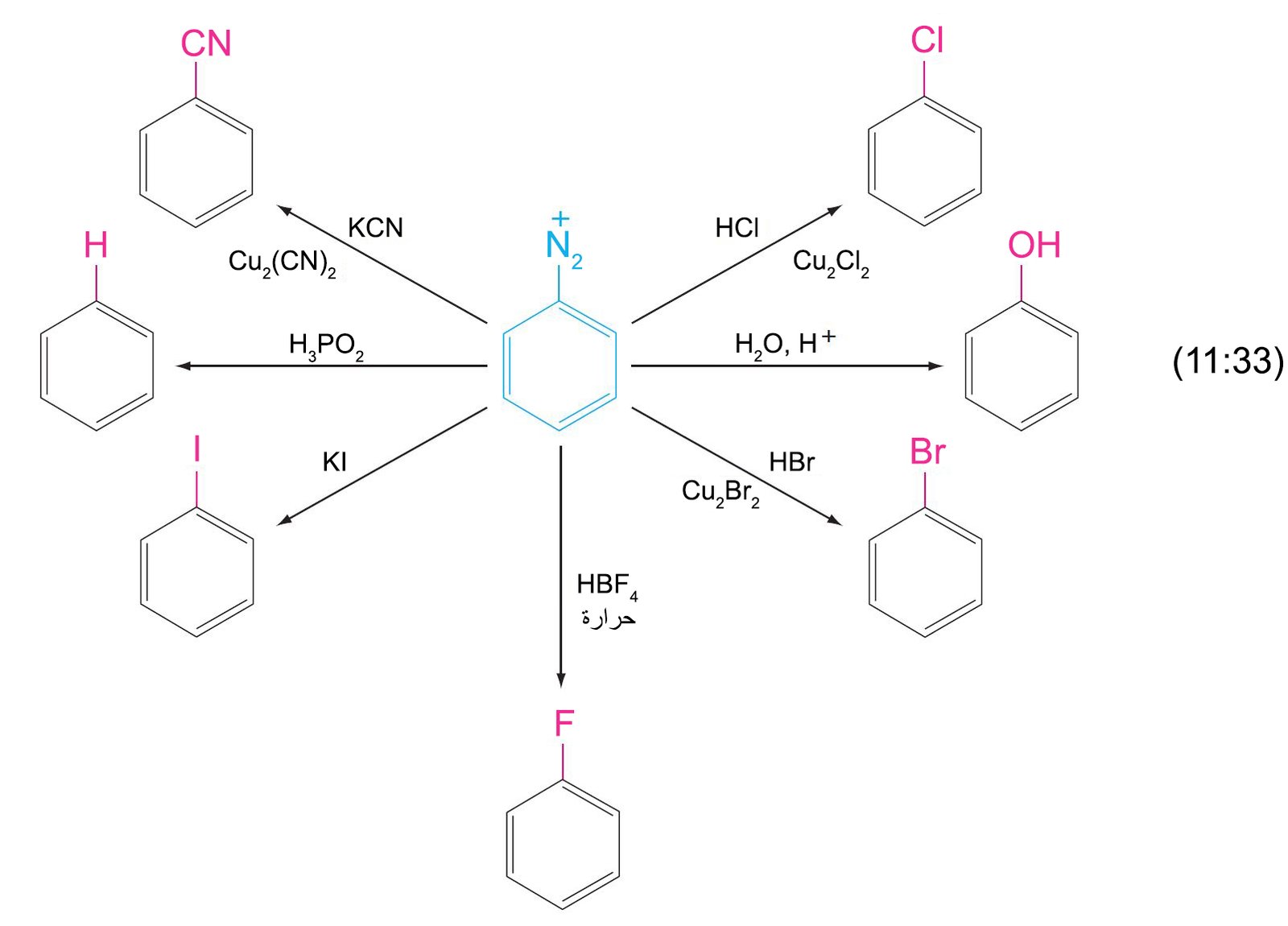
- تحويل مركبات الديازونيوم إلى كلوريدات أو بروميدات أو سيانيدات الأريل يتم من خلال استخدام أملاح النحاس I (أملاح النحاسوز) في تفاعل يعرف باسم تفاعل ساندماير Sandmeyer reaction .
13 – إزدواج الديازو؛ أصباغ الآزو Diazo Coupling; Azo Dyes
- أيونات أريل الديازونيوم هي إلكتروفيلات ضعيفة بسبب كون أن الشحنة الموجبة يمكن لها أن تنتقل من مكانها خلال الرنين.
- تتفاعل أيونات أريل الديازونيوم مع الحلقات العطرية القوية النشطة (الفينولات و الأمينات العطرية) لانتاج مركبات الآزو.
- تحتوي مركبات الآزو على مجموعة -N=N- .
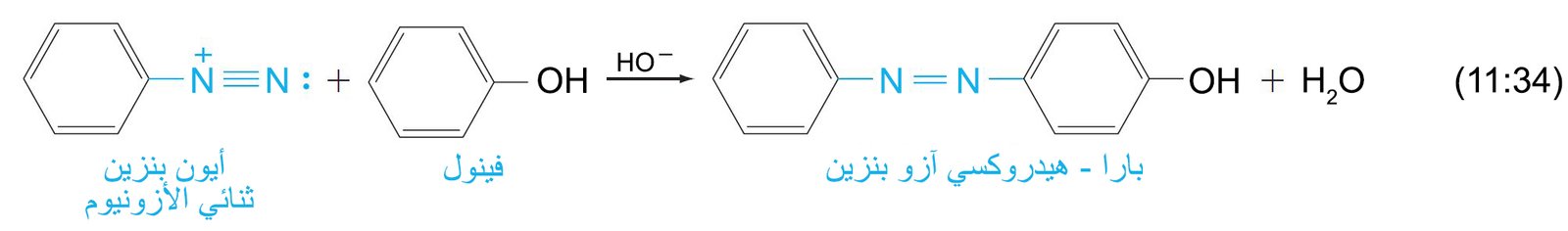
- إن ازدواج الديازو هو تفاعل استبدال عطري إلكتروفيلي بحيث يحدث فيه تفاعل الفينولات و الأمينات العطرية مع ألكتروفيلات أرسل الديازونيوم لإنتاج مركبات الآزو .
- جميع مركبات الآزو ملوّنة ، ويستخدم الكثير منها تجاريا كأصباغ للملابس وفي التصوير الفوتوغرافي الملون (القائم على الأفلام الفوتوغرافية).
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة