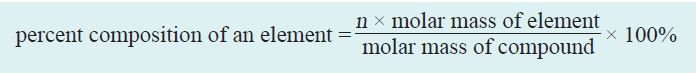ملخص الفصل الثالث من كتاب الكيمياء -تشانج و أوفربي Chapter 3 Notes CHEMISTRY Chang & Overby
Posted in :
ملخص الفصل الثالث من كتاب الكيمياء -تشانج (شانج) و أوفربي Chapter 3 Notes CHEMISTRY Chang & Overby
ملخص الفصل الرابع من هذا الكتاب تجده في الرابط الآتي:ملخص الفصل الرابع من كتاب الكيمياء – ريموند تشانج (شانج) و جاسون أوفربي Chapter 4 Notes CHEMISTRY Chang & Overby
ملاحظة: للحصول على ملخص للفصل الثامن من هذا الكتاب يرجى الضغط على الرابط الآتي: ملخص الفصل الثامن من كتاب الكيمياء -تشانج و أوفربي Chapter 3 Notes CHEMISTRY Chang & Overby
ملخص الفصل التاسع من هذا الكتاب تجده في الرابط الآتي: ملخص الفصل التاسع من كتاب الكيمياء -تشانج (شانج) و أوفربي Chapter 9 Notes CHEMISTRY Chang & Overby
ملخص الفصل العاشر من هذا الكتاب تجده في الرابط الآتي: ملخص الفصل العاشر من كتاب الكيمياء – ريموند تشانج (شانج) و جاسون أوفربي Chapter 10 Notes CHEMISTRY Chang & Overby
Mass Relationships in Chemical Reactions
ملخص الفصل الثالث من كتاب الكيمياء -تشانج و أوفربي: علاقات الكتلة في التفاعلات الكيميائية
لتحميل نسخة كاملة بصيغة pdf يرجى الضغط على هذا الرابط: ملخص الفصل الثالث من كتاب الكيمياء شانج للأستاذ أكرم أمير العلي
1.3 الكتلة الذرية Atomic Mass
- تعتمد كتلة الذرة على عدد الإلكترونات والبروتونات والنيوترونات التي تحتوي عليها.
- لا يمكننا وزن ذرة واحدة ، ولكن من الممكن تحديد كتلة ذرة ما بالنسبة إلى أخرى تجريبياً.
- الكتلة الذرية هي كتلة الذرة بوحدات الكتلة الذرية (و.ك.ذ).
- تُعرَّف وحدة الكتلة الذرية بأنها الكتلة التي تساوي بالضبط واحدًا على اثني عشر من كتلة ذرة كربون -12 واحدة.
- من الضروري وجود مثل هذه الوحدة لأنها تمثل معيارا لقياس الكتلة الذرية لباقي العناصر.
- الكربون 12 هو نظيرللكربون والذي يحتوي على ستة بروتونات وستة نيوترونات.
متوسط الكتلة الذرية
- لمعظم العناصر التي توجد بشكل طبيعي أكثر من نظير واحد.
- هذا يعني أنه عندما نحسب الكتلة الذرية لعنصر ما ، يجب أن نستقر عمومًا على متوسط كتل نظائر العنصر التي توجد بشكل طبيعي.
2.3 عدد أفوجادرو و الكتلة المولية للعنصر Avogadro’s Number and the Molar Mass of an Element
- المول هي وحدة تصف العدد الهائل للذرات.
- يعرف المول بأنه كمية المادة التي تحتوي على العديد من الكينونات الأولية (ذرات أو جزيئات أو جسيمات أخرى) و التي تساوي عدد الذرات في 12 جرام بالضبط (أو 0.012 كجم) من نظير الكربون 12.
- لقد تم تحديد العدد الفعلي للذرات في 12 جرامًا من الكربون -12 بشكل تجريبي ويسمى هذا العدد بعدد أفوجادرو (NA) ويساوي:
NA = 6.0221413 × 1023
- كتلة المول الواحد لذرات الكربون – 12 تساوي بالضبط 12 جرام و تحتوي على عدد أفوجادرو من ذرات الكربون.
- تسمى كتلة الكربون – 12 بالكتلة المولية (M) وتعرف بأنها الكتلة (بالجرام أو الكيلوجرام)لمول واحد من الوحدات (مثل الذرات أو الجزيئات) من مادة ما.
- لاحظ هنا أن الكتلة المولية للكربون – 12 (بالجرام) تساوي عدديًا كتلتها الذرية بوحدة كتل ذرية.
- إذا علمنا الكتلة الذرية لعنصر ما ، فإننا سنعرف أيضًا كتلته المولية.
- فإذا علمنا أن كتلة المول الواحد لذرات الكربون- 12 تساوي 12 جراما ، أو بصيغة أخـرى إذا علمـا أن 1023 × 6.02 ذرة كربون – 12 تزن 12 جرما ، فإن وزن ذرة واحدة من الكربون يساوي 23_10 × 1.993 جرام.
3.3 الكتلة المولية Molar Mass
- الكتلة الجزيئية (تسمى أحيانًا الوزن الجزيئي) هي الكتلة (بوحدة كتل ذرية) لجزيء واحد.
- يتم تحديدها من خلال مجموع الكتل الذرية لكل ذرة في الجزيء.
4.3 مطياف الكتلة The Mass Spectrometer
- يستخدم مطياف الكتلة للتعيين الدقيق لكتل الذرات و الجزيئات.
- في مطياف الكتلة ، يتم قصف العينة الغازية بسيل من الإلكترونات عالية الطاقة التي تصطدم بإلكترونات الذرات لتنتج أيونات موجبة. و من ثم يتم تسريع هذه الأيونات الموجبة في مجال كهربائي قوي حيث تنحرف إلى مسارات دائرية بواسطة مغناطيس ضمن مسارات مختلفة اعتمادًا على نسبة الشحنة إلى الكتلة، وبناء على ذلك فإن الأيونات الثقيلة تنحرف بشكل أكبر من الأيونات الأخف ، و بذلك يمكن فصل الأيونات ذات الشحنات المتساوية ولكن كتلها مختلفة عن بعضها البعض و بالتالي يتم تحديد كتلة كل أيون بناء على حجم انحرافه. في النهاية تصل الأيونات إلى الكاشف ، الذي يسجل تيارًا لكل نوع من الأيونات. فكمية التيار المتولد تتناسب طرديًا مع عدد الأيونات، لذا فإن هذه التقنية تمكننا من تحديد الوفرة النسبية للنظائر.
- يقدم مطياف الكتلة دليلًا لا جدال فيه على وجود النظائر.
5.3 المكونات حسب النسب المئوية في المركبات Percent Composition of Compounds
- إن النسبة المئوية حسب الكتلة لمكونات المركب هي النسبة المئوية بالكتلة لكل عنصر في المركب.
- ورياضيا ، يتم التعبير عن النسبة المئوية للعنصر في مركب بالعلاقة الآتية
حيث n عدد مولات العنصر في مول واحد من المركب.
- من خلال معرفتنا بالنسبة المئوية حسب الكتلة لمكونات المركب ممكن أن نتوقع الصيغة التجريبية للمركب.
- في بعض الحالات ، من المهم معرفة الكتلة الفعلية لعنصر ما في كتلة معينة من المركب. على سبيل المثال، في صناعة التعدين ، ستخبر هذه المعلومات العلماء عن جودة الخام.
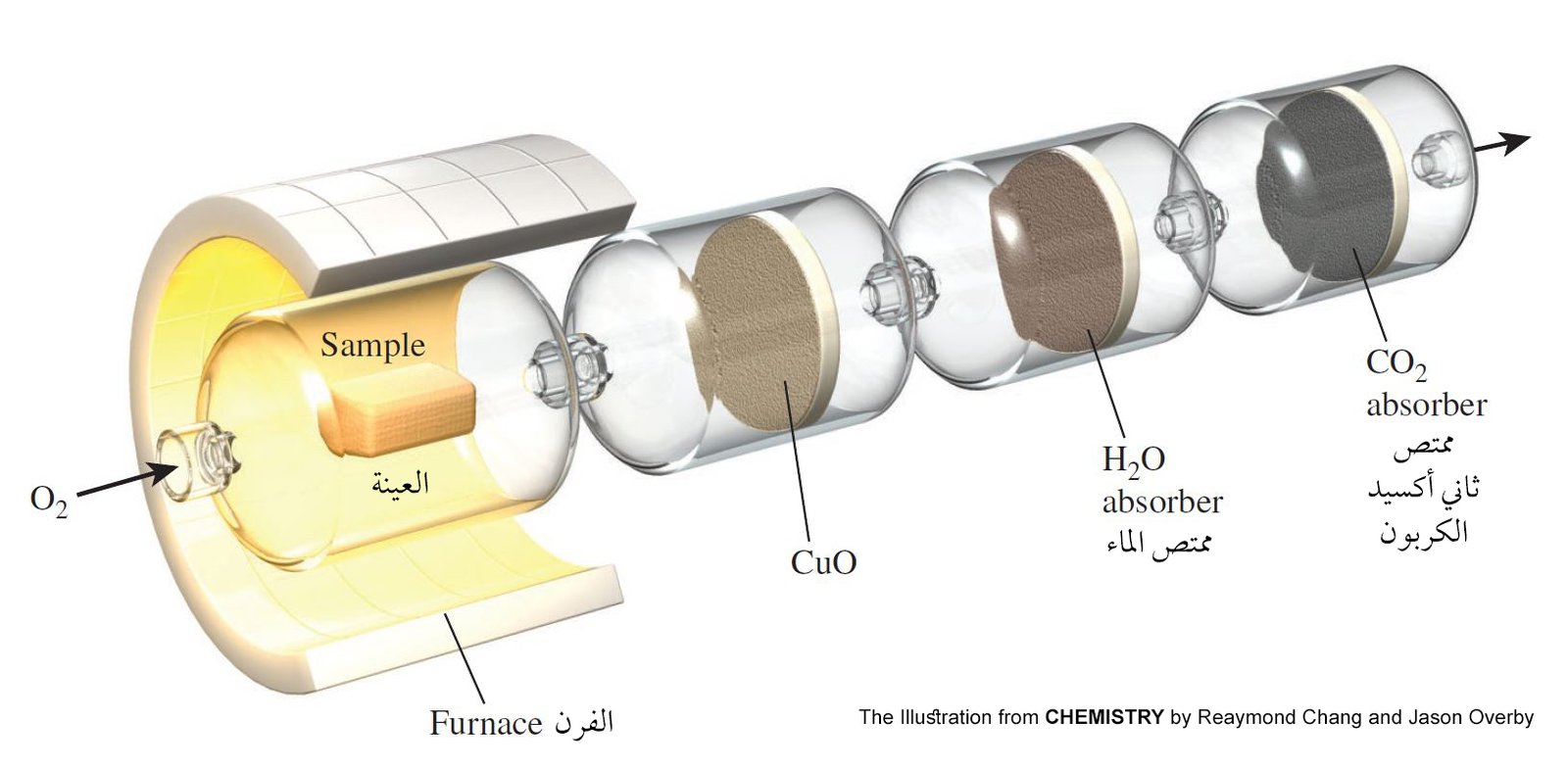
6.3 تعيين الصيغ التجريبية مخبريا Experimental Determination of
Empirical Formulas
- تعني كلمة «تجريبي» حرفيًا «استنادًا إلى الملاحظة والقياس فقط».
- على سبيل المثال عن طريق حرق عينة الإيثانول في جهاز كما هو موضح أدناه ، يمكننا تحديد الصيغة التجريبية للإيثانول (C2H6O).
تعيين الصيغ الجزيئية
- لحساب الصيغة الجزيئية الفعلية ، يجب أن نعرف الكتلة المولية التقريبية للمركب بالإضافة إلى صيغته التجريبية.
7.3 التفاعلات الكيميائية و المعادلات الكيميائية Chemical Reactions and Chemical Equations
- التفاعل الكيميائي هي عملية يتم فيها تغيير مادة (أو مواد) إلى مادة جديدة أو أكثر.
- تستخدم المعادلة الكيميائية الرموز الكيميائية لتوضيح ما يحدث أثناء التفاعل الكيميائي.
كتابة المعادلات الكيميائية
- يجب أن تكون المعادلات الكيميائية موززنة من أجل تحقيق قانون حفظ المادة ، الذي ينص على أنه في نظام مغلق لا تفنى المادة و لا تنشأ من العدم.
- يمكننا كتابة معادلة كيميائية لتفاعل غاز الهيدروجين (H2) مع الأكسجين (O2) لتكوين الماء (H2O) على النحو التالي.
- علامة «زائد» تعني «يتفاعل مع» والسهم يعني «ينتج».
- يمكن قراءة هذا التعبير الرمز كما يأتي: “يتفاعل جزيء الهيدروجين مع جزيء الأكسجين لإنتاج الماء.”
- من المفترض أن يبدأ التفاعل من اليسار إلى اليمين كما يشير السهم.
- المعادلة غير موزونة لأن هناك ذرتان من الأكسجين على الجانب الأيسر من السهم وذرة أكسجين واحدة على الجانب الأيمن.
- للتوافق مع قانون حفظ الكتلة ، يجب أن يكون هناك نفس العدد لكل نوع من الذرات على جانبي السهم.
2H2 + O2 → 2H2O
- يمكننا موازنة المعادلة بوضع المعامل المناسب (2 في هذه الحالة) أمام H2 و H2O:
- توضح هذه المعادلة الكيميائية الموزونة أن «جزيئين من الهيدروجين يمكن أن يتحدا أو يتفاعلا مع جزيء من الأكسجين واحد لتكوين جزيئين من الماء» .
- نشير إلى H2 و O2 في المعادلة أعلاه كمواد متفاعلة ، وهي المواد الأولية في تفاعل كيميائي.أما الماء فهو المنتج ، وهو مادة تكونت نتيجة للتفاعل الكيميائي.
موازنة المعادلات الكيميائية
- يمكن استخدام الخطوات الخمس التالية كدليل لموازنة معادلة كيميائية:
الخطوة 1: اكتب معادلة غير موزونة باستخدام الصيغ الصحيحة لجميع المواد المتفاعلة و النواتج.
C3H8 + O2 → CO2 + H2O
الخطوة 2: تأكد من عدد الذرات في كل جانب في المعادلة.
Reactant المتفاعلات Products النواتج
3 C atoms 1 C atom
8 H atoms 2 H atoms
2 O atoms 3 O atoms
الخطوة 3: قارن عدد كل ذرة على كل جانب من المعادلة. أضف المعاملات لموازنة عدد الذرات. و تذكر أن إضافة المعاملات هي لكل العناصر في المركب.
C3H8 + 5O2 → 3CO2 + 4H2O
الخطوة 4: أعد التأكد من عدد الذرات في طرفي المعادلة.
الخطوة 5: عندما يكون ذلك ممكنًا ، اكتب المعاملات بأقل نسبة ممكنة لها.
- ملاحظة مهمة جدًا: لا تقم أبدًا بتغيير الأرقام السفلية.
8.3 كميات المواد المتفاعلة و المواد الناتجة Amounts of Reactants and Products
- يقصد بمصطلح «قياس الاتحاد العنصري» بأنه الدراسة الكمية للمواد المتفاعلة (المتفاعلات) و الناتجة (النواتج) في التفاعل الكيميائي.
- يُقصد بطريقة المول أن معاملات القياس المتكافئ في المعادلة الكيميائية يمكن تفسيرها على أنها عدد مولات كل مادة.
- من خلال المعادلة الكيميائية يمكننا الحصول على العديد من المعلومات
- يتم تلخيص النهج العام لحل مشاكل القياس الكيميائي بعد ذلك.
1. اكتب معادلة موزونة للتفاعل.
2. تحويل الكمية المعطاة من المادة المتفاعلة (بالجرام أو الوحدات الأخرى) إلى عدد المولات.
3. استخدم النسبة المولية من المعادلة الموزونة لحساب عدد مولات المنتج المتكون.
4. تحويل مولات المادة الناتجة إلى جرامات (أو وحدات أخرى) منها.
9.3 المواد المحددة للتفاعل Limiting Reactants
- يُطلق على المادة المتفاعلة التي تستهلك أولاً في التفاعل اسم المادة المتفاعلة المحددة للتفاعل ، لأن الحد الأقصى لكمية المادة الناتجة المتكونة يعتمد على مقدار هذه المادة المتفاعلة الموجود أصلاً في التفاعل.
- عندما يتم استهلاك المادة المحددة للتفاعل، لا يمكن تكوين المزيد من المواد الناتجة.
- المادة المتفاعلة التي ستنتج أقل كمية من المادة الناتجة تعرف باسم المادة المحددة للتفاعل.
- المواد المتفاعلة الزائدة هي المواد المتفاعلة الموجودة بكميات أكبر من اللازم للتفاعل مع المادة المحددة للتفاعل.
- على سبيل المثال ، إذا تفاعلت 4 مولات من CO مع 6 مولات من H2 لتكوين CH3OH ، ففي بداية التفاعل، كان هناك ستة جزيئات H2 وأربعة جزيئات CO. في النهاية ، اختفت جميع جزيئات H2 ولم يتبق سوى جزيء واحد من CO . لذلك ،فإن جزيء H2 هو المتفاعل المحدد و CO هو المتفاعل الزائد.
10.3 مردود التفاعل Reaction Yield
- العائد النظري للتفاعل هو مقدار المادة الناتجة التي ستنتج إذا تفاعلت كل المتفاعلات المحددة.
- إذن ، العائد النظري هو أقصى عائد يمكن الحصول عليه و التي تتنبأ به المعادلة الموزونة.
- العائد الفعلي ، أو كمية المنتج التي تم الحصول عليها فعليًا من تفاعل و عادة ما تكون دائمًا تقريبًا أقل من العائد النظري.
- هناك العديد من الأسباب للاختلاف بين العوائد الفعلية والنظرية. على سبيل المثال ، العديد من التفاعلات عكوسة ، وبالتالي فهي لا تسـير بنسبـة 100 ٪ من اليسار إلى اليمين.
- في بعض التفاعلات ، قد تتفاعل النواتج المتكونة بشكل أكبر فيما بينها أو مع المواد المتفاعلة لتشكيل نواتج أخرى ، وستؤدي هذه التفاعلات الإضافية إلى تقليل ناتج التفاعل الأول.
- لتحديد مدى كفاءة تفاعل معين ، غالبًا ما يحدد الكيميائيون النسبة المئوية للإنتاجية ، والتي تصف نسبة العائد الفعلي إلى العائد النظري. وتحسب على النحو التالي:










بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرو في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :