ملخص الفصل الثالث من كتاب أساسيات الكيمياء العضوية لـ “جون ماكموري”
الألكينات و الألكاينات : طبيعة التفاعلات العضوية
Fundamentals of Organic Chemistry, J. McMurry
Chapter 3 notes, Alkenes & Alkynes: The Nature of Organic Reactions
إذا كنت تبحث عن ملخصات باقي الفصول فسوف تجدها في الروابط الآتية
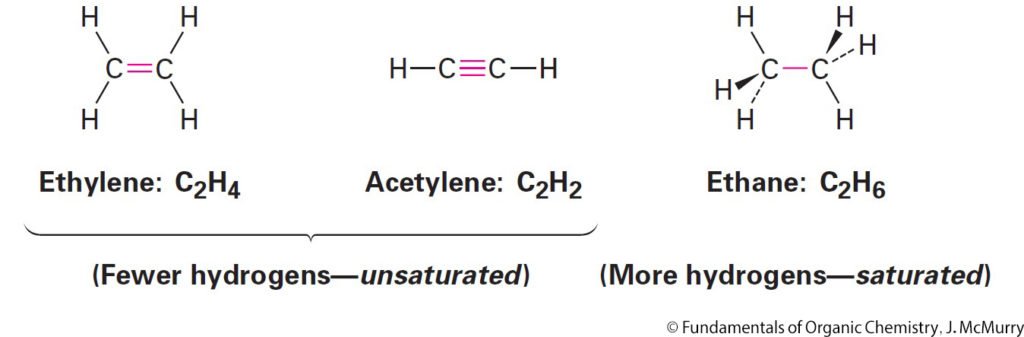
- Alkenes, sometimes called olefins, are hydrocarbons that contain a carbon–carbon double bond, C=C.
- الألكينات و التي تعرف أيضا باسم الأوليفينات هي هيدروكربونات تحتوي على رابطة ثنائية بين ذرتي الكربون (C=C) .
- Alkynes are hydrocarbons that contain a carbon–carbon triple bond, C≡C
- الألكاينات هي هيدروكربونات تحتوي على رابطة ثلاثية بين ذرتي الكربون (C≡C) .
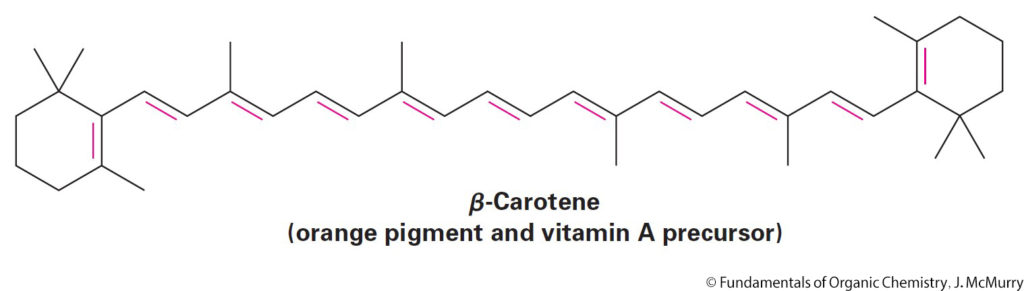
- Alkenes occur abundantly in nature, in Flavours, fragrances, vitamins…etc.
- توجد الإلكينات بوفرة في الطبيعة، في المنكهات و الروائح العطرية و الفيتامينات …الخ.

- Alkenes & alkynes are said to be unsaturated.
- الألكينات و الالكاينات تعرف بأنها مركبات غير مشبعة .
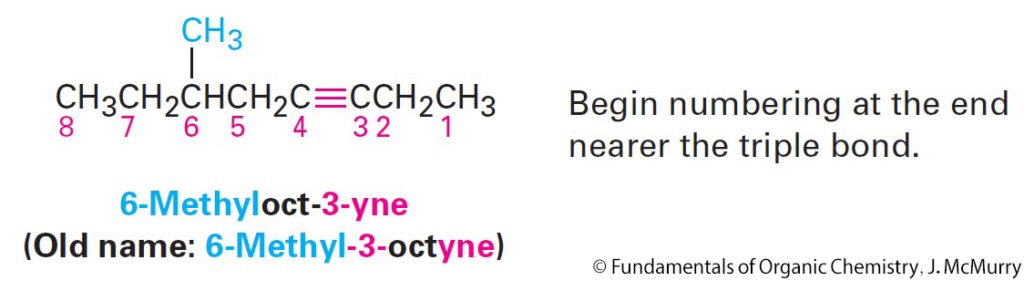
3.1 Naming Alkenes and Alkynes
تسمية الألكينات و الألكاينات
- Find the longest carbon chain that contains the double bond, and name the compound using the suffix -ene in place of -ane.
- ابحث عن أطول سلسلة كربون تحتوي على الرابطة الثنائية ، وقم بتسمية المركب باستخدام اللاحقة – ين بدلاً من – ان.

- Number the carbons in chain so that double bonded carbons have lowest possible numbers.
- قم بترقيم ذرات الكربون في السلسلة بحيث يكون لذرات الكربون في الرابطة الثنائية أقل عدد ممكن.

- Number the substituents on the main chain according to their position, and list them alphabetically. Indicate the position of the double bond by giving the number of the first alkene carbon and placing that number directly before the –ene If more than one double bond is present, give the position of each and use the appropriate multiplier suffix –diene, –triene, tetraene, and so on.
- قم بترقيم المجموعات البديلة في السلسلة الرئيسة وفقًا لمواضعها ، وقم بترتيبها أبجديًا. حدد موضع الرابطة الثنائية بإعطاء رقم لأول كربون ألكاني ووضع هذا الرقم مباشرة قبل اللاحقة – ين. في حالة وجود أكثر من رابطة مزدوجة واحدة ، أعط موضع كل منها واستخدم لاحقة المضاعف المناسبة -diene و -triene و tetraene وما إلى ذلك.
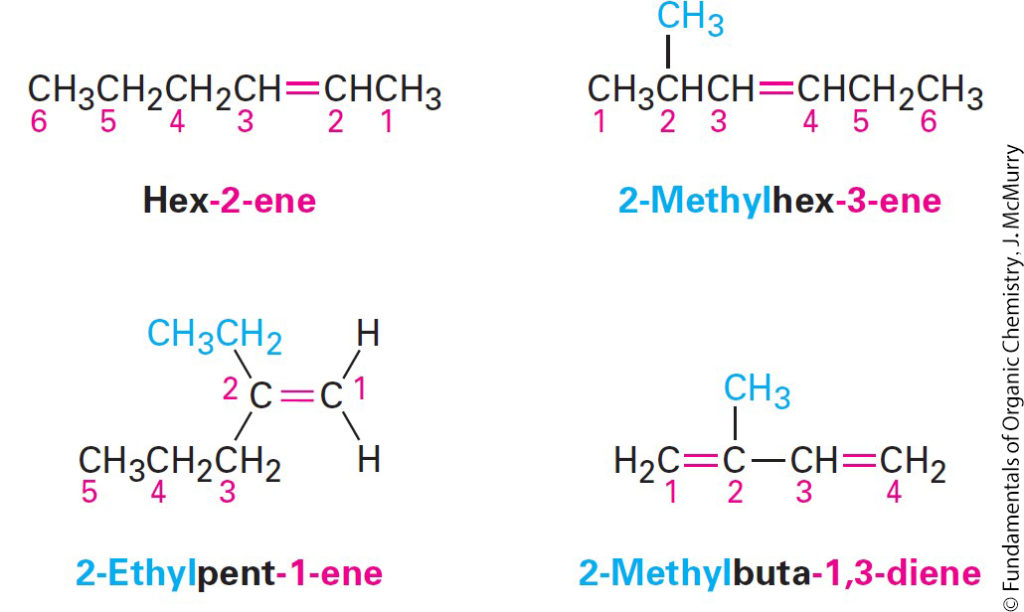

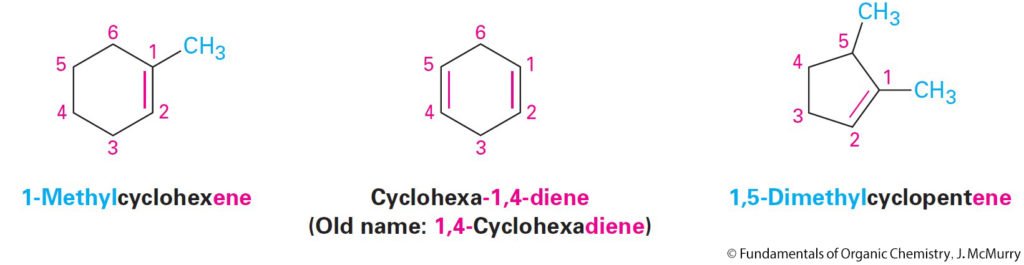
- Many Alkenes Are Known by Common Names
- العديد من الألكينات تعرف بالاسم الشائع.

- Alkynes are named in the same way as alkenes, with the suffix –yne used in place of – Numbering the main chain begins at the end nearer the triple bond so that the triple bond receives as low a number as possible.
- تتم تسمية الألكاينات بنفس طريقة تسمية الألكينات ، مع استخدام اللاحقة – اين بدلاً من – ين. إبدأ بترقيم السلسلة الرئيسة من الطرف الأقرب من الرابطة الثلاثية بحيث تتلقى الرابطة الثلاثية أقل عدد ممكن.
- As with alkyl groups derived from alkanes, alkenyl and alkynyl groups are also possible.
- كما هو الحال أن مجموعات الألكيل مشتقة من الألكانات، فإن مجموعات الألكينيل و الألكينايل تشتق أيضا من الألكينات و الألكاينات على التوالي .
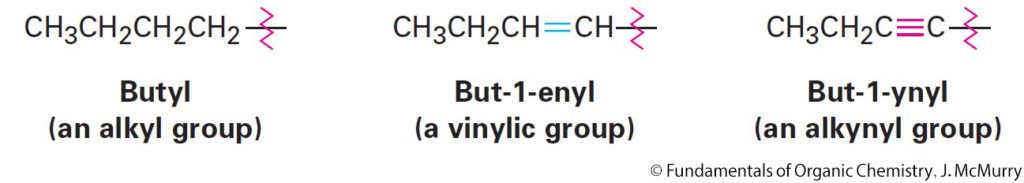
3.2 Electronic Structure of Alkenes
التركيب الإلكتروني للألكينات
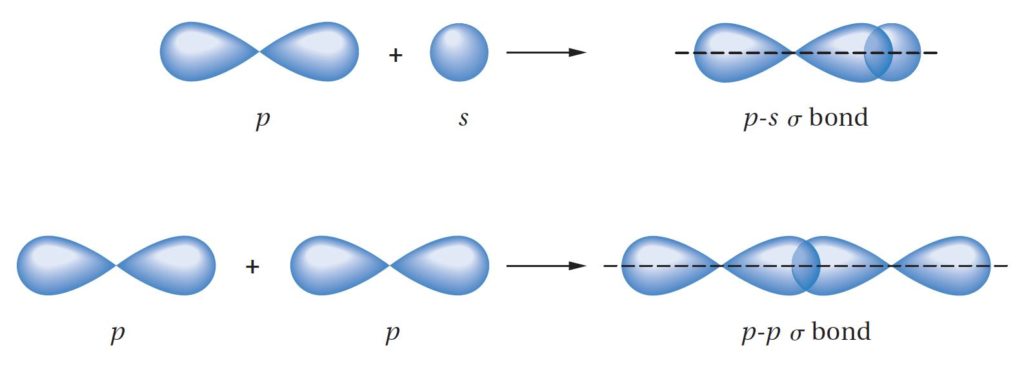
- Carbon atoms in double bond are sp2
- التهجين الحاصل في ذرات الكربون في الرابطة الثنائية من نوع sp2 .
- When two sp2-hybridized carbon atoms approach each other, they form a σ bond by head-on overlap of sp2 orbitals and a π bond by sideways overlap of p
- عندما تقترب ذرتي كربون مهجنة من نوع sp2 من بعضها البعض، فإنها تشكل رابطة سيجما σ عند التداخل من جهة الرأس لأفلاك sp2 و رابطة من نوع باي π عند التداخل الجانبي .

3.3 Cis-Trans Isomers of Alkenes
متصاوغات المقرون-المفروق للألكينات
- The presence of a carbon-carbon double bond can create two possible structures:
- إن وجود رابطة الكربون-الكربون ثنائية يمكن أن يؤدي إلى تكوين تركيبين (هيئتين) محتملتين:
- cis isomer – two similar groups on same side of the double bond.
- المصاوغ المقرون : المجموعتين المتشابهتين تقعان على نفس الجهة أو الجانب.
- trans isomer – similar groups on opposite sides.
- المصاوغ المفروق : المجموعتين المتشابهتين تقع في جهتين متعاكستين .
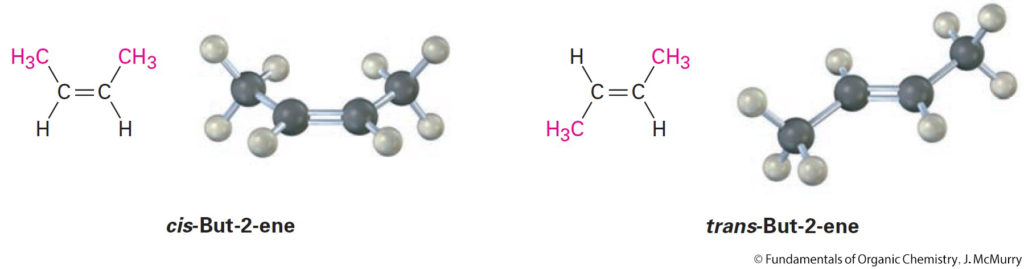
- cis alkenes are less stable than trans alkenes.
- الألكينات من نوع مقرون أقل ثباتا من الألكينات من نوع مفروق .

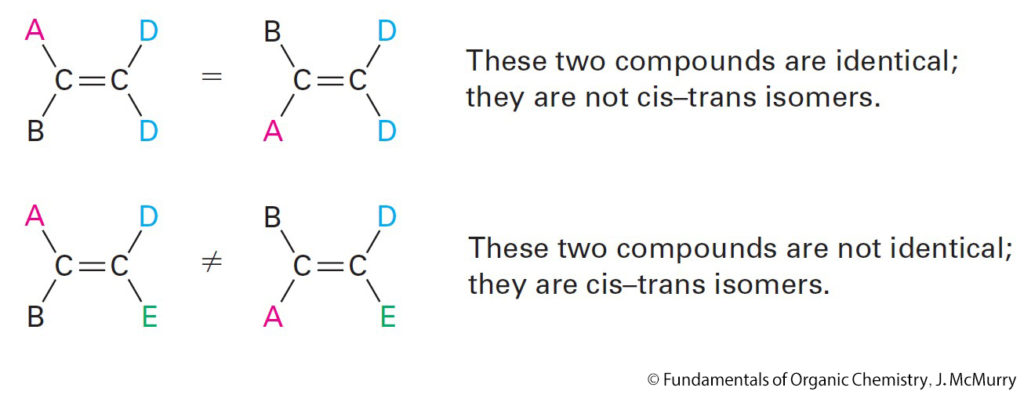
- If one of the double-bond carbons is attached to two identical groups, however, then cis–trans isomerism is not possible.
- إذا تم ربط إحدى ذرات الكربون الرابطة الثنائية بمجموعتين متشابهتين ، فلن لن يحدث تصاوغ من نوع المقرون أو المفروق.
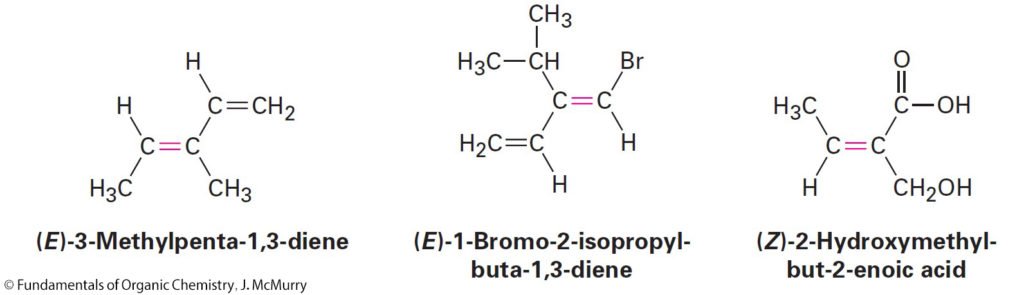
3.4 Sequence Rules: The E,Z Designation
قواعد التسلسل : عُرف E–Z للمصاوغات
- Cis-Trans naming system discussed thus far only works with disubstituted alkene.
- إن تسمية المركبات بناء على قاعدة المقرون-المفروق ناجحة في حال وجد هناك مجموعتين مرتبطتين بالألكين.
- Tri- and Tetra substituted double bonds require more general method.
- أما في حالة وجود ثلاث أو أربع مجموعات بديلة مرتبطة مع الألكين فإنه في هذه الحالة يتم استخدام قاعدة أكثر شمولا.
- Method referred to as the E,Z system.
- تعرف هذه القاعدة باسم “نظام E-Z”
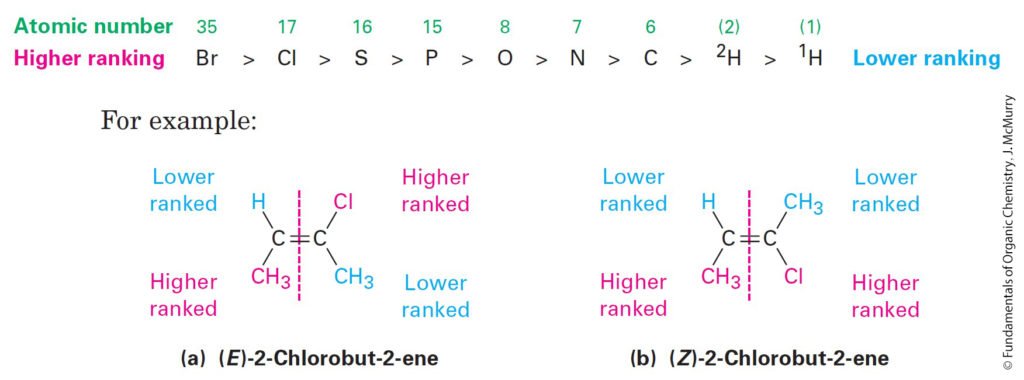
- According to the E,Z system, a set of sequence rules is used to rank the two substituent groups on each double-bond carbon. If the higher-ranked groups on each carbon are on opposite sides of the double bond, the alkene is said to have E stereochemistry, for the German entgegen, meaning “opposite.” If the higher-ranked groups are on the same side, the alkene has Z stereochemistry, for the German zusammen, meaning “together.
- وفقًا لنظام E ، Z ، يتم استخدام مجموعة من قواعد التسلسل لترتيب المجموعتين البديلتين على كل ذرة كربون في الرابطة الثنائية. فإذا كانت المجموعات ذات الرتبة الأعلى المرتبطة على كل ذرة كربون الرابطة الثنائية موجودة على جوانب متعاكسة ، فإنه يقال إن الألكين يحتوي على ترتيب فراغي من نوع E ، (من الكلمة الألمانية entgegen ، و تعني “العكس”). أما إذا كانت المجموعات الأعلى رتبة في نفس الجانب ، فإن الألكين له ترتيب فراغي من نوع Z ، (من الكلمة الألمانية zusammen ، و تعني “معًا”.

- Rank substituent atoms according to atomic number of first atom.
- يتم ترتيب الذرات البديلة طبقا للعدد الذري لأول ذرة.
- Higher atomic number gets higher priority: Br > Cl > S > P > O > N > C > H.
- الذرات ذات الأعداد الذرية العالية تأخذ الأولوية : Br > Cl > S > P > O > N > C > H
- If atomic numbers are the same, compare at next connection point at same distance.
- إذا كان العدد الذري متساويا ، قارن بنقطة الاتصال التالية.
- Compare until something has higher atomic number.
- قارن حتى التوصل إلى شيء ما له عدد ذري أعلى.
- Multiple-bonded atoms are equivalent to the same number of single-bonded atoms.
- الذرات ذات الروابط المتعددة مساوية للذرات الأحادية الرابطة إذا وجدت بنفس العدد.


3.5 Kinds of Organic Reactions
أنواع التفاعلات العضوية
- Addition reactions – two molecules combine.
- تفاعلات الإضافة : إتحاد بين جزيئين.

- Elimination reactions – one molecule splits into two.
- تفاعلات الحذف: جزيء واحد ينقسم إلى إثنين.
- Substitution – atoms from two molecules exchange.
- تفاعل الاستبدال: استبدال ذرات من جزيئين مختلفين مع بعضهما البعض.

- Rearrangement reactions – a single organic reactant undergoes a reorganization of bonds and atoms to yield a single isomeric
- تفاعلات إعادة الترتيب : مادة متفاعلة عضوية واحدة تخضع لإعادة ترتيب الروابط والذرات لإنتاج مركب متماثل.

3.6 How Reactions Occur: Mechanism
كيف تحدث التفاعلات: الميكانيكية
- In a clock the hands move but the mechanism behind the face is what causes the movement.
- في الساعة تتحرك العقارب ولكن الآلية خلف وجه الساعة هي التي تسبب الحركة.
- In an organic reaction, we see the transformation that has occurred. The mechanism describes the steps behind the changes that we observe.
- في التفاعل العضوي ، نرى التحول الذي حدث. تصف الميكانيكية الخطوات وراء التغييرات التي نلاحظها.
- Reactions occur in defined steps that lead from reactant to product – invariably this involves the flow of electrons from one atom to another.
- تحدث التفاعلات في خطوات محددة والتي بسببها يتم التحول من المادة متفاعلة إلى المادة الناتجة – وهذا ينطوي دائمًا على انتقال الإلكترونات من ذرة إلى أخرى.
- A mechanism describes what takes place at each stage of a chemical transformation—which bonds are broken and in what order, which bonds are formed and in what order, and what the relative rates of the steps are.
- تصف الميكانيكية ما يحدث في كل مرحلة من مراحل التحول الكيميائي – أي الروابط تنكسر وبأي ترتيب ، وما هي الروابط التي تتشكل وبأي ترتيب ، وما هي المعدلات النسبية للخطوات.
- All chemical reactions involve bond-breaking in the reactant molecules and bond-making in the product molecules.
- تتضمن جميع التفاعلات الكيميائية تكسير الروابط في جزيئات المادة المتفاعلة وتكوين روابط في جزيئات المادة الناتجة .
- A covalent two electron bond can break in two ways: a bond can break in an electronically symmetrical way so that one electron remains with each product fragment, or a bond can break in an electronically unsymmetrical way so that both electrons remain with one product fragment, leaving the other fragment with a vacant orbital.
- يمكن أن تنكسر الرابطة التساهمية ثنائية الإلكترون بطريقتين: الأولى : يمكن أن تنكسر الرابطة بطريقة متناظرة إلكترونيًا بحيث يبقى إلكترون واحد مع كل جزء ناتج عن الكسر ، أو يمكن أن تنكسر الرابطة بطريقة غير متماثلة إلكترونيًا بحيث يبقى كلا الإلكترونين مع جزء ناتج واحد ، تاركًا الجزء الآخر بفلك فارغ.
- The symmetrical cleavage is said to be homolytic, and the unsymmetrical cleavage is said to be heterolytic.
- يعرف الانقسام المتماثل باسم هوموليتيك ، و يعرف الانقسام غير المتماثل باسم هيتيروليتك.


- Processes that involve symmetrical bond-breaking and bond-making are called radical reactions.
- العمليات التي تنطوي على كسر الروابط بطريقة متماثلة وتكوين الروابط جديدة تسمى تفاعلات الشقوق.
- A radical is a neutral chemical species that has a single, unpaired electron in one of its orbitals.
- الشق هو دقيقة كيميائية متعادلة يحتوي على إلكترون واحد غير مترابط (غير مزدوج) في أحد مداراته.
- Processes that involve unsymmetrical bond breaking and making are called polar reactions.
- العمليات التي تنطوي على كسر الرابطة غير المتماثل و تكوين روابط جديدة تسمى التفاعلات القطبية.
- Polar reactions involve species that have an even number of electrons and thus have only electron pairs in their orbitals.
- التفاعلات القطبية تشمل الدقائق التي لديها عدد زوجي من الإلكترونات وبالتالي ليس لديها سوى أزواج إلكترونية في مداراتها.
- When carbon bonds to a more electronegative atom, such as chlorine or oxygen, the bond is polarized so that the carbon bears a partial positive charge (δ+) and the electronegative atom bears a partial negative charge (δ–). When carbon bonds to a less electronegative atom, such as a metal, the opposite polarity results.
- عندما يرتبط الكربون بذرة أكثر كهروسالبية ، مثل الكلور أو الأكسجين ، يتم استقطاب الرابطة بحيث يحمل الكربون شحنة موجبة جزئية (+δ) وتحمل الذرة الأكثر كهروسالبية شحنة سالبة جزئية (–δ). وعندما يرتبط الكربون بذرة أقل كهروسالبية ، مثل الفلزات ، ينتج عن ذلك القطبية المعاكسة.

- Chemists normally indicate the movement of an electron pair during a polar reaction by using a curved, full-headed arrow. A curved arrow shows where electrons move when reactant bonds are broken and product bonds are formed.
- يشير الكيميائيون عادةً إلى حركة زوج الإلكترونات أثناء التفاعل القطبي باستخدام سهم منحني كامل الرأس. و يوضح السهم المنحني المكان الذي تتحرك فيه الإلكترونات عند كسر روابط المتفاعلات وتشكيل روابط النواتج.
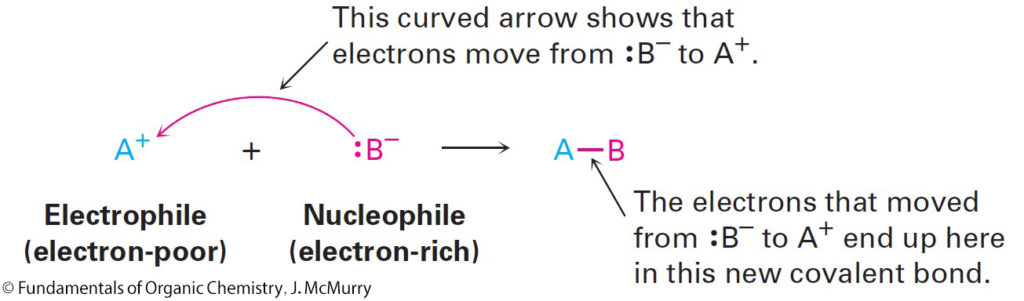
- A nucleophile is a substance that is “nucleus loving” and thus attracted to a positive charge.
- النيوكليوفيل هي مادة “محبة للنواة” وبالتالي تنجذب إلى الشحنة الموجبة.
- Nucleophiles can be either neutral or negatively charged and usually have lone-pairs of electrons: ammonia, water, hydroxide ion, and chloride ion are examples.
- يمكن أن تكون النيوكليوفيلات متعادلة أو سالبة الشحنة وعادة ما تحتوي على أزواج وحيدة من الإلكترونات: و المثال على النيوكليوفيلات هي الأمونيا والماء وأيون الهيدروكسيد وأيون الكلوريد.
- An electrophile is a substance that is “electron-loving.”
- الإلكتروفيل هي مادة “محب للإلكترون”.
- An electrophile has a positively polarized, electron-poor atom and can form a bond by accepting a pair of electrons from a nucleophile.
- يحتوي الإلكتروفيل على ذرة موجبة الاستقطابية و تفتقر إلى الإلكترون ويمكنه تكوين رابطة عن طريق قبول زوج من الإلكترونات من النيوكليوفيل.
- Electrophiles can be either neutral or positively charged. Acids (H+ donors), alkyl halides, and carbonyl compounds are examples.
- يمكن أن تكون الإلكتروفيلات إما متعادلة أو موجبة الشحنة. ومن الأمثلة على ذلك الحموض (مانحة للبروتون +H) وهاليدات الألكيل ومركبات الكربونيل.
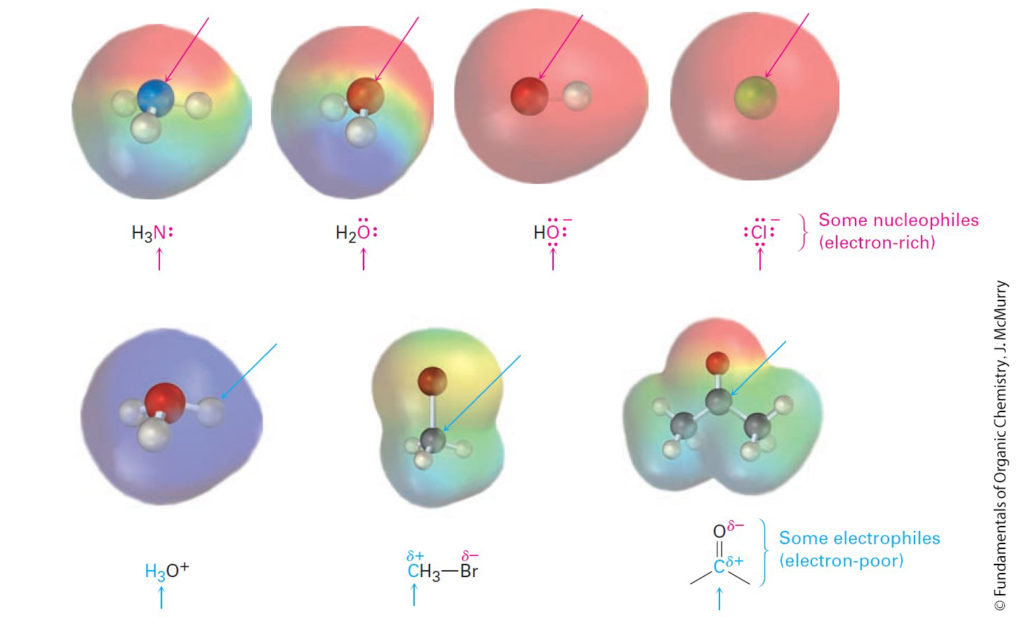
- The neutral compounds can often react either as nucleophiles or as electrophiles, depending on the circumstances.
- يمكن أن تتفاعل المركبات المتعادلة ك “نيوكليوفيلات ” أو ك “إلكتروفيلات” و ذلك اعتمادا على ظروف التفاعل.
- Water, for example, acts as an electrophile when it donates H+ but acts as a nucleophile when it donates a nonbonding pair of electrons.
- على سبيل المثال ، يمكن للماء أن يتفاعل ك “نيوكليوفيل” عندما يمنح بروتون H+ ، و أيضا يمكن له أن يتفاعل ك”إلكتروفيل” عندما يمنح زوجا من الإلكترونات غير الرابطة.
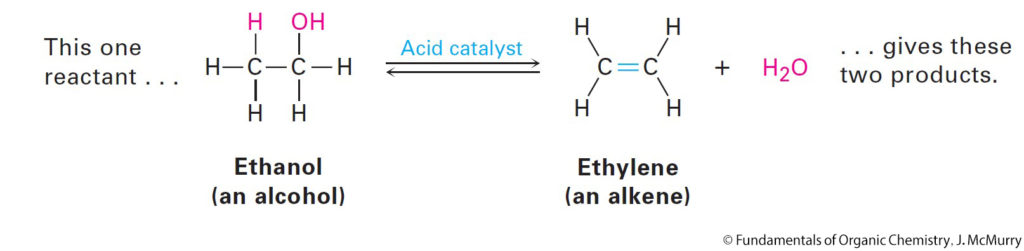
3.7 The Mechanism of an organic Reaction: Addition HCl to Ethylene
ميكانيكية التفاعل الكيميائي : إضافة HCl إلى الإيثيلين
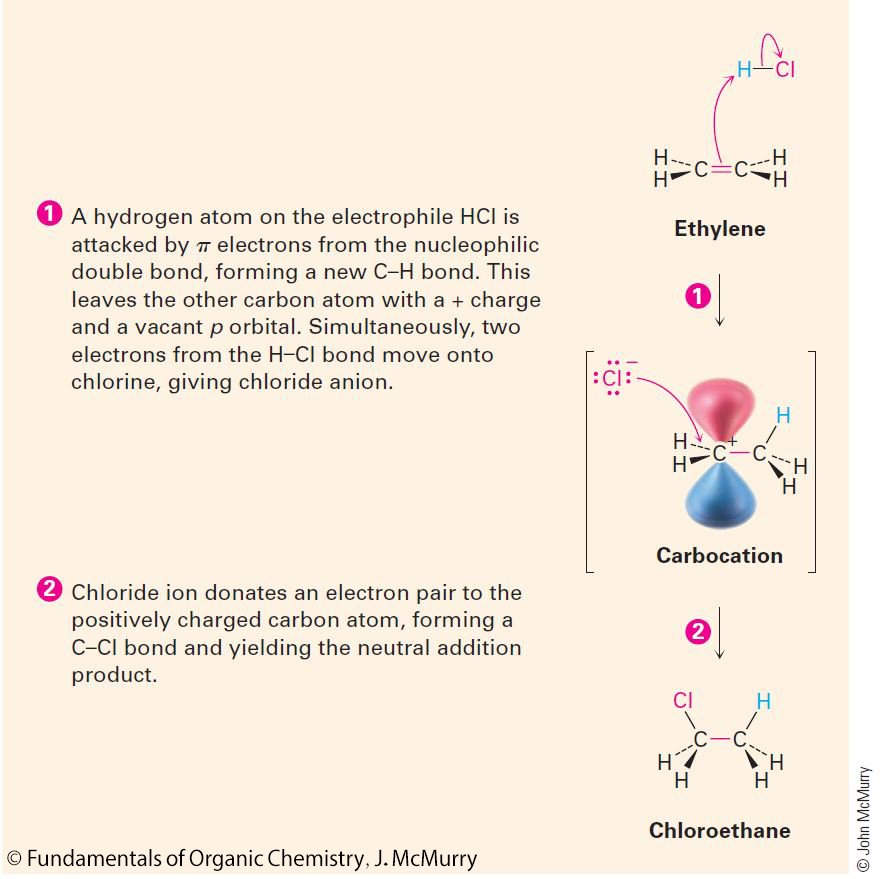
- HCl adds to the π bond.
- يتم إضافة HCl إلى الرابطة π .
- The π bond is electron-rich, allowing it to function as a nucleophile.
- الرابطة π غنية بالإلكترونات و بالتالي تعمل ك ” نيوكليوفيل” .
- H-Cl is electron deficient at the H since Cl is much more electronegative, making HCl an electrophile.
- يلاحظ أن هناك افتقار للإلكترونات عند ذرة الهيدروجين بسبب الكهروسالبية العالية للكلور، و هذا يجعل HCl يعمل ك ” إلكتروفيل” .

- HCl electrophile is attacked by π electrons of ethylene (nucleophile) to form a carbocation intermediate and chloride ion.
- تهاجم إلكترونات الرابطة باي π للإيثيلين الإلكتروفيل HCl ناتجا عن ذلك تكون الكربوكاتيون (الكاتيون الكربوني) كحالة وسط و أيضا تكون أيون الكلور
- Chloride adds to the positive center of the carbocation, which is an electrophile, forming a C-Cl σ
- يضاف أيون الكلور إلى الطرف الموجب للكربوكاتيون و الذي يعتبر إلكتروفيل، ناتجا عن ذلك تكون رابطة سيجما σ بين الكلور و الكربون.
- The result is that ethylene and HCl combine to form chloroethane.
- النتيجة النهائية هو اتحاد الإيثيلين مع HCl لتكوين كلوريد الإيثان.
- All polar reactions occur by combination of an electron-rich site of a nucleophile and an electron-deficient site of an electrophile.
- تحدث جميع التفاعلات القطبية عن طريق اتحاد الطرف الغني بالإلكترونات في النيوكليوفيل مع الطرف الفقير للإلكترونات في الإلكتروفيل.
3.8 Describing a Reaction: Transition States and Intermediates
وصف التفاعل: الحالات الإنتقالية و المركبات الوسطية
- The highest energy point in a reaction step is called the transition state.
- أعلى نقطة طاقة في خطوة التفاعل تسمى الحالة الانتقالية.
- The energy needed to go from reactant to transition state is the activation energy (Eact).
- الطاقة اللازمة للانتقال من المواد المتفاعلة إلى الحالة الانتقالية تعرف باسم طاقة التنشيط (Eact).

- If a reaction occurs in more than one step, it must involve species that are neither the reactant nor the final product.
- في حالة حدوث تفاعل في أكثر من خطوة ، يجب أن يشمل المركبات التي ليست هي المادة المتفاعلة ولا الناتج النهائي.
- These are called reaction intermediates or simply “intermediates”.
- هذه تسمى المركبات باسم المركبات الوسطية للتفاعل أو ببساطة “المركبات الوسطية”.
- Each step has its own free energy of activation.
- كل خطوة لها طاقتها الحرة للتنشيط.
- The complete diagram for the reaction shows the free energy changes associated with an intermediate.
- يوضح الرسم البياني الكامل للتفاعل تغيرات الطاقة الحرة المرتبطة المركب الوسطي..

3.9 Describing a Reaction: Catalysis
وصف التفاعل: التحفيز
- A catalyst is a substance that increases the rate of a reaction by providing an alternative mechanism.
- المادة المحفزة هي مادة تزيد من معدل التفاعل من خلال توفير ميكانيكية بديلة.
- The catalyst participates in the reaction.
- تشارك المادة المحفزة في التفاعل.

- It is regenerated during the reaction.
- تتجدد المادة المتفاعلة أثناء التفاعل.
- The catalyst provided a mechanism with a lower activation energy.
- توفر المادة المحفزة ميكانيكية التفاعل ذات طاقة تنشيط أقل.

بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرو في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة