تطور النظرية الذرية عبر التاريخ
(الكيمياء العامة المستوى الاول – الكلية الجامعية بالجموم)
تطور النظرية الذرية عبر التاريخ
نموذج دالتون:
وضع العالم الإنجليزي جون دالتون ما يمكن اعتباره أول نظرية علمية للذرة ، و تنص على :
1 – تتألف العناصر من دقائق صغيرة تدعى الذرات غير قابلة للإنقسام و لا يستطيع الإنسان افناءها .
2 – الذرة هي أصغر جزء من العنصر .
3 – ذرات العنصر الواحد متشابهة تماما في جميع الخواص .
4 – تختلف العناصر بسبب اختلاف ذراتها .
5 – عندما تتحد الذرات لتشكل مركبات ، فإن الأتحاد يتم بين ذرات صحيحة العدد ( لا تحتوي على كسور أو أجزاء من الذرة ) .
نموذج ثومسون:
أفترض ثومسون أن :
- الذرة تتكون من جسيم صلب متجانس موجب الشحنة .
- تتوزع الإلكترونات السالبة فيه بانتظام .
- أن الذرة متعادلة كهربائيا وعدد الشحنات الموجبة يساوي عدد الشحنات السالبة.
نموذج رذرفورد:
قام العالم إيرنيست رذرفورد بقذف رقاقة من الذهب بسيل من أشعة ألفا ذات الشحنة الموجبة ، و أحاط الصفيحة من جميع جهاتها بألواح مغطاة بكبريتيد الخارصين ، وهي مادة تصدر ومضات صغيرة من الضوء عند ارتطام دقائق الفا بها . فلاحظ بأن معظم هذه الأشعة يخترق رقاقة الذهب بسهولة و لكن بعضها يتشتت و لا يبقى في مساره .
توصل رذرفورد للنقاط التالية :
- تتكون ذرة كل عنصر من نواة تحتوي بداخلها على شحنة موجبة و تمثل هذه النواة معظم كتلة الذرة.
- الذرة تكون في حالة تعادل كهربائي في حالتها العادية .
- تتركز كتلة الذرة في نواتها أما الإلكترون فيمكن اهمال كتلته لصغره بالنسبة لكتلة النواة .
- تدور الإلكترونات حول النواة كما تدور الكواكب حول الشمس .
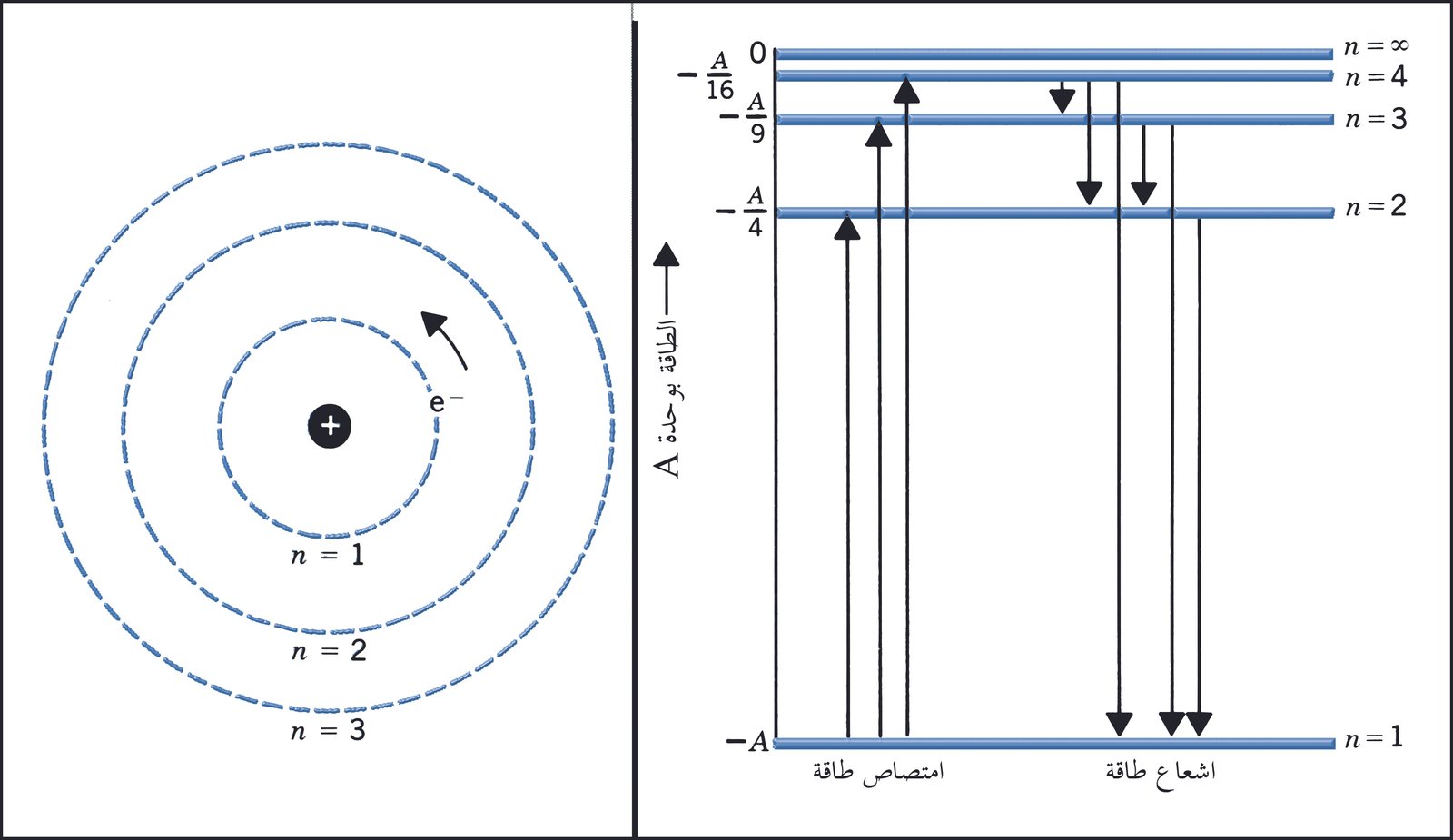
نموذج بور:
قام العالم نيلز بور بدراسة طيف ذرة الهيدروجين لأنها أبسط الذرات و طيفها أبسط الأطياف و وضع نظرية تتعلق بتركيب الذرة و يمكن تلخيص أهم نقاطها كالتالي :
- تدور الإلكترونات حول النواة في مستويات ذات طاقة محددة و ذات قطر محدد تعرف بالطبقات الرئيسة تعتمد على بعد الإلكترون عن النواة و يرمز لهذه المستويات بالحـــروف K , L , M , N….. أو بالأرقــام ……..، n = 1 ، 2 ، 3 .
- لا تشع الإلكترونات الذرة أي جزء من الطاقة و لا تمتصها ما دامت تدور في أحد مستوياتها المحددة و لا تغيره .
- عند انتقال الإلكترون من مستوى ذو طاقة أعلى إلى مستوى ذو طاقة اقل فإن الذرة تشع كميات محددة من الطاقة على شكل وحدات ( كوانتا ) و ينتج عن ذلك الطيف الخطي . و مقدار الطاقة التي يفقدها الإلكترون تساوي الفرق بين طاقتي المستويين اللذين انتقل بينهما.
- vتمتص الذرة الطاقة بكميات محددة و تنتقل الإلكترونات من مستوى طاقة أقرب إلى النواة إلى مستوى طاقة أعلى و ذلك بتعريض الذرة لطاقة .vمقدار الطاقة التي يمتصها أو يشعها الإلكترون يكون مساويا للفرق بين طاقتي المستويين اللذين انتقل بينهما ، و يمكن حساب هذه الطاقة من خلال العلاقة التالية:
ΔE = Ef ‒ Ei
نموذج شرودنجر:
- تمكن العالم شرودنجر من اثبات عدم وجود مدارات ثابتة للإلكترونات ولكنه اتفق مع بور حول وجود مستويات للطاقة .
- اقترح شرودنجر نموذجا آخر اطلق عليه نموذج السحابة الالكترونية .
- حسب نظرية شرودنجر فإن الإلكترونات لا تتحرك في مسارات محددة و لكنها في موجات، و من المستحيل معرفة مكان وجود الإلكترونات و لكن هناك سحابة من الاحتمالات ممكن أن تتواجد فيها الإلكترونات تعرف باسم الأفلاك .
- من خلال نموذج شرودنجر تم إثبات أن للإلكترون طبيعة مزدوجة جسيمية و موجية.
- عند حل معادلة شرودنجر ينتج وصف لوضع الإلكترون يتمثل في ثلاثة أعداد تعرف بأعداد الكم حيث تصف مكان أو موضع الإلكترون و طاقته و شكل حركته حول النواة بالأبعاد الثلاثة .
- كما أنه وفقا لمعادلته قام بإضافة عدد كمي رابع لاحقا يصف إتجاه الدوران المحوري للإلكترون حول نفسه.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :