العوامل الإلكترونية التي تتحكم بالرابطة و التركيب البنائي
Posted in :
العوامل الإلكترونية التي تتحكم بالرابطة و التركيب البنائي
(الكيمياء العامة المستوى الاول – الكلية الجامعية بالجموم)
يتأثر الشكل البنائي و كذلك الرابطة في المركب على مدى قوة الذرات على جذب أو نفر الإلكترونات و علي المدارات الذرية المشغولة من قبل إلكترونات التكافؤ ، و أيضا على التجاذبات الإلكترونية بين الإلكترونات الحرة.
أهم العوامل الإلكترونية التي تتحكم بالرابطة و التركيب البنائي
1 – شحنة النواة الفعالة
- ذلك الجزء من شحنة النواة الذي تتأثر به الإلكترونات الخارجية .
- إلكترونات الذرة الموجودة في مستوى الطاقة الأخير لا تتأثر بكل شحنة النواة الموجبة الناتجة عن البروتونات ، بل تتأثر بجزء أقل وذلك لوجود إلكترونات داخلية حاجبة تحجب تأثير البروتونات عن الإلكترونات الخارجية مثال : الإلكترون الأخير في ذرة الصوديوم لا يتأثر بـ 11 بروتون وانما بجزء منها بسبب وجود 10 إلكترونات داخلية حاجبة.
- تتغير شحنة النواة الفعالة حسب عدد أفلاك الإلكترونات و حسب بعد الإلكترونات عن النواة.
2 – طاقة التأين
- – يرمز لها بالرمز I ، و هي أقل طاقة لازمة لإزالة الكترون من ذرة أو جزيء إلى مسافة ما بحيث لا يصبح هناك أي تجاذب كهرستاتيكي بين الأيون و الإلكترون.
يقاس جهد التأين بالفولت .
- انتزاع إلكترون من الذرة و هي في الحالة الغازية أسهل من انتزاعه و الذرة في الحالة السائلة أو الصلبة
- تختلف قيم طاقة التأين في الذرات عديدة الإلكترونات حيث نجد بأن قيمة طاقة التأين اللازمة لنزع الإلكترون الأول قليلة بينما تكون أكبر عند نزع الإلكترون الثاني و هكذا.
- عند دراسة طاقات التأين يلاحظ ما يلي :1 – العناصر القلوية تمتلك أدنى قيمة تأين حيث يوجد إلكترون واحد فقط في مدارها الأخير بالإضافة إلى كبر حجمها .
2 – للغازات النبيلة أكبر قيم لطاقات التأين نظرا لامتلاء أغلفتها بالإلكترونات و لصغر حجمها.
3 – تزداد قيم طاقات التأين في الدورة الواحدة من اليسار إلى اليمين و السبب صعوبة نزع الإلكترون لزيادة قوى التجاذب بين الإلكترونات و النواة لصغر حجم الذرة عبر الدورة.
4 – تقل قيم طاقات التأين في المجموعة الواحدة من الأعلى لأسفل لسهولة نزع إلكترون المدار الأخير لبعده عن النواة لكبر حجم الذرة عبر الدورة
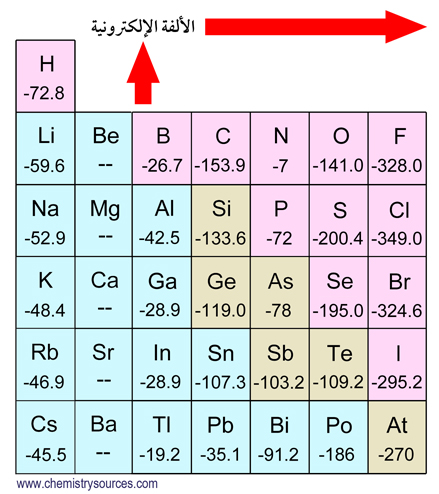
3 – الألفة الإلكترونية
- هي كمية الطاقة المنطلقة عندما يضاف إلكترون إلى ذرّة متعادلة ( في الحالة الغازية ) لتكون أيون مشحونا بشحنة سالبة.
M(g) + e− → M−(g) + Energy
- الألفة الإلكترونية للعنصر هي مقياس لميل ذلك العنصر للسلوك كعامل مؤكسد (مستقبل للإلكترون) و هي في العادة ترتبط مع طبيعة الروابط الكيميائية التي يشكلها العنصر مع العناصر الأخرى.
- عند دراسة قيم الألفة الإلكترونية في الجدول الدوري يلاحظ ما يلي :
1 – تزداد الألفة الإلكترونية في الدورة الواحدة من اليسار إلى اليمين.
2 – تقل قيم الألفة الإلكترونية في المجموعة الواحدة من أعلى لأسفل .
3 – الهالوجينات لها أعلى ألفة إلكترونية ، و لكن يلاحظ عدم انتظام في قيم الألفة الإلكترونية من اليود إلى الفلور .
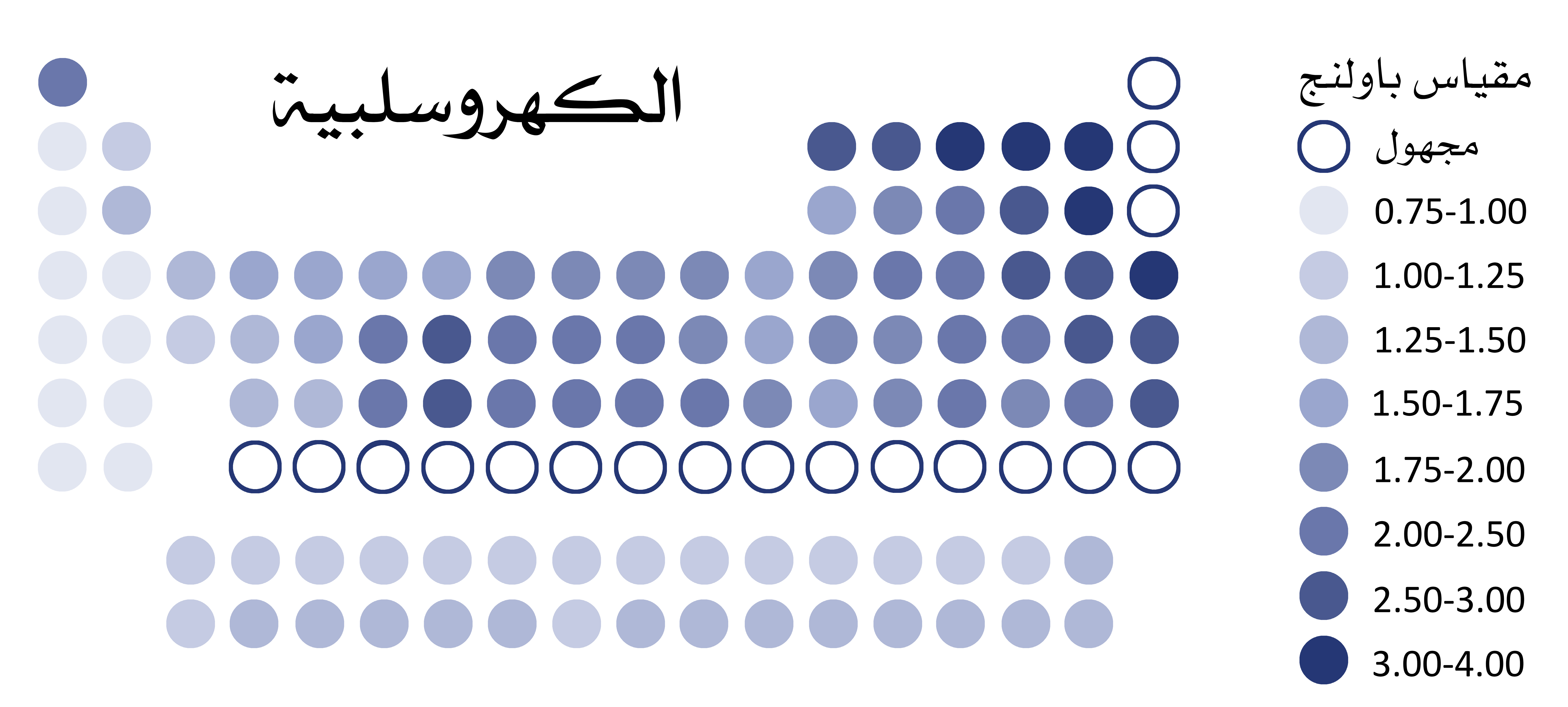
4 – الكهروسالبية
- تعرف الكهروسالبية بأنها قدرة الذرات على جذب إلكترونات الرابطة بصورة أكبر نحوها.
- تزداد قيم الكهرسالبية كلما اتجهنا في الجدول الدوري إلى اليسار إلى اليمين بسبب زيادة الشحنة الموجبة (العدد الذري) فتزداد قوة الجذب عند الذرة .
- إذا انتقلنا من أعلى إلى أسفل في الجدول الدوري نلاحظ نقصان في قيم الكهرسالبية ، وذلك بسبب زيادة مستويات الطاقة فتقل قوة الجذب عند الذرة وتقل الكهرسالبية.
- و يمكن من خلال الكهرسالبية تحديد نوع الرابطة فإذا كان الفرق في الكهرسالبية عالياً تكون الرابطة أيونية أو تساهمية قطبية و ذلك حسب نوع العناصر الداخلة في تركيب المركب .
- إذا كانت بين فلز ولا فلز تكون أيونية وإذا كانت بين لا فلز و لا فلز تكون تساهمية قطبية .
- إذا كان الفرق في الكهرسالبية يساوي صفر، فهي رابطة تساهمية غير قطبية وتكون بين نحو متشابه من الذرات مثل Cl و Cl يعني Cl2 .
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :