مقدمة في الكيمياء العضوية – الهيدروكربونات و المجموعات الوظيفية (الفقرات 6-7 إلى 6-19)
Posted in :
مقدمة في الكيمياء العضوية – الهيدروكربونات و المجموعات الوظيفية (الفقرات 6-7 إلى 6-19)
الهيدروكربونات و المجموعات الوظيفية
(الكيمياء العامة المستوى الاول – الكلية الجامعية بالجموم)
6 – 7 الهيدروكربونات
هي عائلة من المركبات العضوية تتكون من الكربون و الهيدروجين فقط و هي تعتبر من أبسط المركبات العضوية تركيبا و يمكن اعتبارها بأنها أساس باقي المركبات العضوية الأخرى .
6 – 8 الألكانات
هي مركبات هيدروكربونية مشبعة صيغتها العامة CnH2n+2 حسب نظام الأيوباك فإن اسم المركبات الألكانية ينتهي باللاحقة – ان ane و توجد الألكانات في الغاز الطبيعي و البترول .
أمثلة: الميثان CH4 و الإيثان C2H6 و البروبان C3H8 و البيوتان C4H10 و غيرها . و يمكن تحضيرها من خلال تسخين الملح الصوديومي لحمض كربوكسيلي مع هيدروكسيد الصوديوم .
RCOO−Na+ + Na−OH− → Na2CO3 + RH
أبسط الألكانات الحلقية هو البروبان الحلقي و صيغته الكيميائية C3H6 و هذا الجزيء مكون من حلقة تتكون من ثلاثة ذرات كربون كل منها متصل به ذرتي هيدروجين.
6 – 9 الألكينات
مركبات عضوية هيدروكربونية غير مشبعة تحتوي على رابطة ثنائية واحدة أو أكثر بين ذرتي كربون . صيغتها العامة CnH2n حسب نظام الأيوباك فإن اسم المركبات الألكينية تنتهي بالمقطع –ين ene . أمثلة: الإيثين CH2=CH2 و البروبين CH3CH=CH2 .
و المركبات التي تحتوي على أربع ذرات كربون أو أكثر تبدي ظاهرة التصاوغ أو التماكب و ذلك اعتمادا على موقع الرابطة الثنائية في الجزيء . فجزيء البيوتين C4H8 مثلا يظهر نوعين من التصاوغات و هي
1-بيوتين C2H5CH=CH2 و 2- بيوتين CH3CH=CHCH3.
تحضر الألكينات من خلال ازالة الهيدروجين من الكحولات :
RCH2CH2OH – H2O → RCH=CH2
و كذلك من خلال ازالة ذرة هيدروجين من مركبات هاليدات الألكيل بواسطة هيدروكسيد البوتاسيوم في وجود محلول كحولي :
RCH2CH2Cl + KOH → KCl + H2O + RCH=CH2
6 – 10 الألكاينات
الألكاينات هي هيدروكربونات غير مشبعة تحتوي على رابطة ثلاثية واحدة أو أكثر بين ذرتي كربون صيغتها العامة CnH2n-2 حسب الأيوباك ينتهي اسم المركبات التي تنتمي إلى هذه الطائفة باللاحقة –آين yne . أمثلة: الإيثاين CH≡CH و البروباين CH3C≡CH .
يمكن تحضير الألكاينات من خلال تفاعل هيدروكسيد البوتاسيوم في وسط كحولي مع هاليد ألكيل :
RCHClCH2Cl + 2KOH → 2KCl + 2H2O + RC≡CH
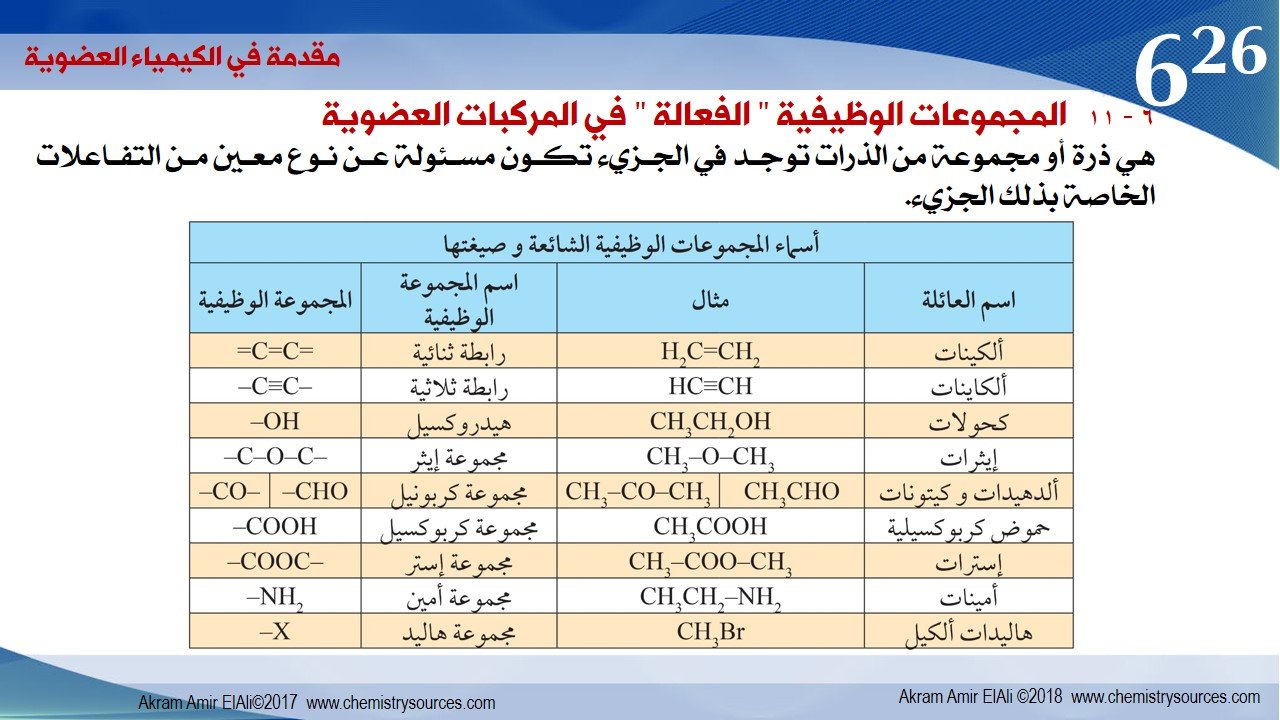
6 – 11 المجموعات الوظيفية ” الفعالة ” في المركبات العضوية
هي ذرة أو مجموعة من الذرات توجد في الجزيء تكون مسئولة عن نوع معين من التفاعلات الخاصة بذلك الجزيء.
6 – 12 الكحولات
1 – مركبات عضوية تحتوي على مجموعة هيدروكسيل OH-
مرتبطة مع ذرة كربون .
و حسب نظام الأيوباك فإن اسم مركبات الكحولات تنتهي باللاحقة –ول .
2 – تصنف الكحولات حسب عدد مجموعات الهيدروكسيل الموجودة فيها إلى كحولات أولية مثل الكحول الميثيلي أو الميثانول CH3OH ، و كحولات ثنائية مثل جلايكول الإيثيلين CH2OH-CH2OH و كحولات ثلاثية مثل الجليسرين CH2OH-CH(OH)-CH2OH .
3 – تعرف الكحولات التي تحتوي على شقوق عطرية بالفينولات .
تتفاعل الكحولات مع الفلزات النشطة لتكون الألكوكسيدات مثل CH3ONa .
4 – تتأكسد الكحولات إلى ألدهيدات أو إلى كيتونات و كذلك تتفاعل مع الحموض لتعطي الإسترات ، و عند نزع الماء من الكحولات يحضر الألكينات و الإيثرات .
5 – تحضر الكحولات بتفاعل الهالوجينات الألكيلية مع المواد القلوية :
R-Cl + NaOH → ROH + NaCl
6 – تحضر الكحولات أيضا بإماهة الهيدروكربونات غير المشبعة :
CH2=CH2 + H2O → CH3CH2OH
تدخل الكحولات في صناعات المركبات العضوية الأخرى و في صناعة الأدوية الطبية و العطور و المواد البلاستيكية و الصناعية و غيرها .
تصنف الكحولات عادة إلى ثلاثة أصناف حسب عدد ذرات الكربون أو حسب عدد المجموعات الألكيلية المرتبطة مباشرة بذرة الكربون الحاملة لمجموعة الهيدروكسيل
6 – 13 الحموض الكربوكسيلية
1 – مركبات عضوية تحتوي على مجموعة كربوكسيل COOH – (مجموعة كربونيل متحدة مع مجموعة هيدروكسيل ) .
2 – حسب نظام الأيوباك ينتهي اسم الحموض الكربوكسيلية باللاحقة –ويك ، مثال حمض الإيثانويك CH3COOH .
3 – الحموض الكربوكسيلية في العادة حموض ضعيفة .
4 – توجد العديد من الحموض الكربوكسيلية الطويلة طبيعيا على شكل إسترات في الدهون و الزيوت .
6 – 14 الألدهيدات
1 – مركبات هي مركبات عضوية تحتوي على مجموعة ألدهيدCHO – .
2 – حسب نظام الأيوباك فإن اسم المركبات الألدهيدية ينتهي باللاحقة –ال .
3 – مثال على الألدهيدات: الميثانال ( الاسم الشائع هو الفورمالدهيد ) HCOH و الإيثانال ( الاسم الشائع هو الأسيتالدهيد ) CH3CHO .
4 – تنتج الألدهيدات من أكسدة الكحولات الأولية.
5 – الألدهيدات عوامل مختزلة لذلك يمكن الكشف عنها من خلال محلول فهلنج و محلول تولينز .
6 – تستخدم الألدهيدات في إنتاج المواد البلاستيكية و كمواد أولية في إنتاج مواد أخرى .
6 – 15 الكيتونات
1 – مركبات صنف من المركّبات العضوية ذات الصيغة العامة R‒CO‒R، حيث R و R هما مجموعتي ألكيل.
2 – إن أبسط كيتون هو الأسيتون أو البروبانون و صيغته الكيميائية CH3COCH3.
3 – الأسيتون هو أحد نواتج أيض الدهون و لكنه تحت الظروف عادية يتأكسد بسرعة إلى ماء و ثاني أكسيد الكربون.
4 – في داء السكّري ، يتجمع الأسيتون في الجسم و يمكن الكشف عنه في البول.
5 – الكيتونات مركّبات عضوية نشطة نسبيا و تدخل في صناعة المركّبات الأخرى كما تعتبر هامة في عمليات أيض الخلية . يمكن تحضير الكيتونات من خلال أكسدة الكحولات الثانوية باستخدام عامل مؤكسد معتدل القوة .
6 – 16 الإيثرات
1 – مركبات عضوية مهمة مرتبطة برابطة وثيقة بالكحولات و تحضر مباشرة منها.
2 – الصيغة الكيميائية العامة للإيثرات هي R-O-R، حيث O ذرّة أوكسجين و R و R مجموعتين ألكيل أو عضويتين متشابهتين أو مختلفتين.
3 – من الناحية الكيميائية تعتبر المركبات الإيثيرية خاملة و مستقرة و لا تتأثر بسهولة بالقلويات أو الحموض.
4 – فأغلب المركبات الإيثرية متطايرة و خفيفة ، و سوائل قابلة للاشتعال و قابلة للذوبان في الكحولات و المذيبات العضوية الأخرى.
6 – 17 الإسترات
1 –مركبات عضوية صيغتها العامة ‘R-COO-R.
2 – تنتج عن طريق تفاعل الحموض العضوية و غير العضوية مع الكحولات .
3 – تتفكك الإسترات بفعل الماء إلى مكوناتها من الحموض و الكحولات و تفاعل التفكك هذا يسرع في وجود الحموض .
4 – فمثلا خلات الإيثيل تتفكك إلى حمض الخليك و كحول إيثيلي .
5 – يطلق على عملية تحول الحمض إلى أستر اسم الأسترة .
6 – تفاعل الإستر مع فلز قاعدي فيطلق عليه اسم التصبن .
7 – عندما يحدث تفكك للإستر نتيجة تفاعله مع الماء فإن في هذه الحالة يقال بأن الإستر تميأ .
8 – للعديد من الإسترات رائحة الفواكه و هي تحضر صناعيا و على نطاق واسع لتستخدم تجاريا كمنكهات بطعم الفواكه و كمكونات للعطور .
9 – جميع الدهون و الزيوت ( غير الزيوت المعدنية ) و أغلب المواد الشمعية هي عبارة عن خليط من الإسترات
للإسترات أهميتها من الناحية الطبية ، فنترات الإيثيل يستخدم كمدر و مضاد للحمى ، أما نترات الإيميل فتستخدم لعلاج الربو و تشنجات الصرع و مضاد للتشنج .
أما النيتروجلسيرين و نترات الإيميل كلاهما يستخدمان في تقليل ضغط الدم و توسيع الشرايين .
10 – للإسترات أهميتها من الناحية الطبية ، فنترات الإيثيل يستخدم كمدر و مضاد للحمى ، أما نترات الإيميل فتستخدم لعلاج الربو و تشنجات الصرع و مضاد للتشنج .
11 – يستخدم النيتروجلسيرين و نترات الإيميل في تقليل ضغط الدم و توسيع الشرايين .
6 – 18 الأمينات
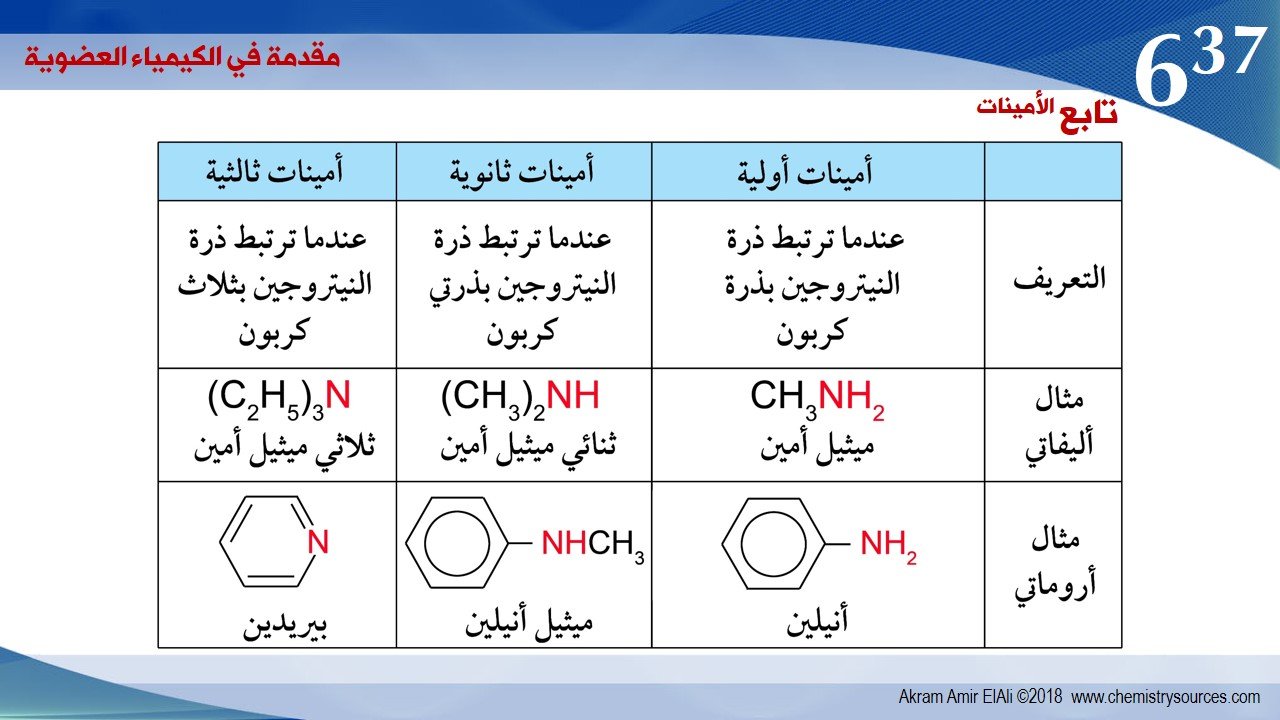
1 –الأمينات هي عبارة عن مشتقات الامونيا تستبدل فيها ذرة هيدروجين أو أكثر .
2 – الأمينات قد تكون ألكيلية (أمينات أليفاتية) أو أريلية (أمينات أروماتية)
3 – هي مركبات عضوية قاعدية لاحتوائها على ذرة النيتروجين و التي تحمل زوجا من الإلكترونات الحرة (غير مشاركة) .
تأخذ الأمينات عموما الصيغ العامة التالية RNH2 و R2NH و R3N ، حيث تعبرR عن مجموعة ألكيلية أو أريلية .
4 – تدخل المجموعات الأمينية في تركيب الحموض الأمينية المكونة للبروتينات و تدخل في تركيب الجزيئات المسؤولة عن الخصائص الوراثية للكائنات الحية كما تدخل في تركيب عدد كبير من الأدوية الطبية .
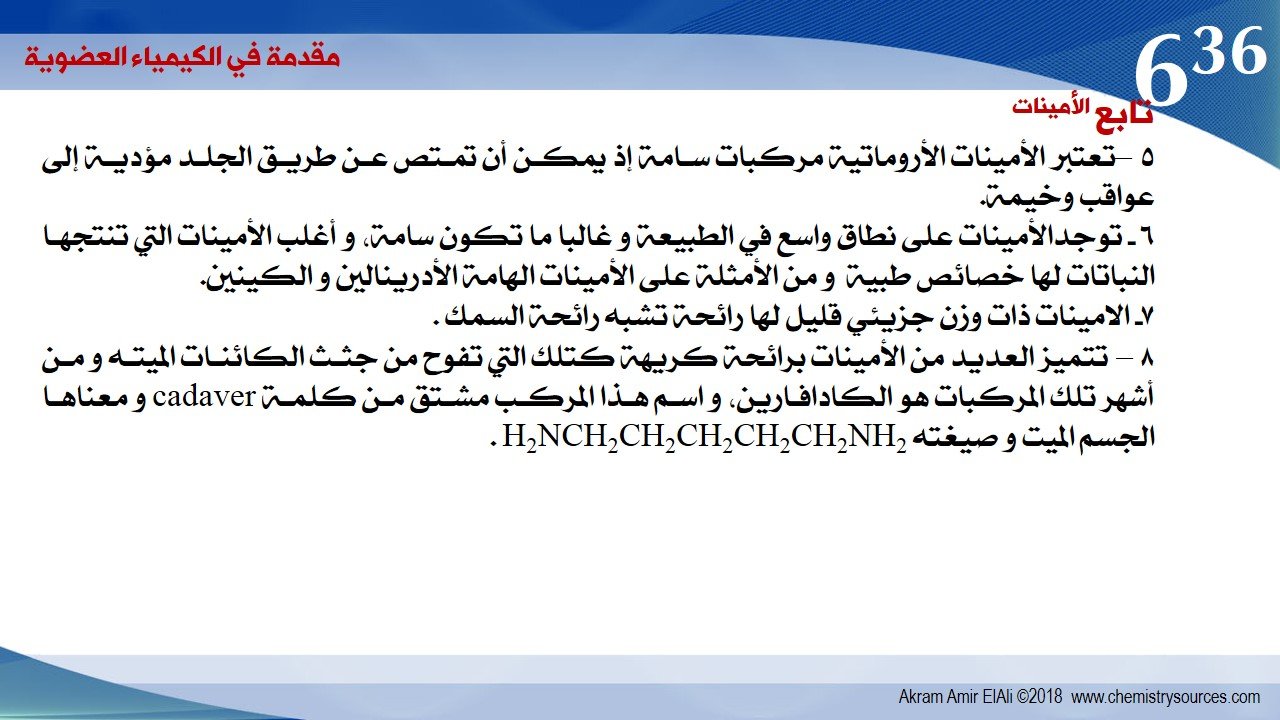
5 –تعتبر الأمينات الأروماتية مركبات سامة إذ يمكن أن تمتص عن طريق الجلد مؤدية إلى عواقب وخيمة.
6 – توجدالأمينات على نطاق واسع في الطبيعة و غالبا ما تكون سامة، و أغلب الأمينات التي تنتجها النباتات لها خصائص طبية و من الأمثلة على الأمينات الهامة الأدرينالين و الكينين.
7- الامينات ذات وزن جزيئي قليل لها رائحة تشبه رائحة السمك .
8 – تتميز العديد من الأمينات برائحة كريهة كتلك التي تفوح من جثث الكائنات الميته و من أشهر تلك المركبات هو الكادافارين، و اسم هذا المركب مشتق من كلمة cadaver و معناها الجسم الميت و صيغته H2NCH2CH2CH2CH2CH2NH2 .
6 – 19 هاليدات الألكيل
1 –هي مركبات عضوية مشتقة من الألكانات بحيث فيها تم استبدال ذرة هيدروجين أو أكثر بهالوجين مثل البروم أو الكلور أو اليود أو الفلور ، و صيغتها العامة R-X ، حيث X ذرة هالوجين.
2 – تصنف هاليدات الألكيل وفقا لنوع ذرة الكربون التي تحمل الهالوجين إلى:
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :