المجموعة السادسة – المجموعة 16 – الكالكوجينات Chalcogens
Posted in :
المجموعة السادسة – المجموعة السادسة عشر – الكالكوجينات – كالكوجين:
ملاحظة هامة حول المجموعة السادسة – المجموعة السادسة عشر – الكالكوجينات Chalcogens : إذا كنت تبحث عن ملف بوربوينت powerpoint فإجة الضغط على الرابط الآتي: سلايدات بوربوينت powerpoint كيمياء المجموعة الرئيسة – المجموعة السادسة (16) – مجموعة الأكسجين
مقدمة
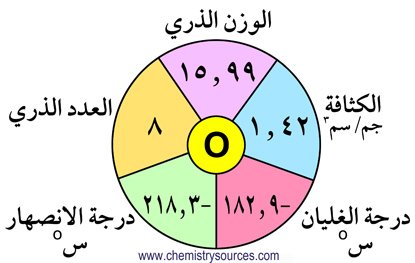
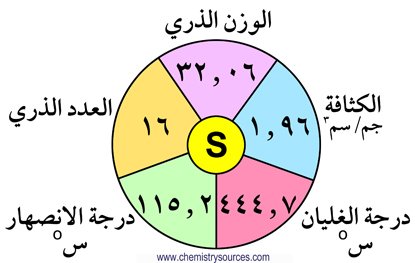
الكالكوجينات هي العناصر التي توجد في المجموعة السادسة عشر من الجدول الدوري و تشمل الأكسجين O و الكبريت S و السيلينيوم Se و التيليرويوم Te و البولونيوم Po ، و هي جميعا تنتمي إلى القطاع p من الجدول الدوري. و يطلق عليها اسم الكالكوجينات أي مُشكلات الخامات.
الخصائص العامة
1 – الأكسجين يشذ في خصائصه عن باقي عناصر المجموعة .
2 – أكثر عناصر هذه المجموعة وفرة هو الأكسجين.
3 – العناصر مثل الكبريت و السيلينيوم و التيلوريوم تكون مركبات مع الهيدروجين H2S و H2Se و H2Te ، بحيث تكون تلك العناصر كهرسالبية و ثنائية التكافؤ .
4 – العناصر مثل الكبريت و السيلينيوم و التيلوريوم تكون الأكاسيد مثل SO2 و SO3 بحيث تكون تلك العناصر كهروموجبة و رباعية أو سداسية التكافؤ .
5 – أقل عناصر هذه المجموعة وفرة هو البولونيوم.
6 – البولونيوم عنصر مشع ، الأكسجين عنصرٌ غازي بينما باقي العناصر صلبة.
7 – يزداد الحجم الذري في المجموعة كلما انتقلنا فيها من أعلى لأسفل.
8 – طاقة التأين تقل في المجموعة من أعلى لأسفل.
9 – الكهرسالبة تقل بالتدريج من الأكسجين إلى البولونيوم.
10 – تزداد الكثافة من الأكسجين إلى البولونيوم.
11 – تزداد درجتي الانصهار و الغليان كلما انتقلنا في المجموعة من أعلى لأسفل.
12 – درجتي الانصهار و الغليان للبولونيوم أقل منها للتيلوريوم و لكنها أعلى من السيلينيوم.
13 – الفارق الشاسع بين درجتي الانصهار و الغليان للأكسيجين مقارنة مع تلك للكبريت لأن الأكسجين غاز ثنائي الذرة ، بينما الكبريت جزيء صلب مكون من 8 ذرات.
14 – الخصائص الفلزية تزداد من أعلى لأسفل.
15 – الأكسجين و الكبريت و السيلينيوم لا فلزات و التيلوريوم شبه فلز والبولونيوم فلز.
16 – الأكسجين عنصر غازي ثنائي الذرة ، بينما الكبريت و السيلينيوم والتيلوريوم عناصر صلبة ثمانية الذرات.
17 – يحتل الأكسجين المرتبة الثانية من حيث الكهرسالبية بعد الفلور ، ومن المستحيل أن يظهر الأكسجين عدد تأكسد موجب إلا في حالة تفاعلة مع الفلور.
18 – ذرات عناصر تلك المجموعة تحتوي على 6 إلكترونات في الغلاف الخارجي .
19 – لجميع تلك العناصر تآصلات خاصة بها .
20 – تكافؤاتها تتراوح ما بين 2 إلى 6 .
هيدريدات المجموعة السادسة عشر
تعرف مركبات عناصر المجموعة السادسة عشر المتحدة مع الهيدروجين باسم الهيدريدات ، حيث تشكل عناصر هذه المجموعة هيدريدات من نوع H2M ، وهي مركبات تساهمية . و بخلاف الماء فإن هيدريدات عناصر هذه المجموعة هي غازات سامة ذات رائحة كريهة و ذات تركيب هندسي منحني.
إن قابلية العناصر لتكوين الهيدريدات تقل في المجموعة من الأكسجين إلى البولونيوم ، كما أن الإستقرارية الحرارية للهيدريدات تقل في المجموعة من H2O إلى H2Po و ذلك بسبب الزيادة في طول الرابطة و الإنخفاض في طاقة الرابطة مع التزامن في الزيادة في الحجم الذري.
H2O > H2S > H2Se > H2Te > H2Po
يمكن تحضير الماء من خلال الإتحاد المباشر بين الماء و الهيدروجين ، و لكن H2S و H2Se و H2Te يمكن تحضيرها من خلال تفاعل الحموض مع كبريتيدات، سيلينيدات و تيلوريدات الفلز .
FeS + H2SO4 → H2S + FeSO4
Al2Se3 + HCl → H2Se + AlCl3
Al2Se3 + H2O → H2Se + Al(OH)3
كما يلاحظ أن درجات الغليان تقل من H2O إلى H2S و من ثم ترتفع
H2S < H2Se < H2Te < H2Po < H2O
كما يلاحظ أن درجة أو نسبة تطاير المواد تزداد من H2O إلى H2S و من ثم تنخفض إلى H2Po .
وعند دراسة الماء يلاحظ بأنه سائل عند درجة حرارة الغرفة و درجة غليانه مرتفعة بسبب الرابطة الهيدروجينية في جزيء الماء. أما في هيدريدات عناصر المجموعة الأخرى فإن تواجد مثل تلك الرابطة لا يمكن توفرها بسبب الكهروسالية المنخفضة للذرة المركزية.
و عند دراسة الخواص الإختزالية و الخصائص الحمضية لهيدريدات تلك المجموعة فإننا نلاحظ بأنها تزداد من H2O إلى H2Po . أما الاستقرارية الحرارية و التي تعتمد على قوة الرابطة بين الذرة المركزية و الذرات المرتبطة بها فإنها تنخفض من H2O إلى H2Po ، حيث الانخفاض في طاقة الرابطة و الزيادة في طول الرابطة و الزيادة في حجم الذرة المركزية.
الكاتيونات ذات الصيغة +H3M
كما أنه يوجد أيون الهيدرونيوم +H3O فإنه يوجد أيضا أيونات السولفونيوم +H3S و السيلينونيــوم +H3Se ، مــن خـلال استخـدام حمــض قــوي جدا –H+SbF6 .
H2S + HF + SbF5 → H+SbF6–
و تعتبر المشتقات العضوية لأملاح السولفونيوم تلك من المركبات المعروفة جيدا ، فأملاح +Me3O نشطة جدا و تستخدم على نطاق واسع ككواشف لانتقال مجموعة الميثيل .
فوق أكسيد الهيدروجين و فوق الأكاسيد الأخرى
إن من أكثر فوق الأكاسيد شهرة هو فوق أكسيد الهيدروجين H2O2 ، و هو من المركبات الهامة جدا صناعيا نظرا لقدرته المؤكسدة المعتدلة والأهم من ذلك أن ناتج عمليةالأكسدة هو الماء أي أنه صديق للبيئة وهذه الأخيرة جعلته في هذه الفترة مهم جدا حيث يستخدم كعامل مبيض ومطهر و يدخل فى الصناعات التجميلية والدوائية وصناعة المنظفات وغيرها .
أما أملاح فوق الأكاسيد فهي أملاح تحتوي على أنيون –O22 مع عناصر المجموعة الأولى أو الثانية ، و منها فوق أكسيد الباريوم BaO2 و فوق أكسيد الصوديوم Na2O2 ، كما يعرف أيضا فوق الأكاسيد الهيدروجينية و التي تحتوي على الأنيون –OOH و منها NaOOH .
فجميع المركبات التي تحتوي على مجموعة البيروكسي تعتبر عوامل مؤكسدة قوية.
هاليدات عناصر المجموعة السادسة عشر
تُشكل عناصر المجموعة السادسة عشر هاليدات أحادية من نوع M2X2 و هاليدات ثنائية من نوع MX2 و هاليدات رباعية من نوع MX2 و هاليدات سداسية من نوع MX2 حيث M أحد عناصر المجموعة السادسة عشر ، و X أحد الهالوجينات.
عند دراسة هاليدات عناصر المجموعة السادسة عشر يلاحظ أن حالات التأكسد للكبريت و السيلينيوم و التيلوريوم في الهاليدات الأحادية هي +1 و في الهاليدات الثنائية +2 و في الهاليدات الرباعية +4 و في الهاليدات السداسية +6.
و حيث أن الكهرسالبية للفلور أكبر منها للأكسجين ، فإن مركبات الأكسجين و الفلور تعرف باسم فلوريدات الأكسجين و ليس أكاسيد الفلور. و بخلاف الأكسجين فإن باقي عناصر المجموعة السادسة عشر يمكن أن تشكل الفلوريدات السداسية. فمركب سداسي فلوريد الكبريت يمكن أن يتشكل عند تفاعل الفلور و الكبريت :
S + 3F3 → SF6
أما مركب رباعي كلوريد الكبريت فإنه يحضر عن طريق تفاعل الكبريت والكلور :
S + 2Cl2 → SCl4
فكلا المركبين لهما تركيب هندسي هرمي مزدوج بحيث يتواجد زوجا من الإلكترونات في أحد أطراف الحد الفاصل بين الهرمين ،و نوع التهجين الحاصل فيهما sp3d .
أما الهاليدات الثنائية فأفضل مثال عليها هو SCl2 ، و يمكن تحضير ثاني كلوريد الكبريت من خلال تفاعل أول كلوريد الكبريت مع الكلور :
S2Cl2 + Cl2 → SCl2
و لهذا المركب بناء هندسي زاوي و نوع التهجين الحاصل فيه sp3 .
هاليدات الكبريت و السيلينيوم و التيلوريوم-نظرة عامة
يعرف العديد من الهاليدات التي تحتوي على رابطـة أو أكثر من –S–S– أو –Se–Se– أو –Te–Te– . فأطول تلك السلاسل هي ما يعرف للكبريت ، حيث تتكون من التركيب H2Sn و قد تحتوي على ثمان ذرات من الكبريت أو أكثر . ، و هذا ليس غريبا عن الكبريت حيث يميل العنصر إلى تكويت السلاسل الطويلة. يمكن تحضير متعدد السلفانات بإضافة الحمض إلى محلول متعدد الكبريتيد
(Sn)2– + 2H+ → H–(S)n–H
حيث n تتراوح ما بين 2-6 .
أما المركبات الأخرى من نوع H2Mx ، حيث M كبريت أو سيلينيوم أو تيلوريوم فإنها غير مستقرة و تتفكك إلى H2M و إلى العنصر بحد ذاته .
H–(M)n–H → H2M + (n-1)M
يمكن تحضيرالسلاسل الطويلة لأنيونات متعدد الكالكوجينات للكبريت والسيلينيوم و التيلوريوم من خلال تفاعل الفلز القلوي M مع العنصر(باستخدام محلول لا مائي مثل الأمونيا ، أو من خلال تفاعل الملح M2E مع الكالكوجين:
4Na + 5Te → Na2Te2 + Na2Te3
Cs2S +4S → Cs2S5
هاليدات الأكسجين
يمكن للأكسجين أن يكون مع الفلور ستة مركبات مختلفة تتراوح فيها عدد ذرات الأكسجين من ذرة واحدة إلى ستة ذرات . و حيث أن الفلور دائما له حالة تأكسد سالبة ، فإن الأكسجين في هذه المركبات تكون له حالة تأكسد موجبة .من بين تلك المركبات يلاحظ بأن أكثرها استقرار هو OF2 و الذي ينتج عن تفاعل الفلور مع محلول هيدروكسيد الصوديوم المخفف . أما المركبات الأخرى فتنتج بسبب التفريغ الكهربائي في خليط من الأكسجين و الفلور عند درجات حرارة منخفضة (تقريبا -185) .
هاليدات الكبريت
يكون الكبريت مركبات عديد من الهاليدات و خصوصا مع الفلور عند حالات تأكسد مختلفة للكبريت . فالمركب S2F2 يوجد في شكلين مختلفين أحدهما يشبه تركيب فوق أكسيد الهيدروجين و الآخر يكون فيه ذرتي الكبريت في حالتي تأكسد مختلفتين.
كما يعرف للكبريت مركبات هالوجينية أخرى مثل S2Cl2 و S2Br2 هي تقع ضمن ما يعرف باسم سلسلة سلفانات الكلور و سلفانات البروم ذات الصيغة العامة SnX2 ، و هي تحتوي على روابط كبريت -كبريت يصل فيها عدد ذرات الكبريت إلى 8 ذرات .
أما ثنائي الهاليد الأكثر استقرارا للكبريت فهو SCl2 ، مقارنة مع SF2 الأقل استقرارا . و عند دراسة الهاليدات الرباعية للكبريت يلاحظ بأن أكثرها استقرارا هو SF4 و الذي يليه SCl4 . و حيث أن SF4 شديد التأثر بالرطوبة فإنه يستخدم كعامل فلورة في الكيمياء العضوية .
SF4 + H2O → SOF2 + 2HF
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :