عملية التماس لصناعة حمض الكبريتيك Contact process for manufacturing Sulfuric Acid
عملية التماس لصناعة حمض الكبريتيك Contact process for manufacturing Sulfuric Acid : عملية التمـاس هي الطريقة الحالية لإنتاج حمض الكبريتيك في تركيزات عالية و المطلوب للعمليات الصناعية. في السابق كان البلاتين يستخدم كعامل المساعد لهذا التفاعل ؛ ومع ذلك ، لأنه عرضة للتفاعل مع شوائب الزرنيخ في خام التغذية الكبريت ، فإنه يُفضل الآن أستخدام أكسيد الفاناديوم (V) (V2O5) بدلا منه . تم تسجيل براءة اختراع هذه العملية في عام 1831 من قبل تاجر الخل البريطاني بيريجين فيليبس. بالإضافة إلى كونها عملية أكثر اقتصادا لإنتاج حمض الكبريتيك المركز من عملية غرفة الرصاص السابقة ، فإن عملية التلامس تنتج أيضا أول أكسيد الكبريت و ثاني أكسيد الكبريت.
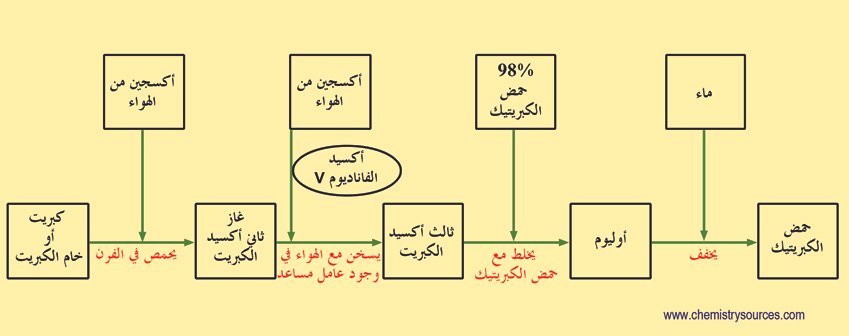
مراحل عملية التماس لصناعة حمض الكبريتيك
يمكن تقسيم عملية التماس إلى خمس مراحل:
1 – الجمع بين الكبريت والأكسجين (O2) لتشكيل ثاني أكسيد الكبريت.
2 – تنقية ثاني أكسيد الكبريت في وحدة تنقية .
3 – إضافة المزيد من الأكسجين إلى ثاني أكسيد الكبريت في وجود خامس أكسيد الفاناديوم الحفاز عند 450 درجة سيليزية و 1-2 ضغط جوي .
4 – يضاف ثالث أكسيد الكبريت المتكون إلى حمض الكبريتيك حيث يتكون الإوليوم (حمض ثنائي الكبريتيك)
5 – يضاف الإوليوم إلى الماء لتكوين حمض الكبريتيك المركز جدا.
فمن الضروري تنقية الهواء وثاني أكسيد الكبريت (SO2) لتجنب التسمم بالمحفز (أي إزالة الأنشطة التحفزية). و من ثم يتم غسل الغاز بالماء وتجفيفه بحمض الكبريتيك.و للحفاظ على الطاقة ، يتم تسخين الخليط بواسطة غازات العادم من المحول الحفاز بواسطة المبادلات الحرارية.
يتفاعل ثاني أكسيد الكبريت و الأكسجين على النحو التالي:
2 SO2(g) + O2(g) ⇌ 2 SO3(g)
وفقًا لمبدأ لو تشاتلييه ، يجب استخدام درجة حرارة منخفضة لدفع الإتزان الكيميائي نحو اليمين ، وبالتالي زيادة نسبة الانتاج. ومع ذلك ، فإن درجة الحرارة المنخفضة جدًا ستخفض معدل الانتاج إلى مستوى غير اقتصادي. و عليه لزيادة معدل التفاعل ، يتم استخدام درجات الحرارة المرتفعة (450 درجة مئوية) ، والضغوط المتوسطة (1-2 ضغط جوي) ، وأكسيد الفاناديوم (V) (V2O5) لضمان تحويل كافٍ (أكبر من 95 ٪). و يعمل الـمحفز فقط على زيادة معدل التفاعل لأنه لا يغير موضع الإتزان الديناميكي الحراري. و تشتمل آلية عمل المحفز على خطوتين:
أكسدة SO2 إلى SO3 بواسطة أيون الفاناديوم الخماسي +V5 .
2SO2 + 4V5+ + 2O2− → 2SO3 + 4V4+
أكسدة +V4 إلى +V5 :
4V4+ + O2 → 4V5+ + 2O2−
يمرر ثالث أكسيد الكبريت الساخن عبر المبادل الحراري ويتم إذابته في H2SO4 المركز في برج الامتصاص لتشكيل الأوليوم:
H2SO4 (l) + SO3 (g) → H2S2O7 (l)
لاحظ أن إذابة SO3 في الماء غير عملي بسبب الطبيعة الطارد للحرارة العالية للتفاعل فيتشكل البخار أو الضباب الحمضي بدلاً من السائل. يتفاعل الأوليوم مع الماء لتكوين H2SO4 المركز.
H2S2O7 (l) + H2O (l) → 2 H2SO4 (l)
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
طرح ممتاز جداً وشرح واضح ، نتمنى لكم التوفيق دائماً
كل التحية لك. سعدت بزيارتكم للموقع