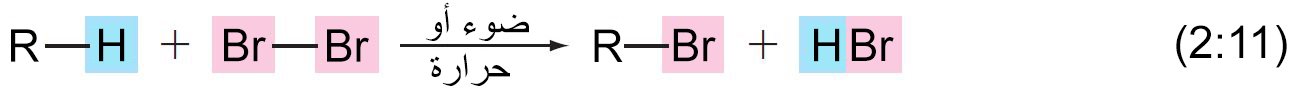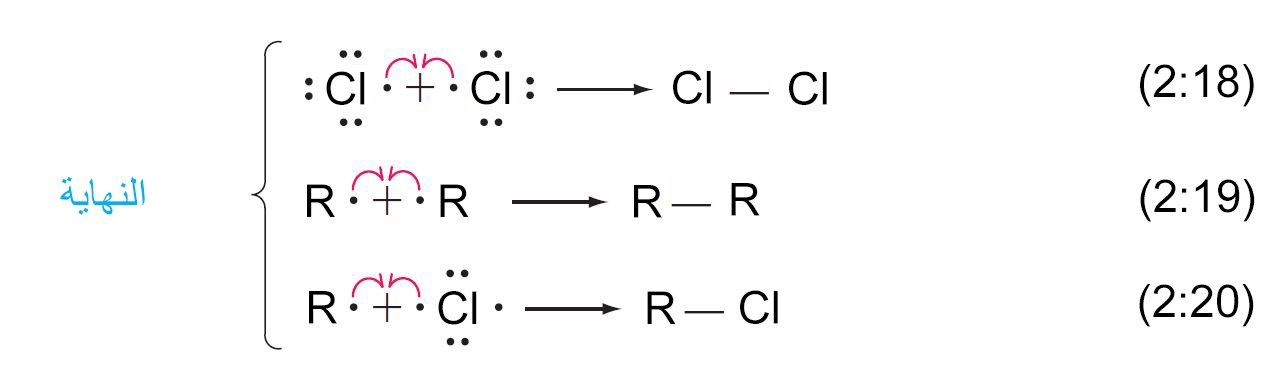الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
Posted in :
الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism : ملاحظة هامة: هذا المقال عبارة عن مختصر للفصل الثاني من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
1 – بُنيات (تراكيب) الألكانات The Structures of Alkanes
- إن أبسط الألكانات هو الميثان و له بُنية (تركيب) رباعي الأسطح المنتظم.
- يمكن كتابة المزيد من الألكانات بإضافة ذرات الكربون إلى السلسلة الكربونية و إضافة العدد المناسب من ذرات الكربون لإتمام عدد الإلكترونات في غلاف التكافؤ للكربون.
- الألكانات هي هيدروكربونات مشبعة ، تحتوي فقط على روابط أحاديةبين ذرات الكربون.
- الألكانات الحلقية تحتوي على حلقات.
- تحتوي الهيدروكربونات غير المشبعة على روابط كربون-كربون ثنائية أو ثلاثية.
- الهيدروكربونات العطرية هي مركبات حلقية مرتبطة بنائيا بالبنزين.
- الصيغة الجزيئية العامة للألكانات هي CnH2n + 2 ، حيث n هو عدد ذرات الكربون.
- تسمى الألكانات ذات سلاسل الكربون غير المتشعبة باسم الألكانات العادية أو ألكانات n.
- يختلف كل عضو في هذه السلسلة عن الذي قبله أو عن الذي بعده بمجموعة ‒CH2 -(تسمى مجموعة الميثيلين).
- تسمى سلسلة المركبات التي يتم فيها بناء الأعضاء بطريقة منتظمة ومتكررة مثل المبينة أعلاه بالسلسلة المتماثلة.
- يتمتع أعضاء هذه السلسلة بخصائص كيميائية وفيزيائية متشابهة ، والتي تتغير تدريجياً مع إضافة ذرات الكربون إلى السلسلة.
2 – بُنيات (تراكيب) الألكانات The Structures of Alkanes
- في الأيام الأولى للكيمياء العضوية ، تم إعطاء كل مركب جديد اسمًا يعتمد عادةً على مصدره أو استخدامه. أمثلة: ليمونين من ليمون ، ألفا-بينين من أشجار الصنوبر.
- حتى اليوم ، يمكن استخدام طريقة التسمية هذه لإعطاء اسم قصير وبسيط لجزيء له بنية معقدة. على سبيل المثال ، تم تسمية الكيوبان Cubane بسبب شكله.
- أصبح من الواضح أنه لا يمكن الاعتماد فقط على الأسماء الشائعة أو الدارجة وأن هناك حاجة إلى طريقة منهجية لتسمية المركبات.
- يجب أن ينتج عن قواعد نظام التسمية اسم فريد لكل مركب.
- من خلال معرفة قواعد التسمية ورؤية بنية المركب ، ينبغي للمرء أن يكون قادرا على كتابة الاسم النظامي.
- من خلال رؤية الاسم النظامي ، ينبغي للمرء أن يكون قادرا على رسم (كتابة) البنية (التركيب) الصحيح للمركب.
- تم وضع النظام المعترف بها دوليا للتسمية من قبل لجنة من الاتحاد الدولي للكيمياء البحتة والتطبيقية. تعرف باسم أنظمة IUPAC.
3 – قواعد الإيوباك لتسمية الألكانات IUPAC Rules for Naming Alkanes
- الاسم العام للمركبات الهيدروكربونية اللاحلقية المشبعة هو الالكانات، و ينتهي اسم جميع المركبات الهيدروكربونية المشبعة باللحقة -ان .
- تسمى الألكانات اللامتشعبة طبقا لعدد ذرات الكربو فيها. و يُظهر الجدول 2-1 أسماء أول 10 مركبات.
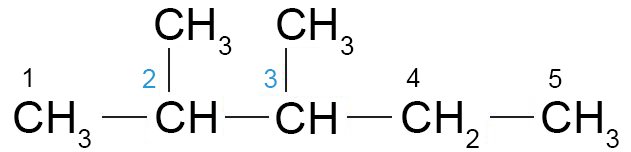
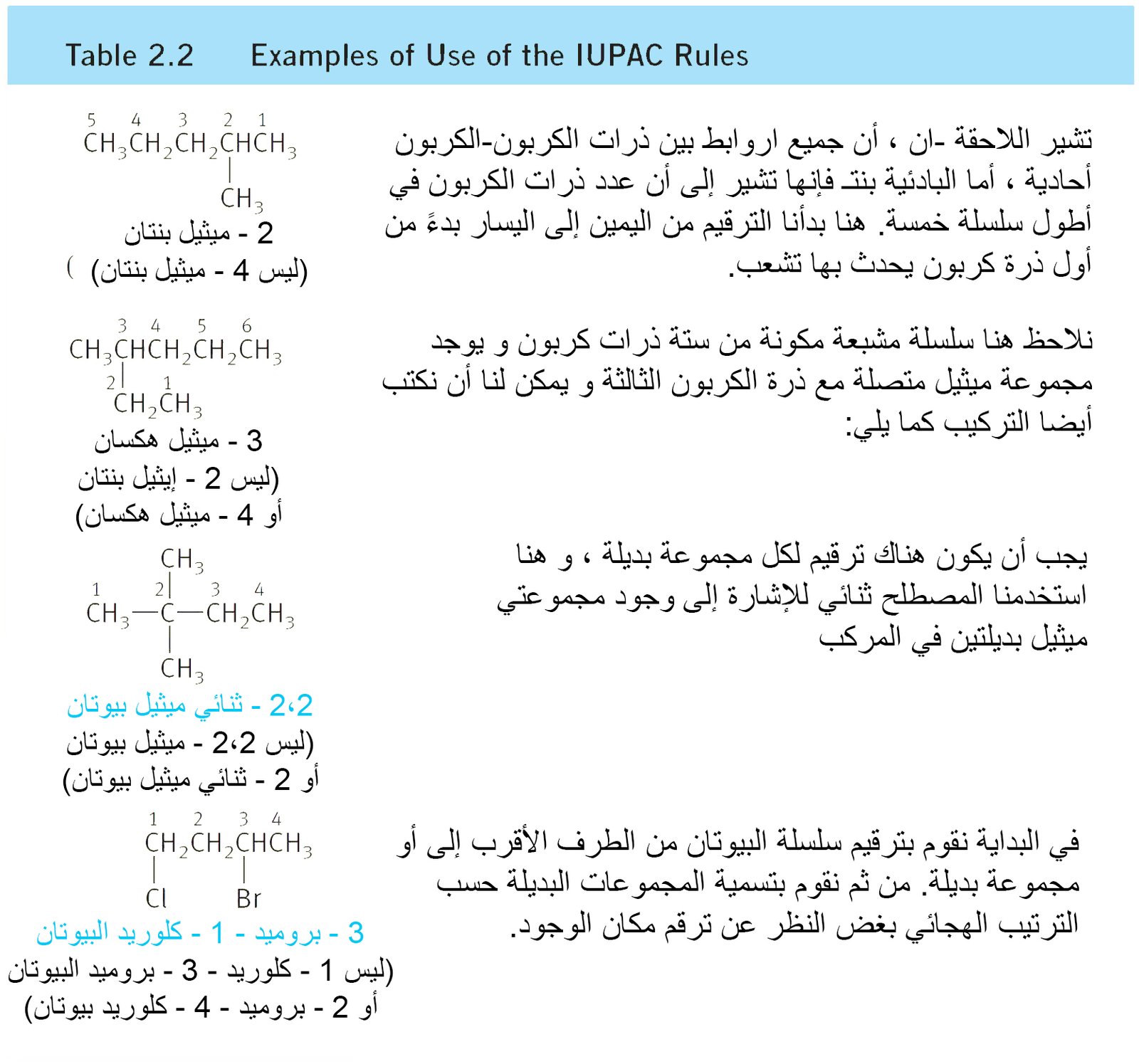
- للألكانات المتشعبة فإن أطول سلسلة ممكنة من ذرات الكربون تعتبر الجذر (الأساس).
- في الشكل أدناه نلاحظ أن أطول سلسلة مستمرة (باللون الازرق) تتكون من خمسة ذرات كربون. لذلك فإن اسم المركب ينتهي بالاسم بنتان ، حتى و لو كان عدد ذرات الكربون في المركب ككل هي سبعة ذرات كربون.
- تسمى المجموعات المرتبطة بالسلسلة الرئيسية باسم البدائل.
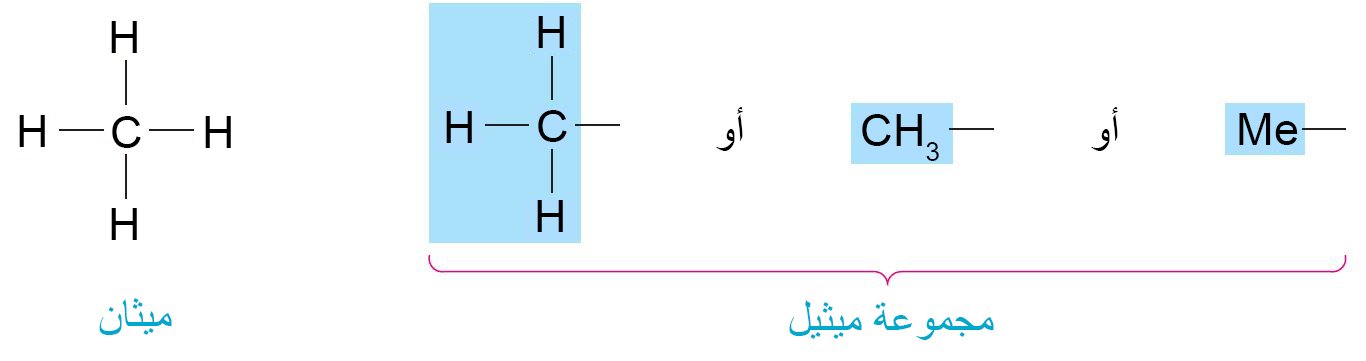
- البدائل المشبعة و التي تحتوي فقط على كربون و هيدروجين تسمى مجموعات الألكيل.
- تتم تسمية مجموعة ألكيل بأخذ اسم الألكان بنفس العدد من ذرات الكربون وتغيير النهاية من -أن إلى – يل.
- في المثال السابق ، يحتوي كل بديل على كربون واحد فقط. أي أنها مشتقة من الميثان عن طريق إزالة ذرة هيدروجين واحدة ، ويسمى بديل المكون من ذرة كربون واحدة باسم مجموعة الميثيل.
- يتم ترقيم السلسلة الرئيسة بحيث يحصل البديل الأول في السلسلة على أقل عدد ممكن. و من ثم يتم تحديد موقع كل بديل باسمه و برقم ذرة الكربون المرتبطة به.
- عندما ترتبط مجموعتين متطابقتين أو أكثر بالسلسلة الرئيسة ، يتم استخدام البادئات مثل ثنائي و ثلاثي و رباعي.
- يجب تسمية كل بديل وترقيمه ، حتى لو تم ربط بديلين متطابقين بنفس الكربون في السلسلة الرئيسة.
- فمثلا اسم المركب أدناه هو 3،2 -ثنائي ميثيل بنتان ، و يخبرنا هذا الاسم أن هناك مجموعتي ميثيل أحدهما ترتبط مع ذرة الكربون رقم2 و الثانية ترتبط مع ذرة الكربون رقم 3 في السلسلة المكونة من خمسة ذرات كربون.
- إذا كان هناك نوعان أو أكثر من البدائل المختلفة ، فسيتم سردهما أبجديًا ، باستثناء أن البادئات مثل ثنائي وثلاثي لا يتم أخذها في الاعتبار عند الترتيب الأبجدي.
- إن لعلامات الترقيم أهمية عند كتابة أسماء الأيوباك. حيث يتم كتابة أسماء الأيوباك للهيدروكربونات ككلمة واحدة. و يتم فصل الأرقام عن بعضها البعض بفواصل ويتم فصلها عن الحروف بواسطة شرطات .و لا توجد مسافة بين آخر بديل مسمى واسم الالكان الأصل و الذي يتبعه.
- لندرس الخطوات الآتية للعثور على اسم الأيوباك المقبول للألكان.
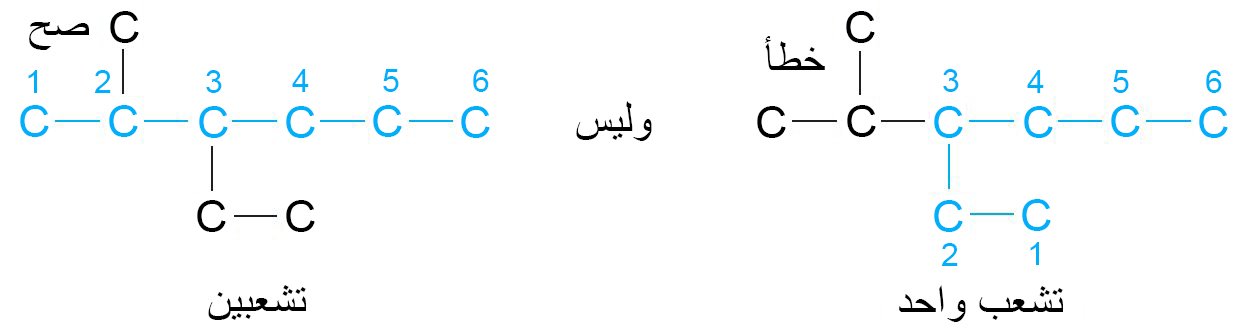
- حدد أطول سلسلة كربون متصلة.
- رقّم أطول سلسلة بحيث يبدأ طرفها بأقرب مجموعة متشعبة .
- إذا كان هناك سلسلتين لهما نفس الطول ، فاختر السلسلة التي لها تشعبات أكثر
- إذا كان هناك تشعب في طرفين متساويين بعدد ذرات الكربون، فابدأ الترقيم بحيث التشعب الثالث يحمل أقل رقم
4 – البدائل الألكيلية و الهالوجينية Alkyl and Halogen Substituents
- تسمى البدائل الألكيلية بتغيير المقطع -ان للألكانات إلى المقطع -يل .
- فمجموعة الألكيل التي تتكون من ذرتي كربون تسمى مجموعة الإيثيل و هي مشتقة من الإيثان.
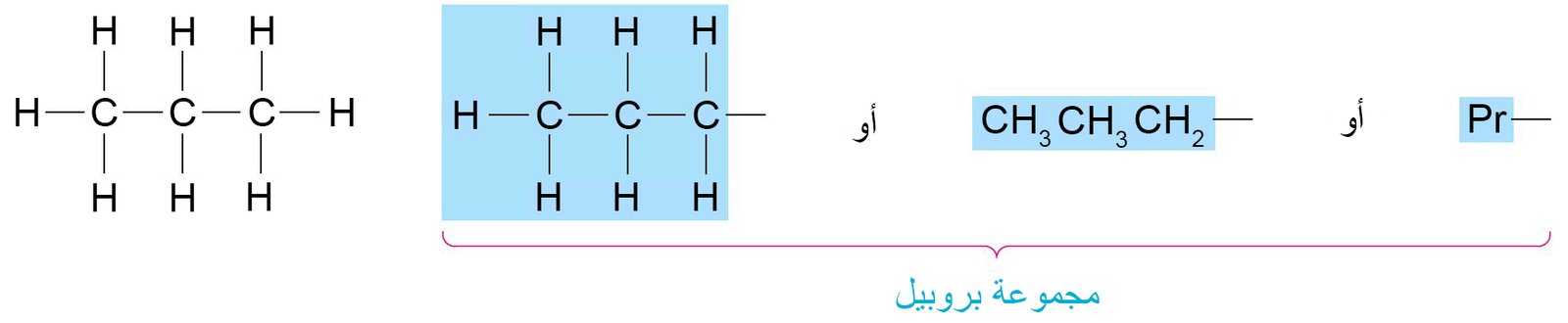
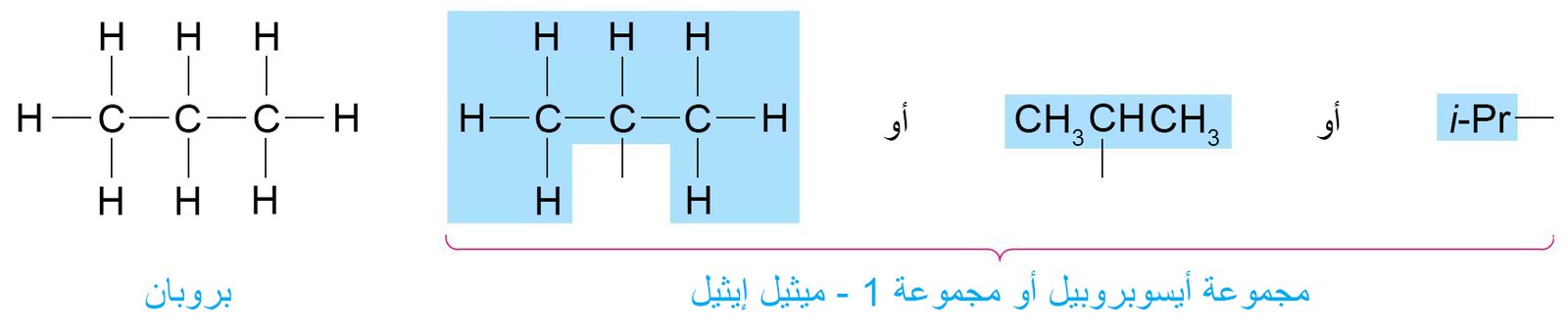
- في حالة البروبان هناك احتمالين لمجموعة الألكيل و ذلك اعتمادا على أي ذرة هيدروجين قد تم إزالتها:
- أ – إذا تم إزالة ذرة الهيدروجين الطرفية، فإن مجموعة الألكيل في هذه الحالة تسمى مجموعة البروبيل.
-
- ب- إذا تم إزالة ذرة الهيدروجين من ذرة الكربون الوسطية، فإن مجموعة البروبيل في هذه الحالة تسمى مجموعة الأيسوبروبيل (أو مجموعة 1 -ميثيل إيثيل) .
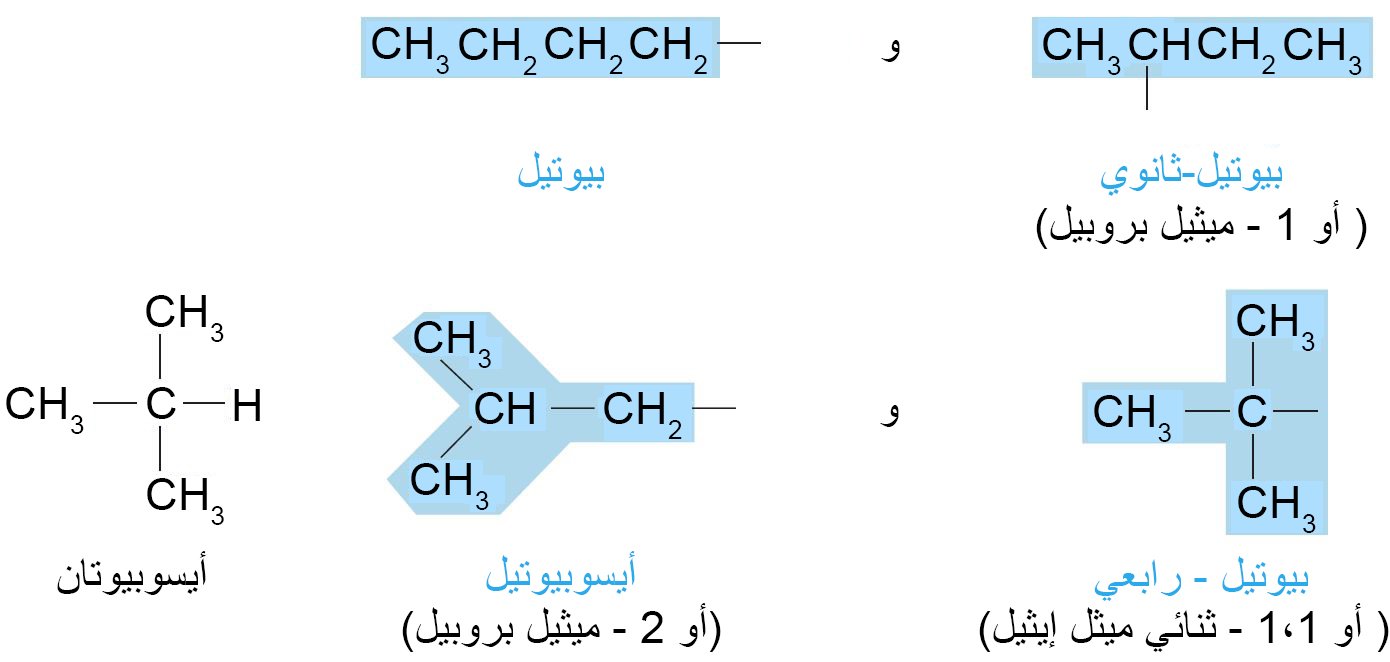
- هناك أربعة مجموعات بيوتيل كما يلي:
- يستخدم الحرف R كرمز عام لمجموعة ألكيل. لذلك فإن الصيغة R‒H تمثل أي ألكان ، و الصيغة R ‒ Cl تعني لأي كلوريد ألكيل (كلوريد الميثيل ، كلوريد الإيثيل ، وهلم جرا).
- تتم تسمية بدائل الهالوجين عن طريق تغيير النهاية -ine للعنصر إلى -o (هذه في حالة اللغة الإنجليزية)
5 – أستخدام قواعد الأيوباك Use of the IUPAC Rules
- يوضح الجدول 2-2 كيفية تطبيق قواعد الأيوباك على تراكيب معينة.
- من المهم أن تكتب بنية (تركيب) اسم الأيوباك المعطى لك.
- في هذه الحالة ، اكتب أولاً أطول سلسلة كربون ورقمها، ثم أضف البدائل إلى ذرات الكربون الصحيحة ، وأملأ الصيغة في النهاية بالعدد الصحيح من ذرات الهيدروجين في كل كربون.
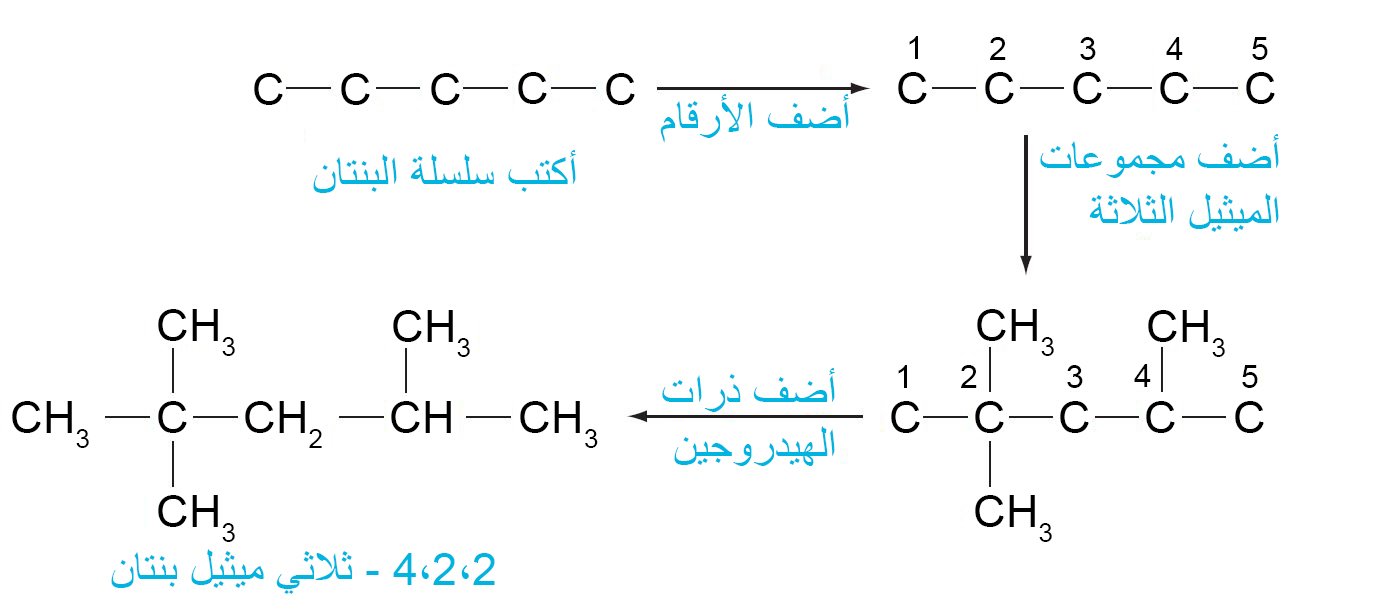
- على سبيل المثال ، لكتابة الصيغة لـ 4،2،2 -ثلاثي ميثيل بنتان 2،2،4-trimethylpentane ، نقوم بالخطوات الآتية:
6 – مصادر الألكانات Sources of Alkanes
- إن أهم مصدرين طبيعيين للألكانات هما البترول والغاز الطبيعي.
- و البترول هو عبارة عن خليط سائل معقد من المركبات العضوية الكثير منها ألكانات أو ألكانات حلقية.
- يتكون الغاز الطبيعي أساسًا من الميثان (حوالي 80٪) والإيثان (من 5٪ إلى 10٪) ، مع كميات أقل من بعض الألكانات العليا.
- البروبان هو المكون الرئيسي لغاز البترول المسال (LPG)، ويستخدم كمصدر للوقود للتدفئة المنزلية والتجارية ، والطبخ.
- أصبح الغاز الطبيعي مصدرًا للطاقة يمكنه التنافس مع النفط وربما تجاوزه.
- يتم توزيع الغاز الطبيعي في جميع أنحاء العالم عبر ناقلات ضخمة أو عبر خطوط أنابيب الغاز.
7 – الخصائص الفيزيائية للألكانات و القوى بين الجزيئية غير الرابطة Physical Properties of Alkanes and Nonbonding Intermolecular Interactions
- الألكانات لا تذوب في الماء لأن جزيئات الماء قطبية بينما جزيئات الألكان غير قطبية.
- بسبب قطبية الرابطة O ‒ H ، تتكون شحنة جزئية موجبة على ذرة الهيدروجين و تتكون شحنة جزئية سالبة على ذرة الأكسجين. ونتيجة لذلك ، تنجذب ذرات الهيدروجين في جزيء الماء بقوة إلى ذرات الأكسجين في جزيئات الماء الأخرى ، ويسمح الحجم الصغير لذرات الهيدروجين للجزيئات بالاقتراب من بعضها البعض عن كثب. و هذا الجذب الخاص يسمى الرابطة الهيدروجينية.
- عندما يذوب جزيء في الماء ، يجب أن يحدث ما يلي:
- أ. كسر القوى بين الجزيئية داخل المادة. و في حالة الألكانات ، هذه هي قوى فان دير فال Van der Waals.
- ب. كسر القوى بين الجزيئية في الماء بحيث يمكن احتواء المادة بين جزيئات الماء، أي: الروابط الهيدروجينة.
- يتطلب كسر أي من عوامل الجذب هذه طاقةً ، على الرغم من أن كمية الطاقة اللازمة لكسر قوى فان دير فال في شيء مثل الميثان لا تكاد تذكر ، لكن هذا ليس صحيحا بالنسبة للروابط الهيدروجينية في الماء
- تحتوي العديد من الأوراق والفواكه على غلاف شمعي واقي غالبًا ما تشكل الألكانات جزءًا منه. وتتمثل الوظيفة الرئيسية لشموع النبات في منع فقدان الماء من الأوراق أو الفاكهة.
للألكانات درجة غليان منخفضة ، لأنها جزيئات غير قطبية. - نظرًا للحركة المستمرة للجزيء غير قطبي ،فإنه يمكن أن تتوزع الإلكترونات الموجودة فيه بشكل غير متساوٍ داخل الجزيء ، مما يتسبب في أن يكون للجزيء أطرافا جزئية موجبة وسالبة ، وهذا يسبب على استقطاب الجزيء مؤقتًا وبالتالي تنجذب الجزيئات إلى بعضها البعض . وتسمى قوى الترابط هذه بين الجزيئات بقوى فان دير فال.
- نظرًا لأنها عوامل تجاذب ضعيفة ، فإنه تتطلب عملية فصل الجزيئات عن بعضها طاقة قليلة نسبيًا ، و بالتالي فإن درجات الغليان لهذه المركبات منخفضة نسبيًا.
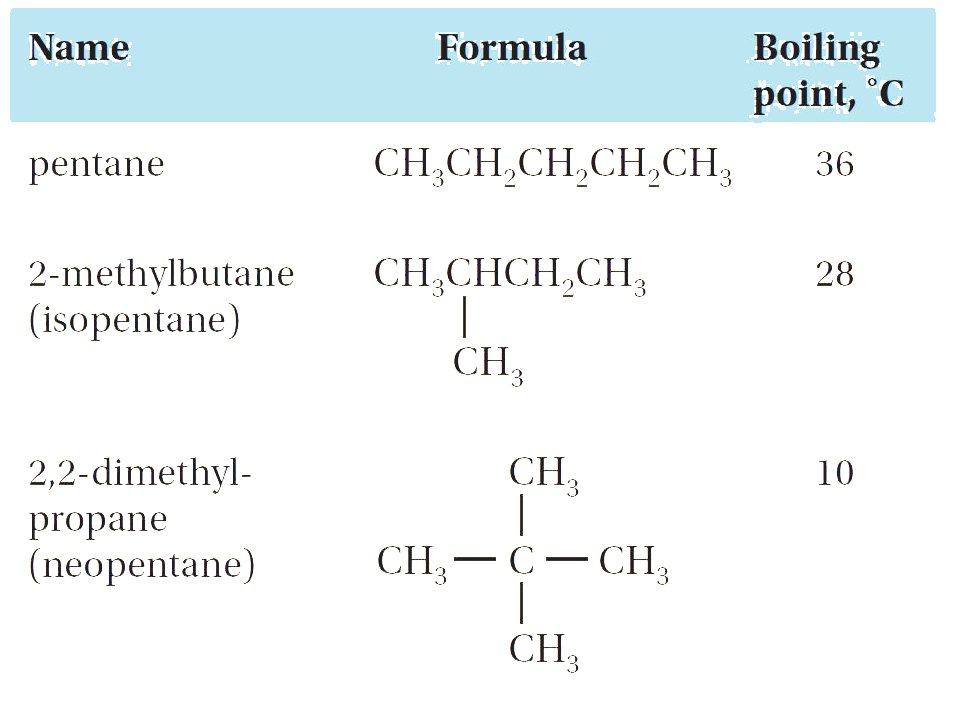
- و نظرًا لأن قوى التجاذب هذه لا يمكنها العمل إلا على مسافات قصيرة بين أسطح الجزيئات ، فإن درجات غليان الألكانات تزداد كلما زاد طول السلسلة و تنخفض عندما تصبح السلاسل متفرعة و الشكل أكثر كرويةً تقريبًا.
- على الرغم من أن جزيئات البنتان على شكل خط مستقيم لها نفس الوزن الجزيئي ، فإن مساحة سطحها متاحة للتلامس فيما بينها أكثر من الجزيئـــــات كرويـــــــة الشكل 2،2 -ثنائي ميثيل البروبان.
- لذلك ، فإن لجزيئات البنتان المزيد من قوى فان دير فال للتجاذب (وبالتالي ، درجة الغليان الأعلى) مقارنة بجزيئات 2،2 -ثنائي ميثيل البروبان.
- تعتبر روابط الهيدروجين و قوى تجاذب فان دير فال مثال على التجاذبات بين الجزيئية غير الرابطة.
- هذه الأنواع من التفاعلات لها عواقب مهمة على خواص وسلوك الجزيئات ، وسوف نواجه المزيد من الأمثلة ونحن نواصل استكشاف كيمياء فئات مختلفة من المركبات العضوية.
8 – هيئات (التشكيلات الدورانية) الألكانات Conformations of Alkanes
- غالبا ما تؤثر أشكال الجزيئات على خصائصها.
- يمكن أن يكون للإيثان عدد لا حصر له من الأشكال نتيجة تدوير ذرة كربون واحدة بالنسبة لذرة الكربون الأخرى.
- تسمى هذه الاشكال الهيئات (التشكيلات الدورانية) .
- الهيئات هي مصاوغات فراغية (مجسمة) ، أي أنها مصاوغات ترتبط فيها الذرات بنفس الترتيب ولكن يتم توزيعها بشكل مختلف في الفضاء.
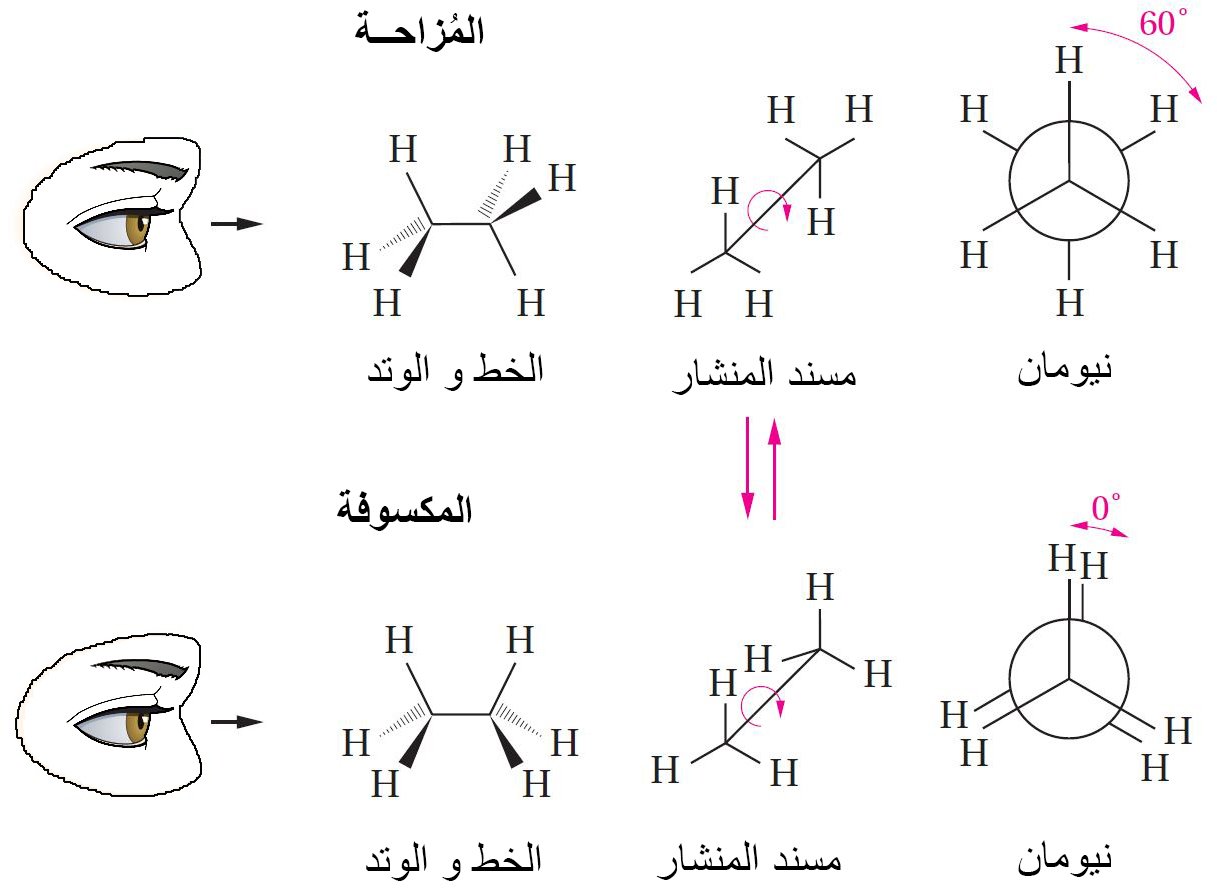
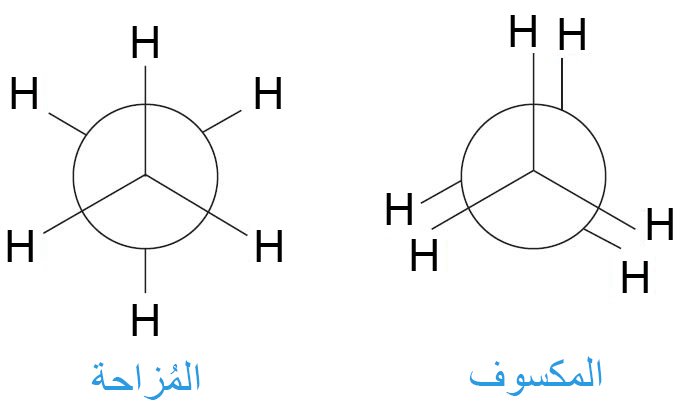
- في الهيئة المزاحة للإيثان، فإن كل رابطة كربون-هيدروجين في ذرة كربون تقطع الزاوية H-C-H في ذرة الكربون الثانية.
- في التشكيل الدوراني المكسوف تكون جميع روابط H-C في ذرتي الكربون الأمامية و الخلفية متطابقة على بعضها البعض.
- من خلال تدوير ذرة كربون 60 درجة بالنسبة لذرة الكربون الأخرى فإنه يمكن التبادل بين الهيئتين المزاحة والمكسوفة.
- يمكن اعتبار الهيئتان المزاحة و المكسوفة للإيثان بأنهما متبادلتان لأن أي منها ممكن أن يتحول إلى الآخر من خلال دوير الرابطة الكربون -الكربون.
- كلا الهيئتين ليستا مستقرتين بالتساوي.
- الهيئة المزاحة أكثر أستقرارا من بين هيئات الإيثان ، بينما الهيئة المكسوفة الأقل استقرارا.
عند درجة حرارة الغرفة فإن الهيئة المزاحة هي التشكيل الوحيدة و الموجودة فعليا.
9 – تسمية و هيئة الألكان الحلقي Cycloalkane Nomenclature and Conformation
- الألكانات الحلقية هي هيدروكربونات مشبعة و التي تحتوى على حلقة واحدة من ذرات الكربون على الأقل.
- يتم تسمية الألكانات الحلقية بإضافة المقطع حلقي بعد (في حال التسمية بالعربية ، و لكن في الإنجليزية تكون قبل) اسم الألكان المقابل لعدد ذرات الكربون في الحلقة.
- يتم تسمية البدائل الألكيلية و الهالوجينية و المرتبطة بالحلقة كما هو معهود.
- إذا كانت هناك بديلة واحدة فإنه لا داعي لتحديد مكانها على الحلقة.
- أما إذا كانت هناك أكثر من بديلة فإنه في هذه الحالة يجب ترقيمها.
- و دائما يبدأ ترقيم البديلة الأولى من ذرة الكربون رقم 1، و من ثم يتم ترقيم البدائل تباعا على أن يكون ترقيمها أقل ما يمكن.
- مع وجود أكثر من مجموعة بديلة ، فإن تلك التي لها أولوية هجائية دائما تحتل الرقم 1 (يبدأ الترقيم من عندها).
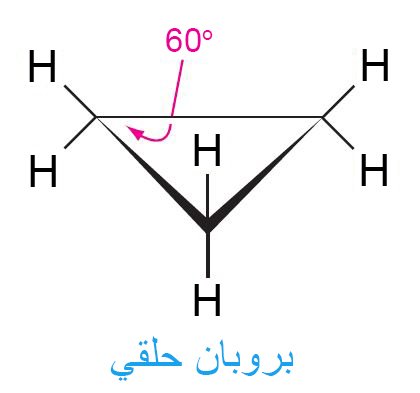
- تقع ذرات الكربون الثلاث في البروبان الحلقي على مستوى واحد ، و تكون قيمة الزاوية C-C-C هي 60 درجة فقط ، و هي أقل بكثير من تلك الزاوية المعروفة للهيكل رباعي الأسطح و التي قيمتها 109.5 درجة.
- تقع ذرات الهيدروجين فوق أو تحت مستوى ذرة الكربون و تكون ذرات الهيدروجين على ذرات الكربون المجاورة مكسوفة.
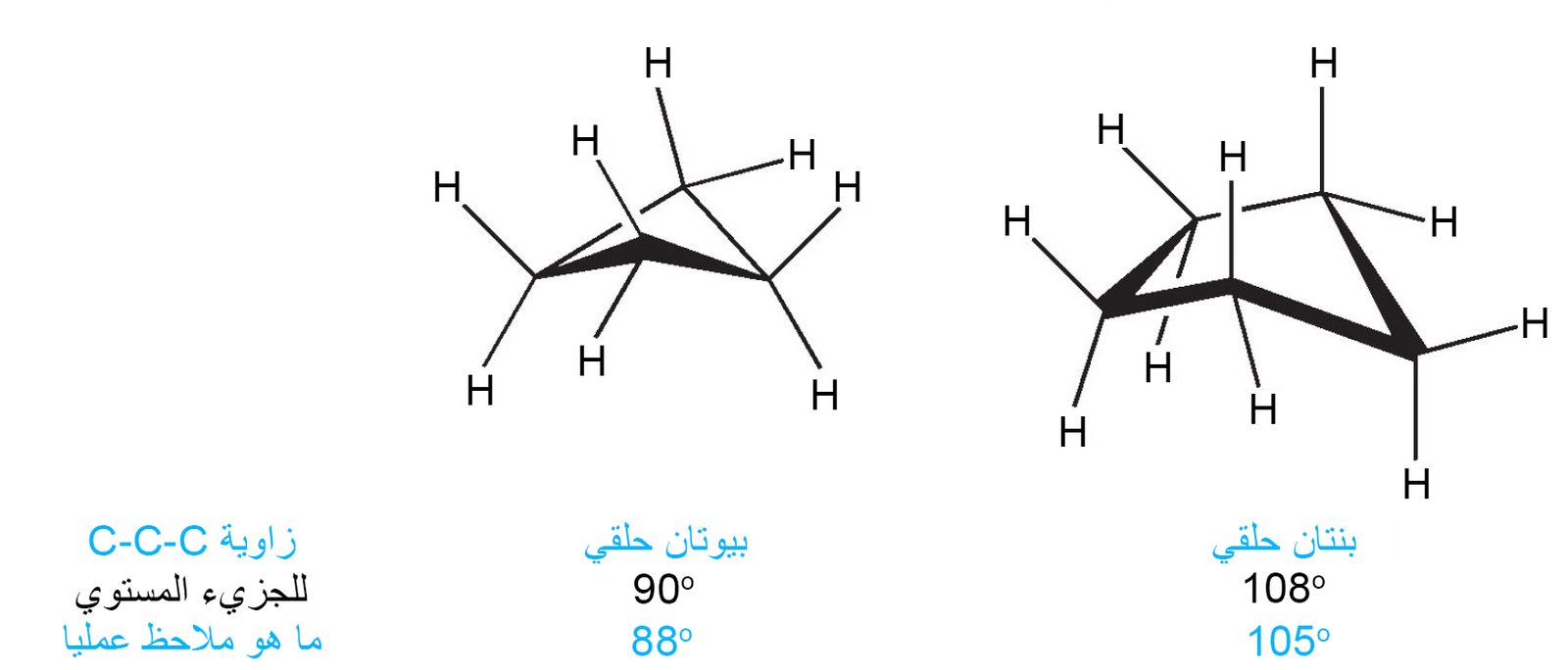
- تعتبر الألكانات الحلقية التي تحتوي على أكثر من ثلاث ذرات كربون غير مستوية ولها «انبعاج».
- في البيوتان الحلقي و البنتان الحلقي فإن الإنبعاج يسمح للجزيء بتبني التشكيل الدوراني الأكثر استقرارًا.
- يقلل الانبعاج من الإجهاد من خلال جعل زوايا C-C‒C أصغر قليلاً مما لو كانت الجزيئات مستوية ؛
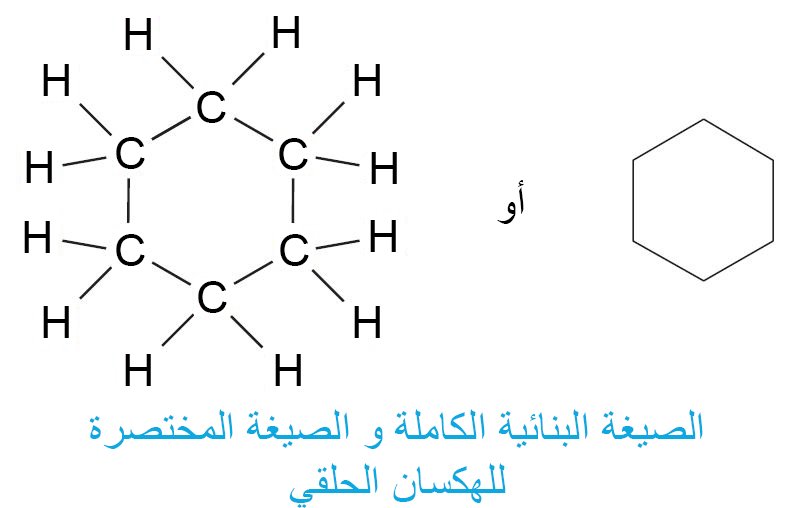
- تمت دراسة الحلقات المكونة من ستة ذرات كربون بتفصيل كبير لأنها شائعة جدًا في الطبيعة.
- الهكسان الحلقي هو مثال على الحلقة المكونة من ستة ذرات كربون ، لذلك فإن هيئة الأكثر تفضيلًا للهكسان الحلقي هو التشكيل الدوراني الكرسي ، وهو ترتيب تكون فيه جميع زوايا C‒C‒C تساوي 109.5 ° وتكون كل ذرات الهيدروجين الموجود على ذرات الكربون المتجاورة مُزاحة تماما.
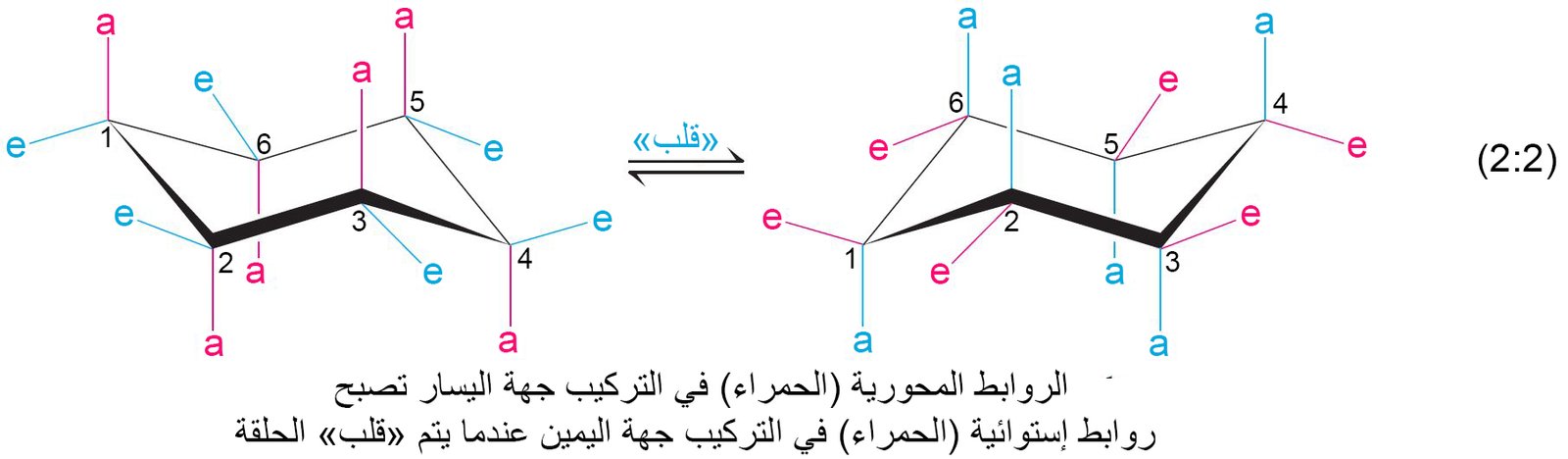
- في هيئة الكرسي ، تقسم ذرات الهيدوجين الموجودة في الهكسان الحلقي إلى مجموعتين : المحورية والاستوائية.
- تقع ثلاث ذرات هيدروجين محورية فوق مستوى ذرات الكربون بينما تقع ذرات الهيدروجن الثلاث الاخرى المحورية تحت مستوى ذرات الكربون.
- أما ذرات الهيدروجين المحورية فجميعها يقع ضمن مستوى ذرات الكربون تقريبا.
- عند درجة حرارة الغرفة تكون عملية التقلب بيت الهيئتبن الظاهرتين في المعادلة 2-2 سريعة جدا بحيث لا يمكن التفريق بينها ، و لكن عند درجات الحرارة المنخفضة جدا يمكن التفريق بينها من خلال مطيافية الرنين المغناطيسي NMR .
- في هيئة الكرسي للهكسان الحلقي، حيث أن ذرات الهيدروجين المحورية قريبة من بعضها البعض، فإن المجموعة البديلة الكبيرة (مثل مجموع الميثان) تحل محل إي ذرة هديروجين استوائية.
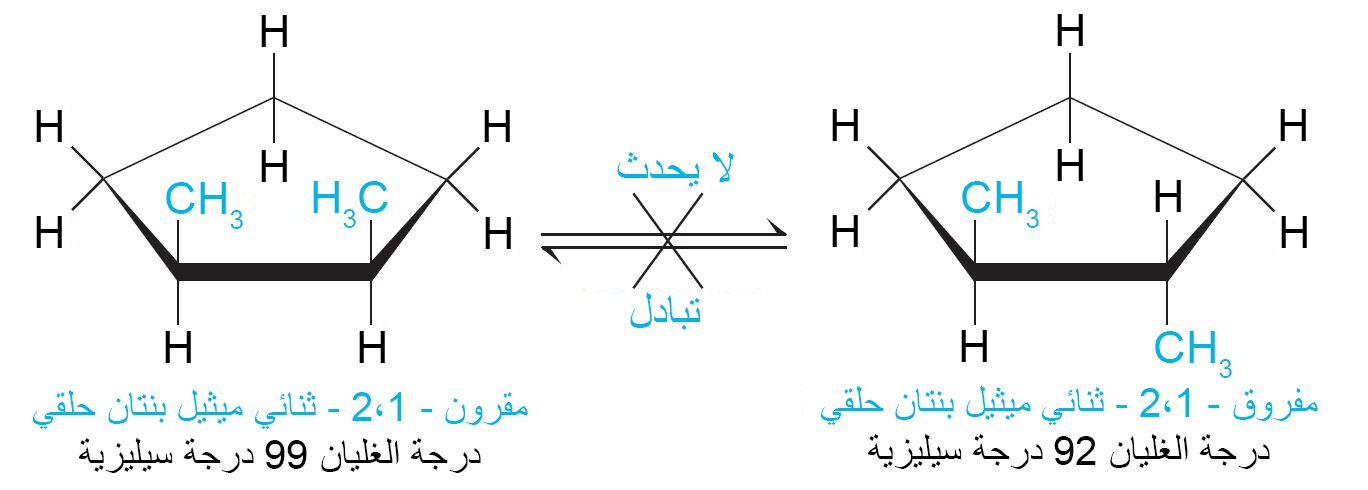
10 – التصاوغ المقرون و المفروق في الألكانات الحلقية Cis-Trans Isomerism in Cycloalkanes
- المصاوغات المقرونة – المفروقة للألكانات الحلقية هي نوع من المتصاوغات تعرف باسم المتصاوغات الهندسية (البنائية) ، بحيث إن وجدت البدائل في نفس الجانب في الحلقة فإن التصاوغ يسمى مقرون و إن وجدت البدائل في جانبين متعاكسين في الحلقة فإن التصاوغ يسمى مفروق.
- تختلف مصاوغات المقرون-المفروق عن بعضها البعض فقط في الطريقة التي يتم بها وضع الذرات أو المجموعات في الفراغ. و هذا الاختلاف يكفي لمنحها الخصائص الفيزيائية والكيميائية المختلفة.
- لا يمكن التحويل من متصاوغ المقرون إلى متصاوغ المفروق من خلال التدوير حول روابط الكربون-الكربون.
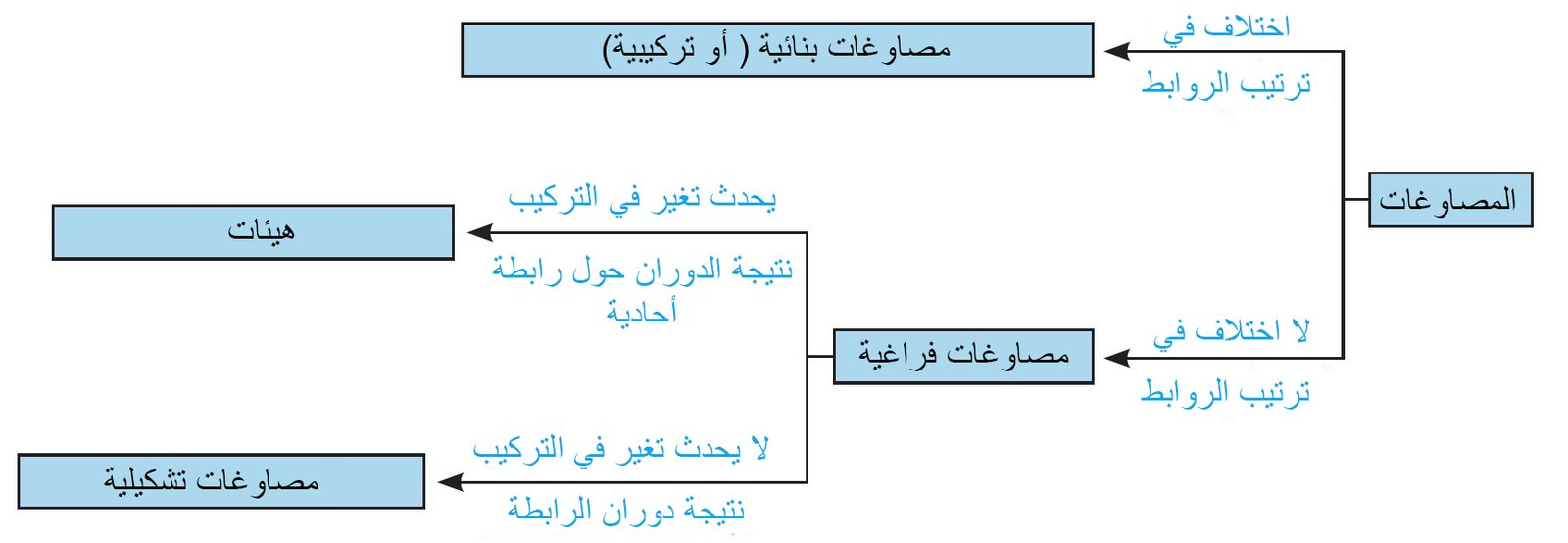
11 – ملخص التصاوغ Summary of Isomerism
- إذا كانت أنماط الترابط مختلفة ، فإن المركبات عبارة عن مصاوغات بنائية ، على سبيل المثال الإيثانول و الميثوكسي ميثان
- إذا كانت أنماط الترابط هي متشابهة ، فإن المركبات عبارة عن مصاوغات فراغية ، على سبيل المثال الأشكال المزاحة و المكسوفة للإيثان أو المتصاوغات المقرون-المفروق لـ 2،1 -ثنائي ميثيل البنتان الحلقي.
- إذا كانت المركبات مصاوغات فراغية، وإذا كان دوران الرابطة الواحدة سهل بحيث يتم التحول من متصاوغ إلى آخر فإننا نسميهما الهيئات (التشكيلات الفراغية).
- إذا كان بالإمكان التحويل من متصاوغ لآخر فقط من خلال كسر الروابط وإعادة تشكيلها ، فإننا نسميها المتصاوغات البنائية (التكوينية) .
12 – تفاعلات الألكانات Reactions of Alkanes
- لأن جميع الروابط في الألكانات أحادية تساهمية و غير قطبية، فإن الألكانات إلى حد ما يمكن اعتبارها بأنها خاملة.
12 . أ – الأكسدة و الاحتراق، الألكانات كوقود
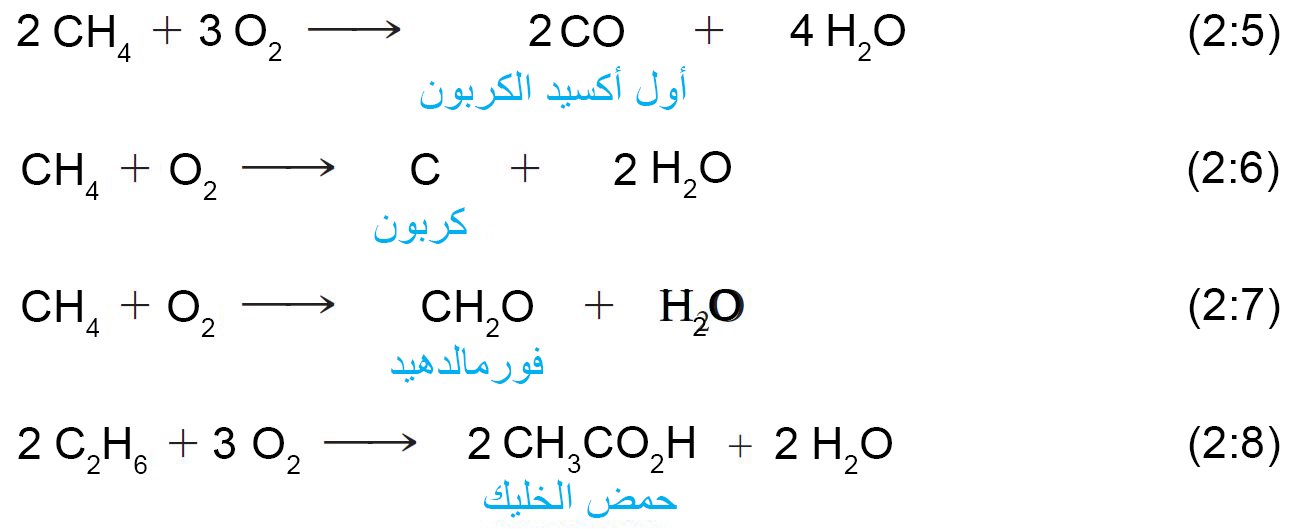
- بوجود فائض من الأكسجين ، فإن الألكانات تشتعل لتكوين ثاني أكسيد الكربون والماء. و الأهم من ذلك ، أن تلك التفاعلات ينتج عنها حرارة كبيرة (طاردة للحرارة).
- إذا لم يتوفر الأكسجين بصورة كافية للاحتراق التام للهيدروكربون ، فقد تحدث أكسدة جزئية ، كما هو موضح في المعادلات من 2.5 إلى 2.8.
- كلما كانت روابط C-O في المركب أكثر ، كان الكربون أكثر أكسدة.
- كلما كانت روابط C-H في المركب أكثر ، كان الكربون أكثر اختزالا.
12 .ب – هلجنة الألكانات
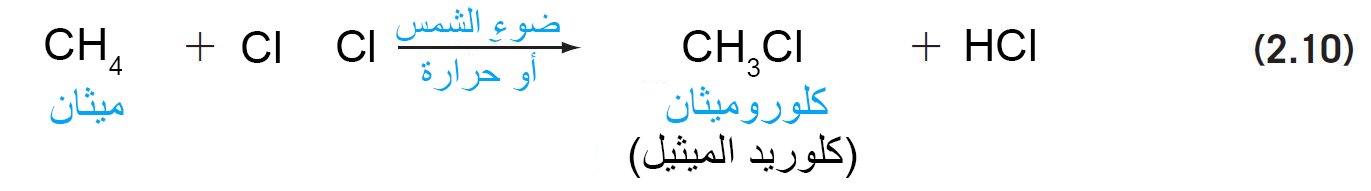
- عندما يتم تخزين خليط من ألكان وغاز الكلور في ضوء الشمس أو عند درجات حرارة عالية ، فإنه يتم استبدال ذرة هيدروجين واحدة أو أكثر من الألكان بذرات الكلور.
- يعرف هذا التفاعل بالتحديد باسم الكلورة ، و يسمى هذا النوع من التفاعلات باسم تفاعل الاستبدال.
- يحدث تفاعل مماثل ، يسمى البرومة ، عندما يكون مصدر الهالوجين هو البروم.
- إذا كان هناك المزيد من الهالوجين، فيمكن أن يستمر التفاعل أكثر للإنتاج منتجات متعددة الهلجنة.
- مع الألكانات ذات السلسلة الطويلة ، يمكن الحصول على خليط من المنتجات.
- عندما يتم هلجنة الألكانات الكبيرة ، يصبح مزيج المنتجات أكثر تعقيدًا ؛ و يصبح من الصعب فصل المصاوغات كل على حدة والحصول عليها نقية ، لذا فإن الهلجنة لا تميل إلى أن تكون وسيلة مفيدة لتصنيع هاليدات ألكيل معينة. ومع الألكانات الحلقية حيث تكون كل ذرات الهيدروجين مكافئة لبعضها البعض ، فإنه يمكن الحصول على منتج عضوي نقي واحد:
2 : 13 ميكانيكية تسلسل الشقوق الحرة للهلجنة The Free-Radical Chain Mechanism of Halogenation
- إن ميكانيكية التفاعل هي وصف خطوة بخطوة لعمليات تكسير الروابط و صنع الروابط التي تحدث عندما تتفاعل المواد مع بعضها البعض لتكوين النواتج.
- تحدث الهلجنة عبر سلسلة من تفاعلات الشقوق الحرة.
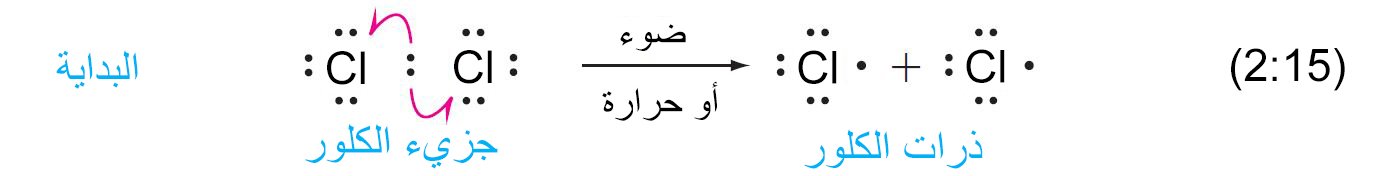
- تتمثل خطوة بدء التسلسل في تكسير جزيء الهالوجين إلى ذرتين من الهالوجين.
- إن الرابطة Cl-Cl أضعف من الرابطة C-H أو الرابطة C-C، وبالتالي فهي أسهل رابطة للكسر عن طريق توفير الطاقة الحرارية. و عندما يكون الضوء هو مصدر الطاقة ، فإن جزيء الكلور (Cl2) يمتص الضوء المرئي ولكن الألكانات لا تمتصه. وبالتالي تكسر الرابطة Cl-Cl أولاً.
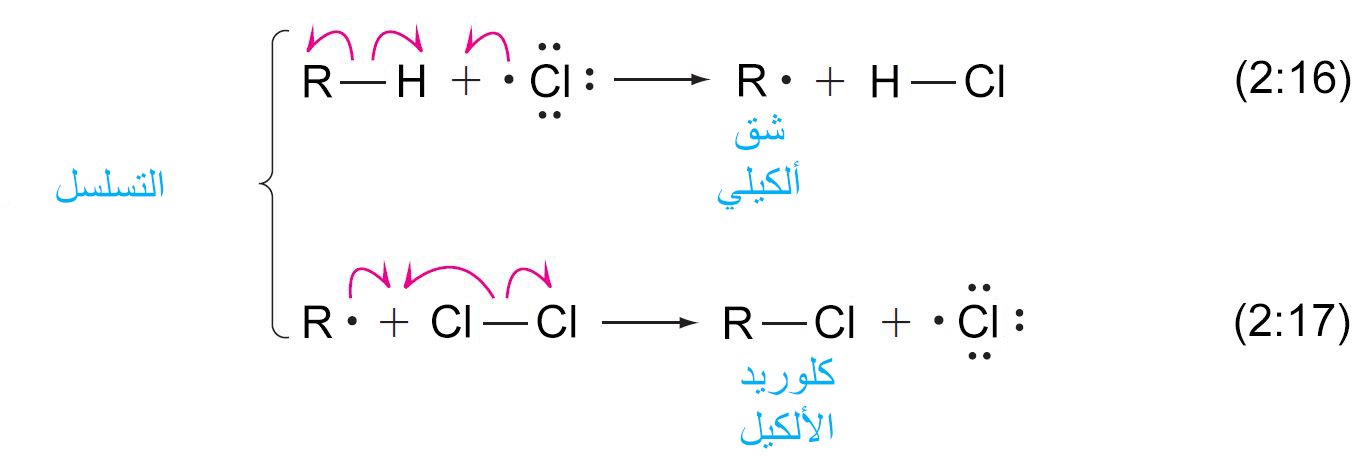
- و يمكن توضيح خطوات انتشار التسلسل كما يلي:
- إن ذرات الكلور نشطة جدا ، لأنها تحتوي على غلاف تكافؤ غير مكتمل.
فهي إما أن تتحد لتشكل جزيئات الكلور أو تجذب ذرة الهيدروجين من جزيء الألكان لتكوين كلوريد الهيدروجين وجذر ألكيل • R. - من المرجح أن تقوم بمهاجمة ذرة الهيدروجين الطرفية في رابطة C ‒ H.
كما أن جذر الألكيل • R المتشكل في الخطوة الأولى من التسلسل (معادلة 2.16) نشط للغاية أيضا. - فإذا تفاعل جذر الألكيل بجزيء الكلور (Cl2) ، فقد يشكل جزيء كلوريد الألكيل وذرة كلور (كما هو الحال مثلا في المعادلة 2.17).
- يمكن أن تتفاعل ذرة الكلور الناتجة عن تلك الخطوة للتفاعل بشكل متسلسل مع جزيئات الألكان الأخرى.
- في كل خطوة انتشار للتسلسل ، يتم استهلاك شِق أو جذر (أو ذرة) ، ولكن في نفس الوقت يتم تشكيل شِق (أو ذرة) آخر و يستمر التفاعل بالتسلسل.
- يتم استهلاك جميع المواد المتفاعلة تقريبًا ، ويتم تشكيل جميع المنتجات تقريبًا في هذه الخطوات.
- و نظرًا لأن العديد من جزيئات الكلور تتفاعل لتكوين ذرات الكلور في خطوة بدء التسلسل ، فإن العديد من التسلسلات تبدأ في وقت واحد.
- إذا تم الجمع بين أي شقين (جذرين) ، سيتم إنهاء التسلسل. و هناك ثلاث خطوات ممكنة لإنهاء السلسلة كما هو مبين أدناه
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :