ما هو الجزيء؟
يُعرَّف الجزيء بأنه اتحاد متعادل كهربائيًا مكون من ذرتين أو أكثر و ترتبط مع بعهضا البعض بواسطة روابط كيميائية. فيما يلي أمثلة على الجزيئات وإلقاء نظرة على الفرق بين الجزيئات والمركبات والأيونات.
الفرق بين الذرة و الجزيء
الذرة هي أصغر وحدة في العنصر، و تحتوي جميع ذرات العنصر الواحد على نفس عدد البروتونات، كما لا يمكن تقسيم الذرات باستخدام أي طريقة كيميائية. في المقابل ، الجزيء هو وحدة لمادة نقية. و يتكون الجزيء من أكثر من ذرة واحدة، كما يحتوي جزيء ما على تركيبة ثابتة ، مما يعني أن نسبة الذرات المختلفة هي نفسها دائمًا.
كما تعرض الجزيئات المتطابقة أيضًا نفس الخصائص الكيميائية. و على عكس الذرات فإنه يمكن للجزيئات أن تتفكك عن طريق التفاعلات الكيميائية، و يؤدي كسر كل الروابط الكيميائية في الجزيء إلى مجموعة من الذرات.
أمثلة على الجزيئات
قد يتكون الجزيء من ذرتين أو أكثر لعنصر واحد أو ذرات من عناصر مختلفة. فيما يلي بعض الأمثلة على الجزيئات:
- H2O (ماء)
- N2 (نيتروجين)
- O3 (أوزون)
- CaO (أكسيد الكالسيوم)
- CO2 (ثاني اكسيد الكربون)
- C6H12O6 (جلوكوز)
- NaCl (ملح الطعام، كلوريد الصوديوم)
- هيموجلوبين (C738H1166N812O203_S2Fe)
- فيتامين C أو حمض الأسكوربيك (C6H8O6)
- الحمض النووي الريبوزني منزوع الأكسجين (DNA)
أنواع الجزيئات
يمكن أن تصنف الجزيئات حسب التركيب :
– الجزيء ثنائي الذرة : يتكون الجزيء ثنائي الذرة من ذرتين فقط. و قد تكون هذه الذرات لعنصر واحد (متجانسة النواة) أو ذرات من عناصر مختلفة (غير متجانسة النواة). فجزيء الأكسجين مثلا O2 هو مثال على جزيء ثنائي الذرة المتماثلة. ينما حمض الهيدروكلوريك HCl هو مثال على جزيء ثنائي الذرة غير متجانس.
– الجزيء متعدد الذرات : يتكون الجزيء متعدد الذرات من أكثر من ذرتين. و المثال على ذلك الجلوكوز (C6H12O6) والماء (H2O) .
– الجزيء الكبير : الجزيء الكبير هو جزيء كبير جدًا ، غالبًا ما يتكون من وحدات فرعية. تعد البروتينات والحمض النووي أمثلة على الجزيئات الكبيرة.
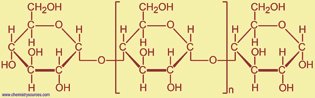
كما أن هناك طريقة أخرى لتصنيف الجزيئات حسب روابطها الكيميائية.
الجزيء التساهمي – تتكون الجزيئات التساهمية من ذرات متصلة بواسطة روابط كيميائية تساهمية. و تتكون الجزيئات التساهمية من لافلزات. ففي الجزيء التساهمي النقي ، تمتلك الذرات قيما كهروسالبية متشابهة. ومن أمثلة الجزيئات التساهمية النقية H2 و O3. أما في الجزيئات التساهمية القطبية ، تمتلك الذرات قيم كهروسالبية مختلفة قليلاً.
من أمثلة الجزيئات التساهمية القطبية الماء (H2O) وحمض الهيدروكلوريك (HCl).
الجزيء الأيوني – تتكون الجزيئات الأيونية من فلزات وغير فلزات(مع استثناءات قليلة). الكاتيون (الجزء الأول من الجزيء) والأنيون (الجزء الثاني من الجزيء) لهما قيم كهروسالبية مختلفة تمامًا. كما تُظهر الجزيئات الأيونية قطبية شديدة ، ولكن عادةً عندما يتحدث شخص ما عن جزيء قطبي ، فإنهم يقصدون الجزيء التساهمي القطبي.
تتضمن أمثلة الجزيئات الأيونية الملح (كلوريد الصوديوم) وخلات الأمونيوم (NH4CH3CO2 – مركب أيوني يتكون فقط من اللافلزات) و هيدروكسيد الصوديوم (NaOH).
الفرق بين الجزيء و المركب
يتكون المركب من عنصرين مختلفين أو أكثر مرتبطين بروابط كيميائية. فالماء (H2O) وحمض الهيدروكلوريك (HCl) أمثلة على المركبات.
أما غاز الهيدروجين (H2) والأوزون (O3) في أمثلة على جزيئات ، ولكنها ليست مركبات. و عليه يمكننا القول أن جميع المركبات هي جزيئات ولكن ليست كل الجزيئات مركبات.

الفرق بين الجزيء والأيون
الجزيء هو متعادل كهربائيًا. أي أن العدد الإجمالي للبروتونات والإلكترونات هو نفسه. أما الأيون فيحتوي على عدد مختلف من البروتونات والإلكترونات. فإذا كان هناك المزيد من البروتونات ، فإن الأيون يحمل شحنة موجبة. أما إذا كان هناك المزيد من الإلكترونات ، فإن الأيون يحمل شحنة سالبة.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات العاملة بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرو في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
المصدر : https://sciencenotes.org/what-is-a-molecule-definition-and-examples/
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة