أساسيات القياسات الطيفية الضوئية (المطيافية الضوئية)
Fundamentals of Spectrophotometry
( Sections 17.1-17.4 & 17.6, Quantitative Chemical Analysis by Daniel C. Harris, 8th Edition )
( التحليل الكيميائي النوعي – دانيال هاريس )
Spectrophotometry is any technique that uses light to measure chemical concentrations.
القياسات الطيفية الضوئية هي أي تقنية تستخدم الضوء لقياس التراكيز الكيميائية.
A procedure based on absorption of visible light is called colorimetry.
العمليات التي تقوم على مبدأ امتصاص الضوء تعرف باسم القياسات اللونية أو التحليل اللوني.
A colorimetric method where an instrument is used to determine the amount of analyte in a sample by the sample’s ability or inability to absorb light at a certain wavelength.
إن طريقة القياس اللوني تعتمد على استخدام أداة لتحديد كمية المادة المراد تحليلها في العينة من خلال قدرة العينة من عدمها على امتصاص الضوء عند طول موجي معين.
Spectrophotometry is the use of the measurement of the interaction of Electromagnetic radiation (EMR) with matter to quantize the concentration of an analyte. There are many different types of spectrophotometers, based on the wavelength region of the EMR they measure. Examples are uv-vis, IR, microwave, x-ray, etc.
فالقياس الطيفي الضوئي هو استخدام قياسات تفاعل الإشعاع الكهرومغناطيسي (EMR) مع المادة لتحديد تركيز المادة المراد تحليلها. و هناك العديد من الأنواع المختلفة لأجهزة قياس الطيف الضوئي و ذلك بناءً على منطقة الطول الموجي للإشعاع الكهرومغناطيسي التي يتم قياسها. ومن الأمثلة على تلك الاجهزة مقياسات الأشعة فوق البنفسجية-الضوء المرئي ، و مقياس الأشعة تحت الحمراء ، و مقياس الميكروويف ، و تحليل الأشعة السينية ، وما إلى ذلك.
17 – 1 خصائص الضوء
17 – 1 Properties of Light
It is convenient to describe light in terms of both particles and waves.
من الملائم وصف الضوء من حيث كل من الجسيمات والأمواج.
Light waves consist of perpendicular, oscillating electric and magnetic fields.
تتكون موجات الضوء من حقول كهربائية ومغناطيسية متعامدة و متذبذبة.
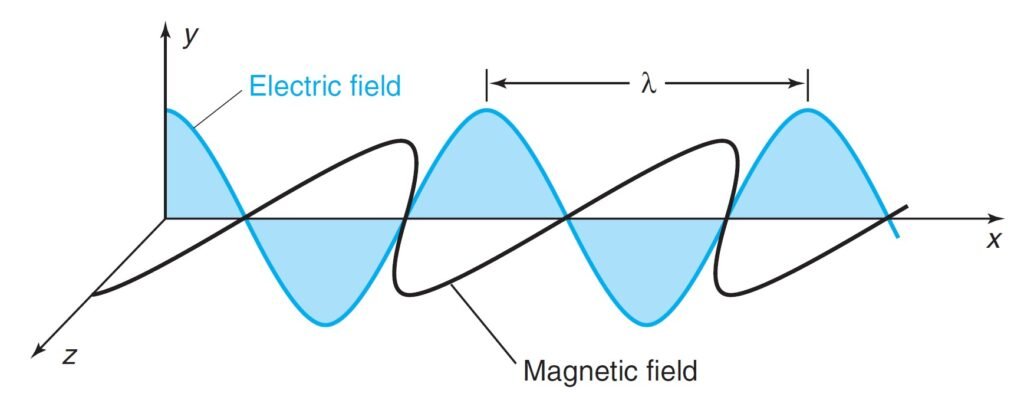
Parameters used to describe light:
المتغيرات التي تصف الضوء كما يأتي:
-
- Amplitude (A): height of wave’s electric vector.
- سعة الموجة (A): هو أقصى قيمة رأسية لمتجه الموجه الكهربائية.
- Wavelength (λ): distance (nm, cm, m) from peak to peak.
- الطول الموجي (λ) : المسافة بين قمتين أو قاعين في الموجة (نانومتر، سنتيمتر أو متر).
- Frequency (ν = nu): number of complete oscillations that the waves makes each second:
- التردد (ν و تلفظ نو): عدد الاهتزازات الكاملة التي يمكن للموجة القيام بها كل ثانية.
Hertz (Hz): unit of frequency, second–1 (s–1)
1 megahertz (MHz) = 106s–1 = 106Hz

where c is the speed of light (2.998 × 108 m/s in vacuum).
-
-
Energy (E): the energy of one particle of light (photon) is proportional to its frequency
- الطاقة (E) : طاقة كل جزيء من الضوء (فوتون) بالنسبة إلى تردده
-

where h is Planck’s constant (= 6.626 × 10–34 J s).

Where ![]() = (1/λ) = wavenumber.
= (1/λ) = wavenumber.
Energy (E) of light increase as frequency (n) increases or wavelength (l) decreases. For example: Red light, with a longer wavelength than blue light, is less energetic than blue light.
تزداد طاقة الضوء (E) كلما زاد تردده (ν) أو كلما نقص طوله الموجي (λ) . على سبيل المثال: الضوء الأحمر ، ذو الطول الموجي الأطول من الضوء الأزرق ، أقل طاقة من الضوء الأزرق.
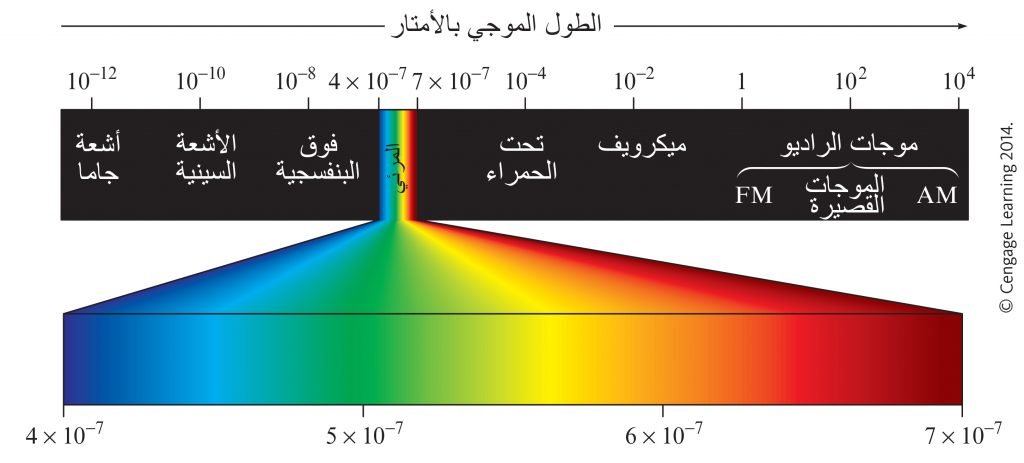
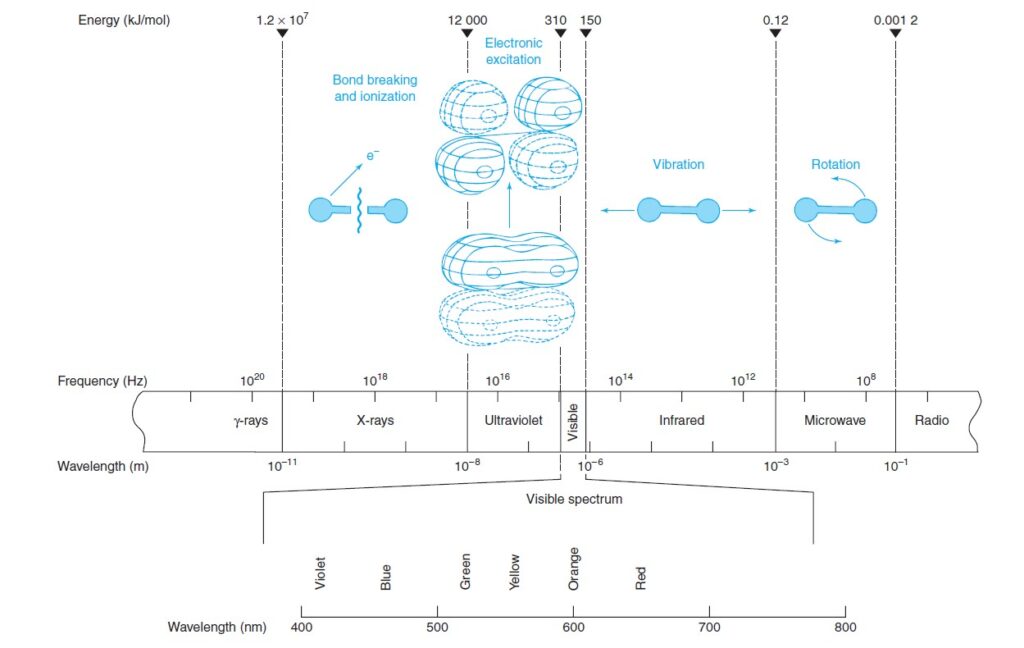
The following figures shows regions of the electromagnetic spectrum, where visible light represents only a small fraction of the electromagnetic spectrum.
توضح الأشكال الآتية مناطق الطيف الكهرومغناطيسي. حيث يمثل الضوء المرئي جزءً صغيرًا فقط من الطيف الكهرومغناطيسي.
Different regions of the electromagnetic spectrum produce different types of transitions in molecules.
تنتج مناطق مختلفة من الطيف الكهرومغناطيسي أنواعًا مختلفة من الانتقالات في الجزيئات.
17 – 2 امتصاص الضوء
17 – 2 Absorption of Light
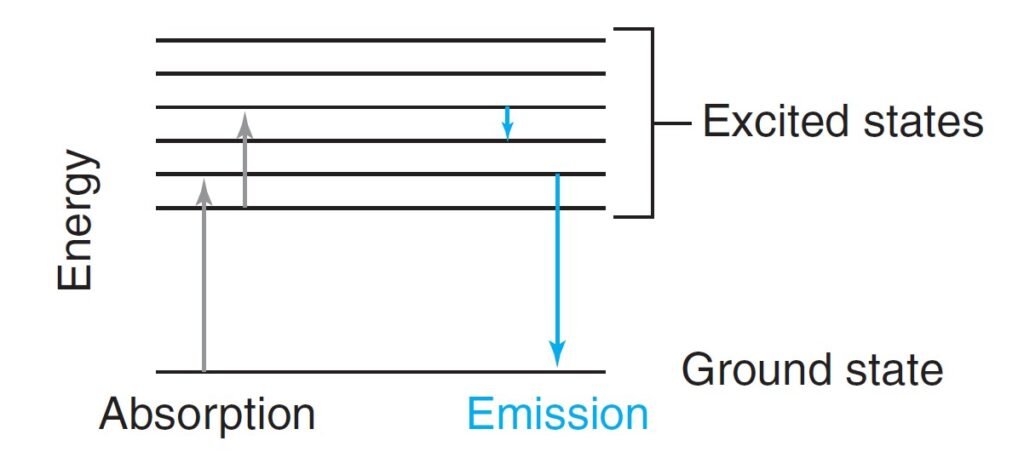
When a molecule absorbs a photon, the energy of the molecule increases and hence promoted to an excited state.
عندما يمتص جزيء فوتونا، فإن طاقة ذلك الجزيء تزداد و بالتالي ينتقل إلى الحالة المثارة.
If a molecule emits a photon, the energy of the molecule is lowered.
إذا قام الجزيء بإشعاع فوتونا فإن طاقة ذلك الجزيء تقل.
The lowest energy state of a molecule is called the ground state.
تسمى الحالة التي كون فيها لالجزيء أقل طاقة ممكنة بحالة الاستقرار.
Visible and ultraviolet radiation promote electrons to higher energy orbitals.
يعمل الضوء المرئي و الأشعة فوق البنفسجية على إثارة الإلكترونات لتنتقل إلى مستويات أعلى.
When light is absorbed by a sample, the irradiance of the beam of light is decreased.
عندما تمتص عينة ضوءًا، فإن إشعاعية شعاع ذلك الضوء تقل.
Irradiance, P, is the energy per second per unit area of the light beam.
الإشعاعية ، P ، هي طاقة شعاع الضوء في كل ثانية لكل وحدة مساحة.
Many Types of Chemicals Absorb Various Forms of Light.
فالعديد من المواد الكيميائية تمتص أشكالا عدة من الضوء.
Light with a very narrow range of wavelength is said to be monochromatic.
الضوء الذي له مدى طول موجي ضيق جدا يعرف باسم الضوء أحادي اللون.
The monochromatic light, with irradiance P0, strikes a sample of length b, the irradiance of the beam emerging from the other side of the sample is P. Some of the light may be absorbed by the sample, so P ≤ P0.
فعندما يصطدم الضوء أحادي اللون ذو الإشعاعية P0 ، عينة ذات الطول b ، فإن إشعاعية ذلك الضوء الخارج من الطرف الآخر من العينة يساوي P . و حيث أن بعضا من ذلك الضوء قد يمتص من العينة، فإنه يمكننا القول بأن شدة الضوء الخارج من العينة سيكون أقل أو يساوي شدة الضوء قبل مروره بالعينة.
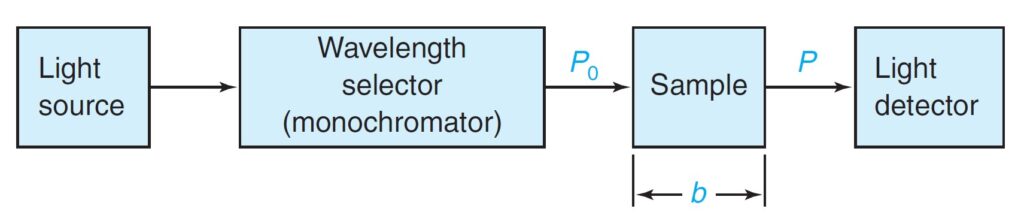
Transmittance, T, is defined as the fraction of the original light that passes through the sample and has the range 0 to 1 . The percent transmittance ranges is between 0 and 100%.
يتم تعريف النفاذية ، T ، على أنها جزء من الضوء الأصلي الذي يمر عبر العينة ولها مدى يتراوح ما بين 0 و 1 . أما نسبة النفاذية فهي تتراوح ما بين 0 و 100% .
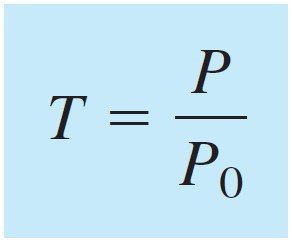
Absorbance (A) is defined as:
و يمكن تعريف الإمتصاصية (A) على أنها :

Absorbance is directly proportional to the concentration, c, of the light-absorbing species in the sample.
تتناسب الامتصاصية تناسبا طرديا مع تركيز الجسيمات الماصة للضوء c في العينة.
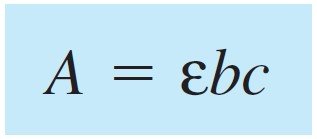
the above equation is called the Beer-Lambert law,6 or simply Beer’s law.
تسمى المعادلة السابقة باسم قانون بير-لامبرت أو تجاوزا قانون بير .
where, A absorbance which is dimensionless and c concentration given in units of moles per liter (M), and b the pathlength expressed in centimeters, and finally ε is molar absorptivity and has the units M–1 cm–1 and hence the product εbc dimensionless.
حيث ، A : الامتصاصية حيث لا وِحدة لها و c التركيز و وحدته مول لكل لتر (M) ، و b طول المسار و وحدته السنتيمتر ، وأخيرًا ε : الامتصاص المولي و وحدته لكل مول لكل سنتيمتر و بالتالي لا يكون هناك وِحدة لـ bcε .
The greater the molar absorptivity, the greater the absorbance.
كلما كان الامتصاص المولي أكبر كانت الإمتصاصية أعلى.
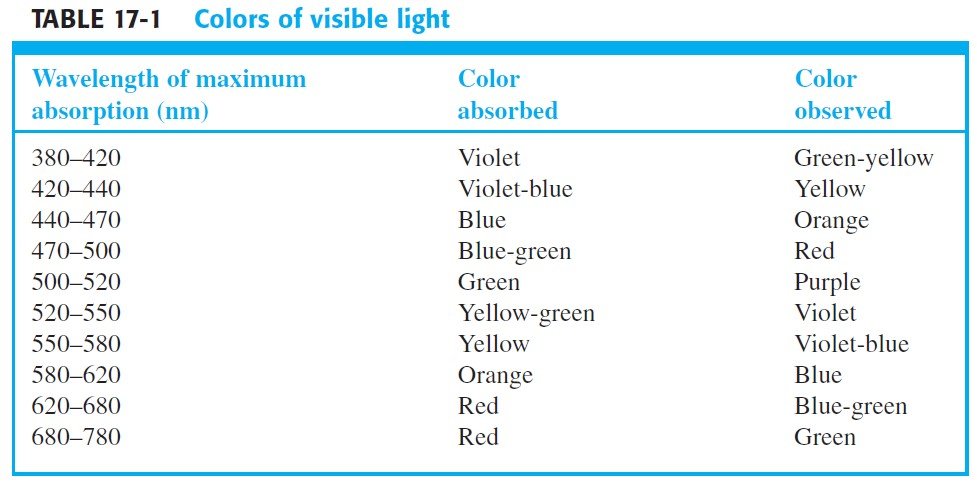
The Color of light absorbed and observed passing through the compound are complimentary , or in other words, the observed color is called the
complement of the absorbed color.
فلون الضوء الممتص والملاحظ المار عبر المركب الكيميائي هو مكمل، أو بصيغة أخرى: اللون المشاهد هو اللون المكمل للون الممتص.
When Beer’s Law Fails متى يفشل قانون بير
Beer’s law applies to monochromatic radiation and it works very well for dilute solutions (≤ 0.01 M) of most substances.
ينطبق قانون بير على الإشعاع أحادي اللون ويعمل بشكل جيد للغاية مع المحاليل المخففة (≤ 0.01 مول/لتر) لمعظم المواد.
17 – 3 قياس الإمتصاصية
17 – 3 Measuring Absorbance
The minimum requirements for a spectrophotometer (a device to measure absorbance of light) is shown below.
إن الحد الأدنى لمتطلبات مقياس الطيف الضوئي (جهاز لقياس امتصاص الضوء) مبين أدناه.

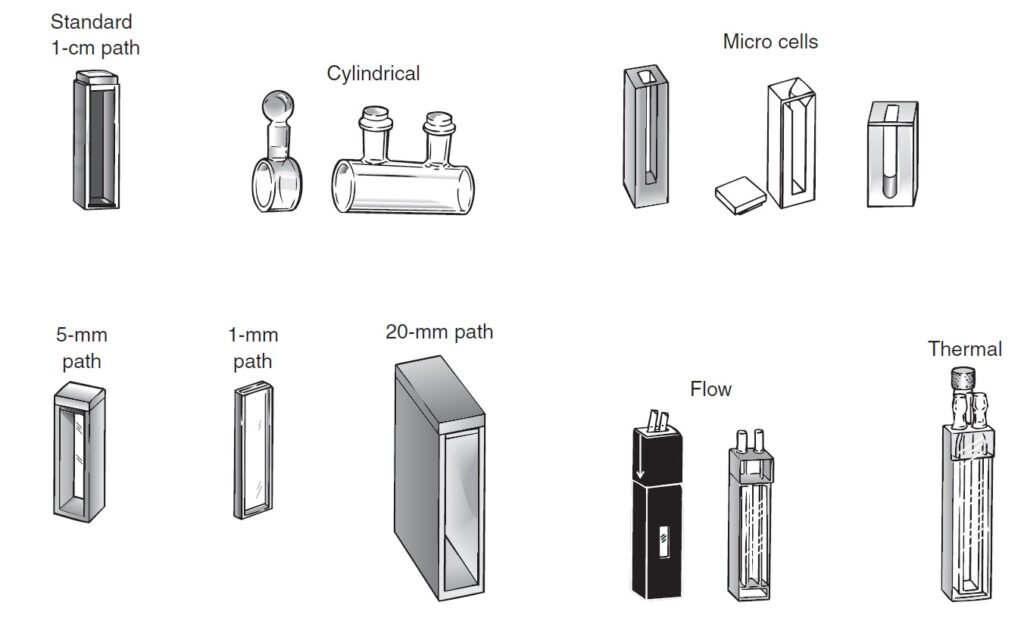
For visible and ultraviolet spectroscopy, a liquid sample is usually contained in a cell called a cuvet that has flat, fused-silica (SiO2) or quartz faces.
بالنسبة إلى التحليل الطيفي المرئي و الأشعة فوق البنفسجية ، يتم عادةً احتواء العينة السائلة في خلية تسمى كوفيت (أو الحاوية) و تتميز بوجوه مسطحة مصنوعة من السيليكا (SiO2) المصهورة أو الكوارتز.
Cuvet made of Glass is suitable for visible, but not ultraviolet, spectroscopy because it absorbs ultraviolet radiation.
الكوفيت المصنوع من الزجاج مناسب للطيف المرئي وليس للطيف فوق البنفسجي لأنه يمتص الأشعة فوق البنفسجية.
For infrared measurements, cells are commonly constructed of NaCl or KBr.
بالنسبة لقياسات طيف الأشعة تحت الحمراء ، عادةً ما يتم صناعة الكوفيت من NaCl أو KBr.
Solid samples are commonly ground to a fine powder, which can be added to mineral oil (a viscous hydrocarbon also called Nujol) to give a dispersion that is called a mull and is pressed between two KBr plates.
عادة ما يتم طحن العينات الصلبة إلى مسحوق ناعم ، والذي يمكن إضافته إلى الزيت المعدني (هيدروكربون لزج يسمى أيضًا Nujol) لتتبعثر و تنتشر المادة الصلبة في الزيت المعدني و التي يطلق على ذلك المزيج اسم “الدُّبال” ويتم ضغطه بين طبقتين من KBr.
Gases are more dilute than liquids and require cells with longer pathlengths, typically ranging from 10 cm to many meters.
الغازات عادة ما تكون مخففة أكثر من السوائل وتتطلب خلايا ذات أطوال مسارات أطول، تتراوح عادة من 10 سم إلى عدة أمتار.
Common cuvets for visible and ultraviolet spectroscopy shown below.
الكوفيدات الشائعة للتحليل الطيفي المرئي والأشعة فوق البنفسجية مبينة هو موضح أدناه.
In a single-beam instrument, there is one beam of light. The irradiance of light is passing through a reference cuvet containing pure solvent (or a reagent blank), and this light is defined as P0. This cuvet is then removed and replaced by an identical one containing sample. The irradiance of light striking the detector after passing through the sample is the quantity P. Knowing both P and P0 allows T or A to be determined.
في أجهزة قياس الطيف المرئي/الأشعة فوق البنفسجية ذات الشعاع واحد ، يكون هناك شعاع ضوء واحد (مصدر واحد للضوء). حيث يمر إشعاع الضوء من خلال كوفيت مرجعي يحتوي على مذيب نقي (أو محلول مرجعي ) ، ويتم تعريف هذا الضوء على أنه P0. ثم يتم إزالة هذا الكوفيت واستبداله بآخر مماثل تحتوي على العينة. فالإشعاع الضوئي الذي يصطدم بالمكشاف بعد مرور الإشعاع خلال العينة هو ما يعرف بـ P. و يسمح معرفة كل من P و P0 بتحديد T أو A.
In recording an absorbance spectrum, first record a baseline spectrum with reference solutions (pure solvent or a reagent blank) in both cuvets. If the instrument were perfect, the baseline would be 0 everywhere. In our imperfect world, the baseline usually exhibits small positive and negative absorbance. We subtract the baseline absorbance from the sample absorbance to obtain the true absorbance at each wavelength.
عند تسجيل طيف الامتصاص ، في البداية يتم تسجيل الطيف الأساسي باستخدام المحاليل المرجعية (مذيب نقي أو محلول مرجعي ) في كلا أنبوبتي الكوفيت. فإذا كان جهاز قياس الطيف “مثالي” ، فسيكون خط الأساس 0 في كل مكان. و لكن حقيقة مهاما كان الجهاز متقدما إلا أنه سيظهر خط الأساس عادةً امتصاصًا إيجابيًا وسلبيًا صغيرًا. و هنا نقوم بطرح امتصاص خط الأساس من عينة الامتصاص للحصول على الامتصاص الحقيقي عند كل طول موجي.
For spectrophotometric analysis, we normally choose the wavelength of maximum absorbance for two reasons: (1) The sensitivity of the analysis is greatest at maximum absorbance; that is, we get the maximum response for a given concentration of analyte. (2) The curve is relatively flat at the maximum, so there is little variation in absorbance if the monochromator drifts a little or if the width of the transmitted band changes slightly.
بالنسبة للتحليل الطيفي الضوئي ، نختار عادةً الطول الموجي لأقصى امتصاص لسببين: (1) تكون حساسية التحليل أكبر عند الحد الأقصى للامتصاص ؛ وهذا يعني أننا نحصل على أقصى استجابة لتركيز معين من المادة التحليلية. (2) يكون المنحنى مسطحًا نسبيًا عند الحد الأقصى ، لذلك سيكون هناك اختلافا بسيطا في الامتصاص إذا انحرف اللون الأحادي قليلاً أو إذا تغير عرض نطاق الشعاع المار قليلاً.
17 – 4 قانون بير في التحليل الكيميائي
17 – 4 Beer’s Law in Chemical Analysis
For a compound to be analyzed by spectrophotometry, it must absorb light, and this absorption should be distinguishable from that due to other substances in the sample.
لكي يتم تحليل المركب بواسطة مقياس الطيف الضوئي، يجب أن يمتص المركب الضوء ويجب أن يكون ذلك الامتصاص مميزا عن المواد الأخرى الموجودة في العينة.
Proteins are normally assayed in the ultraviolet region at 280 nm because aromatic groups present in virtually every protein have an absorbance maximum at 280 nm.
عادة ما يتم الكشف عن البروتينات و فحصها في المنطقة فوق البنفسجية عند 280 نانومتر لأن المجموعات العطرية الموجودة في كل بروتين تقريبًا لها أقصى امتصاص عند 280 نانومتر.
Serum Iron Determination تعيين مصل الدم
Iron for biosynthesis is transported through the bloodstream by the protein transferrin. The following procedure measures the Fe content of transferrin in blood. This analysis requires only about 1 g of Fe for an accuracy of 2–5%. Human blood usually contains about 45 vol% cells and 55 vol% plasma (liquid). If blood is collected without an anticoagulant, the blood clots; the liquid that remains is called serum. Serum normally contains about 1 g of Fe/mL attached to transferrin. The serum iron determination has three steps:
يتم نقل الحديد لغايات العمليات الحيوية في الجسم عبر مجرى الدم بواسطة بروتين الترانسفيرين. و الطريقة الآتية تقيس محتوى الترانسفيرين من الحديد في الدم. يتطلب هذا التحليل حوالي 1 جرام من الحديد للحصول على دقة تتراوح ما بين 2-5٪. فدم الإنسان يحتوي عادة على حوالي 45٪ من الخلايا و 55٪ بالحجم من البلازما (السائل). و إذا ما تم جمع الدم بدون مضادات التخثر فإنه يتجلط و يسمى. السائل المتبقي بمصل الدم. و يحتوي المصل عادة على حوالي 1 جرام من الحديد لكل مليلتر مرتبطا بالترانسفيرين. و يمكن تحديد الحديد في المصل من ثلاث خطوات:
STEP 1 :Reduce Fe3+ in transferrin to Fe2+ by reducing agents such as hydroxylamine hydrochloride (NH3OH+Cl–) or thioglycolic acid, or ascorbic acid.
الخطوة 1: اختزال +Fe3 في الترانسفيرين إلى +Fe2 عن طريق عامل مختزل مثل هيدروكلوريد الهيدروكسيل أمين (–NH3OH+Cl) أو حمض الثيوجلايكوليك ، أو حمض الأسكوربيك.
2Fe3+ + 2HSCH2CO2H → 2Fe2+ + HO2CCH2S–SCH2CO2H + 2H+
STEP 2 : Adding trichloroacetic acid (Cl3CCO2H) to precipitate proteins, leaving Fe2+ in solution and remove the precipitate by centrifuge.
الخطوة 2: إضافة ثلاثي كلوريد حمض الخليك (Cl3CCO2H) لترسيب البروتينات ، فيتبقى +Fe2 في محلول وإزالة الراسب بواسطة أجهزة الطرد المركزي.
STEP 3 : Transfer a measured volume of Fe2+ liquid from step 2 to a fresh vessel. Add buffer plus excess ferrozine to form a purple complex. Measure the absorbance at the 562-nm.
الخطوة 3: انقل حجمًا مُقاسًا من سائل أيون الحديد الثنائي الخطوة الذي تم الحصول عليه من الخطوة 2 إلى وعاء جديد. أضف محلول منظم بالإضافة إلى المزيد من الفيروزين لتشكيل معقد زهري اللون. قس الامتصاصية عند 562 نانومتر.
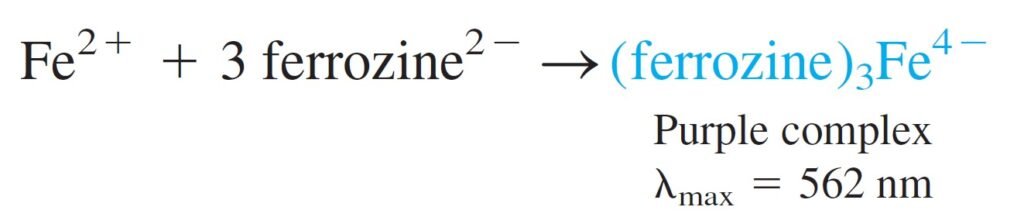
Use a series of iron standards for a calibration curve to show that Beer’s law is obeyed.
استخدم سلسلة من المحاليل القياسية للحديد لمعايرة المنحنى لإظهار الامتثال لقانون بير.
17 – 6 ماذا يحدث عندما يمتص الجزيء الضوء؟
17 – 6 What Happens When a Molecule Absorbs Light?
Molecule Promoted to a More Energetic Excited State.
ينتقل الجزيء إلى حالة مثارة يكون فيها أكثر طاقة.
Two Possible Transitions in Excited State
- Single state – electron spins opposed
- Triplet state – electron spins are parallel
هناك نوعين من الانتقالات تحدث في الحالة المثارة:
- الحالة الأحادية : يكون غزل الإلكترونات في هذه الحالة معاكس لبعضها البعض.
- الحالة الثلاثية: يكون غزل الإلكترونات في هذه الحالة موازٍ لبعضها البعض
In general, triplet state has lower energy than singlet state
عموما الحالة الثلاثية لها طاقة أقل من الحالة الاحادية.
Singlet to Triplet transition has a very low probability
هناك احتمالية ضعيفة للإنتقال من الحالة الأحادية إلى الحالة الثلاثية.
Singlet to Singlet Transition are more probable
الانتقال من الحالة الاحادية إلى الحالة الأحادية أكثر تفضيلا.
Infrared and Microwave Radiation: Not energetic enough to induce electronic transition.
الأشعة تحت الحمراء و الميكرويف لا تمتلك الطاقة الكافية لكي تحدث إنتقالات إلكترونية.
When molecule absorbs light the entire molecule and each atom can move along the x, y, z-axis.
عندما يمتص الجزيء الضوء ، فإنه يمكن للجزيء بأكمله و كذلك كل ذرة أن تتحرك على طول المحور x و y و z.
When correct wavelength is absorbed, oscillations of the atom vibration is increased in amplitude and molecule rotates or moves (translation) faster.
عندما يتم امتصاص الطول الموجي الصحيح ، تزداد تذبذبات اهتزاز الذرة في السعة ويدور الجزيء أو يتحرك (ينتقل) بشكل أسرع.
انتقالات الإلكترونية المشتركة والاهتزازية والدورانية
Combined Electronic, Vibrational, and Rotational Transitions
Absorption of photon with sufficient energy to excite an electron will also cause vibrational and rotational transitions.
سيؤدي امتصاص الفوتون مع الطاقة الكافية لإثارة الإلكترون إلى حدوث انتقالات اهتزازية ودورانية أيضا.
There are multiple vibrational and rotational energy levels associated with each electronic state.
هناك العديد من مستويات الطاقة الاهتزازية والدورانية المرتبطة بكل حالة إلكترونية.
Excited vibrational and rotational states are lower energy than electronic state.
الحالات الاهتزازية والدورانية المثارة لها طاقة أقل من الحالة الإلكترونية.
Therefore, transition between electronic states can occur between different vibrational and rotational states.
لذلك ، يمكن أن يحدث الانتقال بين الحالات الإلكترونية بين حالات الاهتزاز والدوران المختلفة.
المصادر:
- Quantitative Chemical Analysis by Daniel C. Harris, 8th Edition
- الموسوعة العلمية الكيميائية للأستاذ أكرم العلي
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة