أيون مزدوج Zwitterion :
في الكيمياء ، الزويتريون Zwitterion (أيون الزويتر) أو الأيـون المزدوج هو جزيء متعادل يحتوي على أعداد متساوية من المجموعات الوظيفية الموجبة والسالبة، بحيث ترتبط المجموعات الوظيفية المشحونة مع الجزيء عن طريق الروابط التساهمية.
تعريف الأيون المزدوج (الزويتريون)
اشتق تعريف الزويتريون من الكلمة الألمانية Zwitter ، والتي تعني “هجين” أو “مزدوج” ، و يعكس الاسم أن في جزيء الزويتريون مناطق متساوية من حيث الشحنة الكهربائية الموجبة والسالبة. و لكن في بعض الأحيان يستخدم مصطلح الزويتريونـات للإشارة إلى “الأملاح الداخلية”. ولكن ، قد يؤدي هذا الاسم إلى حدوث ارتباك لأن الأملاح تحتوي على روابط أيونية ، بينما تحتوي الزويتريونـات على روابط تساهمية.
كما أن هناك بعض الجزيئات الزويتريونية توجد فقط ضمن نطاقات معينة من الرقم الهيدروجيني. كما توجد بعض الجزيئات الأخرى على شكل زويتريونـات و لا تحتوي على مجموعات وظيفية غير مشحونة، و تعرف هذه المركبات باسم الزويتريونـات الدائمة.
أمثلة على الأيونات المزدوجة (الزويتريونات)
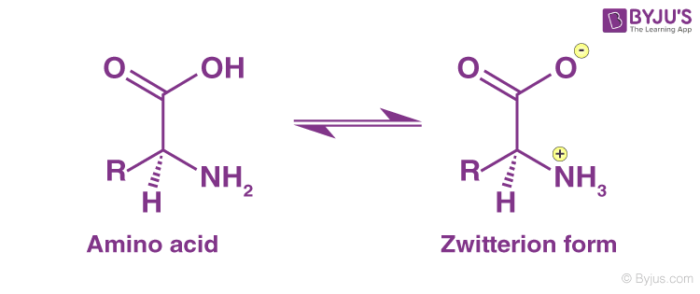
– الحموض الأمينية (الاحماض الأمينية) : من أشهر الأمثلة على الزويتريونـات هي الحموض الأمينية. حيث يحتوي الحمض الأميني على مجموعة أمينية ومجموعة كربوكسيل وظيفية. لا يعتبر الحمض الأميني بمفرده زويتريون ، ولكن في المحلول مائي تكتسب المجموعة الأمينية بروتونًا (ذرة هيدروجين) و بالتالي تصبح شحنتها موجبة، و في الوقت نفسه تفقد مجموعة الكربوكسيل بروتونًا و تصبح سالبة الشحنة . فجزيء الزويتريون متعادل بشكل عام ، ولكن لديه مجموعات وظيفية متساوية و ذات شحنات متعاكسة. و عند درجة الحموضة المتعادلة في الماء ، فإنه يحدث توازن بين الحمض الأميني “الأصل” و جزيء الزويتريون.
H2N (R) CO2H H3N + (R) CO2– + H2O
وعند انخفاض درجة الحموضة ، يشكل الحمض الأميني كاتيونًا. عند درجة الحموضة العالية ، فإنها تشكل أنيون.
– البيتانات Betaines : البيتانات هي زويتريونـات دائمة. ومن الأمثلة على البيتانات هي ثلاثي ميثيل الجلايسين trimethylglycine وكوكاميدوبروبيل البيتين cocamidopropyl betaine.
– حمض السلفاميك Sulfamic acid : مثل الحموض الأمينية ، يوجد حمض السلفاميك في شكل متعادل تمامًا وفي شكل زويتريون ، حيث يتبلور حمض السلفاميك في شكله الزويتريوني .
– حمض أنثرانيليك Anthranilic acid : تحتوي بلورات حمض أنثرانيليك على كميات متساوية من الجزيء الأصلي و الزويتريون .
– بسيلوسيبين Psilocybin
– فسفاتيديل كولين Phosphatidylcholine
ما هي الجزيئات التي لا تعتبر أيـون مزدوج (زويتريونا) ؟
من أجل فهم ما هي الزويتريونـات، من المفيد ذكر أمثلة على جزيئات ليست من الزويتريونـات على الرغم من كونها متعادلة. فالجزيئات التي تحمل شحنة جزئية ليست من الزويتريونـات، كما أن الأملاح لا تعتبر من الزويتريونـات. و فيما يلي أمثلة على مركبات لا تعتبر من الزويتريونـات :
– الماء (H2O): على الرغم من أن الماء جزيء تساهمي متعادل إلا أنه لا يعتبر من الزويتريونـات ، حيث أن ذرات الهيدروجين والأكسجين عبارة عن مناطق ذات شحنة جزئية ، كما أن الماء يتأين تلقائيًا ويشكل أيونات الهيدرونيوم والهيدروكسيد المنفصلة.
– كلوريد الصوديوم (NaCl): كلوريد الصوديوم والأملاح الأخرى ليست من الزويتريونـات لأنها تحتوي على روابط أيونية. علاوة على ذلك ، فإنها تتفكك في الماء بدلاً من تكوين جزيئات بمناطق ذات شحنة موجبة وسالبة.
– كلوريد الأمونيوم (NH4Cl): يحتوي كلوريد الأمونيوم على روابط تساهمية داخل كاتيون الأمونيوم ، لكن الأمونيوم يرتبط بالكلوريد عبر الروابط الأيونية. يتفكك كلوريد الأمونيوم في الماء بدلاً من تكوين جزيء متعادل مع مناطق مشحونة.
خصائص الأيـونات المزدوجة (الزويتريونات)
تتميز الزويتريونـات ببعض الخصائص و منها:
– الزويتريون متعادل و لكن يحتوي على مجموعات مناطق شحنة موجبة وسالبة.
– الزويتريونات تحتوي على روابط تساهمية فقط.
– يشكل العديد من الزويتريونات الأمفولات ampholytes التي لها مجموعات وظيفية حمضية وأساسية.
– تميل الزويتريونات إلى الحصول على درجات انصهار أعلى من الجزيئات الأخرى من نفس الحجم، و هذا يرجع إلى كون المناطق المشحونة تعمل على جذب الجزيئات الأخرى بقوة ، لذلك يتطلب فصلها المزيد من الطاقة.
– يحتوي الزويتريون مثل الحموض الأمينية على منطقة متساوية الكهربية (pI).
أهمية الأيـونات المزدوجة (الزويتريونات)
للزويتريونات أهمية في الطبيعة و أيضا من الناحية الاقتصادية:
– الكيمياء الحيوية: على سبيل المثال ، فوسفاتيديل الكولين هو فوسفوليبيد (شحم فوسفوري) وهو عنصر مهم في أغشية الخلايا. تعطي المناطق المشحونة للجزيء خصائص كارهة للماء ومحبة للماء.
– الأدوية والمكملات: العديد من أشباه القلويات هي زويتريونات. فعلم العقاقير الخاص بها يعتمد على خصائصها. بعض المكملات الغذائية ، مثل L-lysine ، هي زويتريونات. فالزويتريونات مهمة في أجهزة الاستشعار والغرسات الطبية.
المحاليل المنظمة: بعض المحاليل المنظمة هي زويتريونات ، مثل MOPS و HEPES. هذه المحاليل المنظمة لا تتخلل أغشية الخلايا.
البيولوجيا الجزيئية: تجد الزويتريونات استخدامًا في SDS PAGE (الرحلان الكهربائي لهلام دوديسيل كبريتات – بولي أكريلاميد). الاستخدام الرئيسي هنا هو لفصل البروتين.
الطلاءات: تساعد الزويتريونات على منع البكتيريا والكائنات الحية الأخرى من الاستقرار على الأسطح. توجد هذه الطلاءات في الطب والصناعة البحرية.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
المرجع : https://sciencenotes.org/zwitterion-definition-and-examples/
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة