العناصر الانتقالية (الفلزات الانتقالية) في الجدول الدوري:
في الكيمياء إن لمصطلح الفلز الانتقالي (أو العنصر الانتقالي) ثلاثة معانٍ ممكنة:
– فحسب تعريف الأيوباك IUPAC فإن الفلز الانتقالي هو”عنصر له ذرة تحتوي على غلاف فرعي d ممتلئ جزئيًا ، أو يمكن أن يؤدي إلى إنشاء الكاتيونات مع فلك فرعي d غير مكتمل “.
– و يصف العديد من العلماء “الفلز الانتقالي” بأنه أي عنصر يقع في القطاع d من الجدول الدوري والذي يتضمن مجموعات من 3 إلى 12 في الجدول الدوري و لكن فعليا ، تُعتبر سلسلة اللانثنيدات و الاكتنيدات و هي تنتمي إلى القطاع f من الجدول الدوري بأنها العناصر الانتقالية الداخلية”.
قام كل من العالمين كونون و ويلكنسون بتوسيع تعريف الأيوباك IUPAC المختصر و المذكور أعلاه بتحديد العناصر التي يتم تعيينها ضمن العناصر الانتقالية . فبالإضافة إلى عناصر المجموعات من 4 إلى 11 ، فإنهما يضيفان السكانديوم والإيتريوم في المجموعة 3 والتي يكون فيها الفلك الفرعي d ممتليء جزئيا في الحالة الفيزيائية كما يتم تصنيف اللانثانوم والأكتينيوم في المجموعة 3 مع اللانثانيدات والأكتينيدات على التوالي.
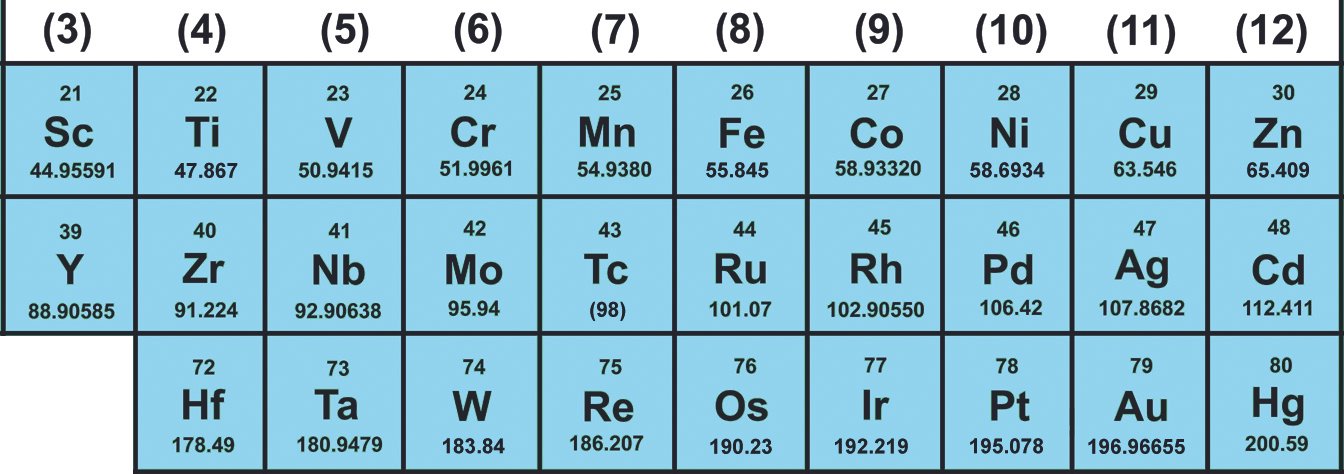
تصنيف العناصر الانتقالية (الفلزات الانتقالية):
يمكن تقسيم العناصر الانتقالية إلى صنفين و هما:
أ – العناصر الانتقالية الرئيسية (القطاع d ) و توجد في صلب الجدول الدوري و هي العناصر التي تُكوِّن أيونا واحدا على الأقل و تكون فيه أفلاك (مدارات) d ممتلئة إمتلاءً جزئيا ، أي أنها غير مكتملة الإلكترونات في الفلك d . و هي تقع في صلب الجدول الدوري و في الدورات الرابعة و الخامسة و السادسة و في المنطقة الفاصة بين القطاعين s على اليسار و القطاع p على اليمين.
ب – العناصر الانتقالية الداخلية (القطاع f) و توجد خارج أسفل الجدول الدوري و تتكون من سلسلة اللانثنيدات و سلسلة الاكتنيدات.
الخصائص العامة للعناصر الإنتقالية:
1 – جميعها معادن و بالتالي تتمتع بكل خواص المعادن من حيث جودة التوصيل للتيار الكهربائي و سهولة السحب و الطرق و تكوين سبائك مع الفلزات الأخرى و غيرها من الصفات.
2 – تشكل عددا كبيرا من الايونات الملونة و البارامغناطيسية و ذلك لوجود إلكترونات فردية. أما سبب تلون مركبات العناصر الإنتقالية فهذا يرجع إلى الإنتقالات الإلكترونية و هي نوعين :
أ – إنتقال d-d : حيث ينتقل الإلكترون بين فلكين (مدارين) من أفلاك d و يعطي هذا الانتقال ألوانا شاحبة (فاتحة).
ب – إنتقال إلكترون من فلك جزئي في الربيطة في مدار جزئي على ذرة الفلز أو العكس و يعطي هذا الانتقال ألوانا داكنة.
3 – لها القدرة على تكوين مركبات تناسقية (معقدة) مثل –Fe(CN)6]3] و سبب هذه الخاصية:
أ – ارتفاع شحنة أغلب الأيونات.
ب – وجود أفلاك (مدارات) d فارغة تسمح بدخول الأزواج الإلكترونية التي تتواجد على الرُبيطات (الليجاندات) .
4 – تعدد حالات الأكسدة و ذلك لأن الفرق في الطاقة الكلية بين الإلكترونات (d(n-1 و إلكترونات ns صغير مما يُمكن من استخدامها في التفاعلات الكيميائية.
5 – ذات خواص حفزية في التفاعلات الكيميائية و الصناعية و الحيوية ، فمثلا يستخدم أكسيد المنغنيز MnO2 في تفاعل تحلل فوق أكسيد الهيدروجين H2O2 .
6 – يتناقص نصف القطر الذري للعناصر من اليسار إلى اليمين خلال الدورة حتى قرب النهاية فإن الحجم يزداد فليلا.
7 – الاحجام الذرية للعناصر الانتقالية صغيرة لأن الزيادة في شحنة النواة تجذب الإلكتروناتإلى الداخل و بالتالي فإن كثافة العناصر الانتقاليى تكون كبيرة.
8 – بصفة عامة فإن درجات الانصهار و الغليان لأغلب العناصر الانتقالية عالية جدا. و تعتبر العناصر الخارصين Zn و الكادميوم Cd و الزئبق Hg مستثناه بسبب إمتلاء الفلك d بالإلكترونات.
9 – من ناحية انتشارها في الطبيعة نلاحظ أن عناصر الصف الأول زات الرقم الزوجي تكون اكثر انتشارا من العناصر التي تحتوي على أرقام ذرية احادية ، و الحالة الشاذة عنا هو المنجنيز. و عناصر الصف الثاني و الثالت أقل انتشارا من عناصر الصف الأول.
الصفات المغناطيسية:
تقسم المواد حسب طبيعة تفاعلاتها مع المجال المغناطيسي الخارجي حسب التركيب الإلكنروني للذرات أو الجزيئات أو الأيونات:
أ – مواد بارامغناطيسية : و هي المواد التني تنجذب نحو المجال المغناطيسي و يكون مقدار الحث المغناطيسي أكبر من أو يساوي 1 و المثال عليها أيونات فلزات القطاع d .
ب – المواد الدايامغناطيسية : و هي المواد التي لا تنجذب نحو المجال المغناطيسي و الحث المغناطيسي لها يساوي صفرا .
للحصول على الجـدول الدوري البسيط يرجى الضغط على الرابط الآتي : لوحة الجـدول الدوري باللغة العربية بدقة عالية1 Arabic periodic table
للحصول على الجـدول الدوري المفصل يرجى الضغط على الرابط الآتي : الجـدول الدوري للعناصر المفصل باللغة العربية Detailed Periodic Table of Elements (Arabic)
لمعلومات أكثر عن الجدول الدوري و العناصر أضغط على الرابط الآتي : خصائص الجدول الدوري و أسماء عناصر الجدول الدوري بالعربي Arabic Periodic Table
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة