الفلزات القلوية – العناصر القلوية – المجموعة الأولى
ملاحظة هامة حول الفلزات القلوية – العناصر القلوية – المجموعة الأولى : إذا كنت تبحث عن ملف بوربوينت powerpoint فأرجو التوجه إلى المقال الآتي : سلايدات بوربوينت powerpoint كيمياء المجموعة الرئيسة – المجموعة 1 (الفلزات القلوية)
مقدمة
تعرف أول ستة عناصر الموجودة في المجموعة الأولى من الجدول الدوري باسم العناصر القلوية .فهذه العناصر لينة مقارنة مع 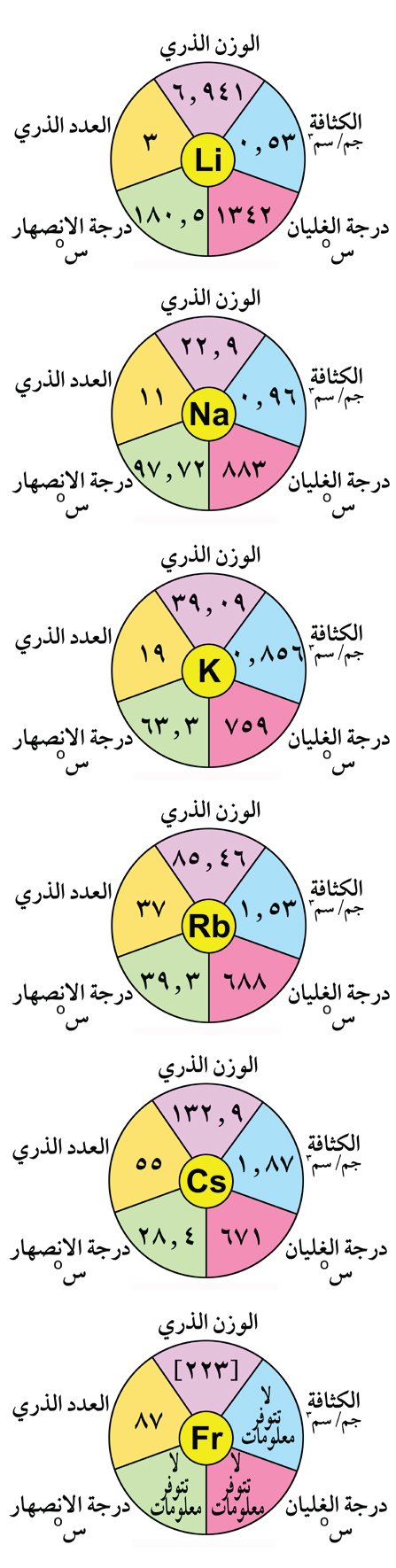 الفلزات الأخرى، و لها درجات انصهار منخفضة، ونشطة جدا بحيث أنها لا توجد مطلقا في الطبيعة بدون أن تكون مرتبطة مع عناصر أخرى. و تعتبر أيضا عوامل اختزال قويّة بحيث تعطي إلكترونا بسهولة، و تتفاعل بعنف مع الماء لتكون غاز الهيدروجين والهيدروكسيدات، أو القواعد القوية.
الفلزات الأخرى، و لها درجات انصهار منخفضة، ونشطة جدا بحيث أنها لا توجد مطلقا في الطبيعة بدون أن تكون مرتبطة مع عناصر أخرى. و تعتبر أيضا عوامل اختزال قويّة بحيث تعطي إلكترونا بسهولة، و تتفاعل بعنف مع الماء لتكون غاز الهيدروجين والهيدروكسيدات، أو القواعد القوية.
ترتب العناصر في المجموعة حسب الزيادة في العدد الذري إلى ليثيوم Li، صوديوم Na ، بوتاسيوم K، روبيديوم Rb ، سيزيوم Cs، و فرانسيوم Fr.
تذوب أكاسيد الليثيوم ، الصوديوم، البوتاسيوم ، الروبيديوم و السيزيوم في الماء ناتجا عن ذلك محاليل قلوية قوية، و من هنا جاءت تسميتها باسم العناصر القلوية .
ينتهي التوزيع الإلكتروني لعناصر المجموعة الأولى بـ ns1 و هي بالتالي تقع ضمن النطاق s في الجدول الدوري .
الخصائص العامة
1 – عناصر المجموعة الاولى نشطة جدا لذلك لا توجد في الطبيعة بصورتها الحرة.
2 – لونها يميل إلى اللون الأبيض الفضي ، و هي لينة و خفيفة الوزن .
3 – عادة ما توجد على شكل هاليدات مثل NaCl ، KCl .
3 – تمتلك عناصر تلك المجموعة أكبر حجم ذري مقارنة مع عناصر أخرى ، وهذا الحجم في المجموعة يزداد من أعلى لأسفل .
4- عناصر المجموعة الأولى خفيفة و كثافاتها منخفضة ، حيث تزداد كثافة العناصر القلوية من الليثيوم إلى السيزيوم مع ملاحظة أن كثافة البوتاسيوم أقل من كثافة الصوديوم كحالة استثنائية و هذا بسبب كون حجم ذرة البوتاسيوم أكبر من حجم ذرة الصوديوم و بالتالي البوتاسيوم أخف من الصوديوم.
5 – درجات انصهار عناصر المجموعة الأولى منخفضة نسبيا و تقل كلما انتقلنا في المجموعة من أعلى لأسفل .
6- هذه العناصر تعتبر عوامل مختزلة قوية.
7 – طاقات التأين الأولى لعناصر هذه المجموعة تعتبر الأقل مقارنة مع عناصر الجدول الدوري الأخرى . فهي تميل إلى فقدان إلكترونها بسهولة الموجود في الفلك s مقارنة مع عناصر الجدول الدوري الأخرى ، و بالتالي الوصول إلى التوزيع الإلكتروني للعناصر النبيلة الأكثر استقرارا . طاقات التأين الأولى لعناصر تلك المجموعة تقل كلما انتقلنا من أعلى لأسفل في المجموعة .
8 – طاقة التأين الثانية لجميع عناصر المجموعة مرتفعة جدا لانها عند فقدها لإلكترونها الوحيد فإن توزيعها الإلكتروني يصبج مشابها للتوزيع الإلكتروني للعناصر النبيلة الأكثر استقرارا و التي تمتلك أعلى شحنة نووية فعالة ، لذلك يتطلب الأمر طاقة عالية لإزالة إلكترون ثان منها
9- تفاعلها مع الماء قوي جدا و ينتج عن ذلك التفاعل هيدروكـسيدات أو محاليل قاعدية قوية (ما عدا هيدروكسيد الليثيوم) ، و يمكن ترتيب التدرج في قوة المحلول القاعدي كما يلي:
CsOH < RbOH < KOH < NaOH < LiOH
10- جميع أملاح الفلزات القلوية أيونية (ما عدا الليثيوم) و هي قابلة للذوبان في الماء ، و الطاقة الناتجة عن ذوبانها في الماء مرتفعة جدا و هذه الطاقة تعرف باسم طاقة التميؤ .
11- تتفاعل مع جميع اللافلزات على الأغـلب .
12 – عند تعرضها للهب ينتج عنها ألوان يعرف بها كل عنصر على حده .
13- تتفاعل بشدة مع الهواء الجوي لذلك تحفظ في الكاز (الكيروسين).

الخصائص الكيميائية لعناصر المجموعة
الأملاح البسيطة للفلزات القلوية:
تميل أملاح الفلزات القلوية لأن تكون شديدة الذوبان في الماء و خصوصا أملاح الصوديوم و الليثيوم ، على الرغم من وجود بعض أملاح للبوتاسيوم و الروبيديوم و السيزيوم لا تذوب في الماء ، و أيضا بعض الأملاح شحيحة الذوبان في الماء مثل LiF و Li2CO3 ، حيث تعتمد ذوبانية الملح على عاملين رئيسيين و هما طاقة الشبكية و طاقة الحلمأة (التحلل في الماء) للأيونات .
تميل جميع فلزات المجموعة الأولى إلى التفاعل مع الماء حيث يكون الليثيوم أبطأها و تزداد شدة ذلك التفاعل كلما انتقلنا في المجموعة من أعلى لأسفل ، حيث ينتج عن ذلك الهيدروكسيدات و غاز الهيدروجين .
2M + 2H2O → 2MOH + H2
تعتبر الهيدروكسيدات مفيدة في انتاج و تصنيع أملاحا أخرى من خلال معادلتها بحمض مناسب ، كما انها عندما تمتص ثاني أكسيد الكربون فإنها تنتج الكربونات المقابلة لها M2CO3 (ما عدا الليثيوم طبعا) و البيكربونات MHCO3 و التي بدورها عند تفكيكها بالحرارة تنتج الكربونات و التي تتفكك بوجود الحرارة العالية مكونة الأكسيد و ثاني أكسيد الكربون.
2NaHCO3 → Na2CO3 + H2O + CO2
أما النتراتات MNO3 حيث M صوديوم أو بوتاسيوم أو روبيديوم أو سيزيوم، فإنها تتفكك إلى نتريتات عند التسخين ، بينما LiNO3 تتفكك عند التسخين إلى Li2O .
2MNO3 → 2MNO2 + O2
أما هاليـدات الفلـزات القلويـة فهي معروفـة جيـدا ، فالأمـلاح مثـل CsCl و CsBr و CsI لها تركيب بلوري مشابه يعرف باسم تركيب كلوريد السيزيوم، بينما أملاح العناصر الأخرى لها تركيب كلوريد الصوديوم .
التفاعل مع الأكسجين :
عندما يتم تسخين الفلزات القلوية مع الأكسجين أو عندما تتفاعل مع الهواء فإنها تنتج الأكاسيد و تعتمد طبيعة و خصائص الأكاسيد الناتجة على الفلز بحد ذاته.
4Li + O2 → 2Li2O
2Na + O2 → Na2O2
K + O2 → KO2
لا يُكوِّن الليثيوم الأكسيد الأعلى ، أما فوق أكسيد الليثيوم Li2O2 (يحضر من خلال تفاعل هيدروكسيد الليثيوم مع فوق أكسيد الهيدروجين) فهو غير مستقر و يتفكك إلى Li2O و غاز الأكسجين ، و لكن عند انتقالنا في المجموعة من أعلى لأسفل نلاحظ بأن الأكاسيد العليا و فوق الأكاسيد تصبح أكثر استقرارا. ويمكن تحضير الأكاسيد الأحادية M2O للصوديوم إلى السيزيوم بتفاعل كميات زائدة من الفلز مع الأكسجين و ذلك لتجنب تشكل الأكاسيد العليا و / أو فوق الأكاسيد ، حيث يمكن لاحقا إزالة الزائد من الفلز عن طريق التبخير . كما يمكن تحضير الأكاسيد الأحادية أيضا عن طريق اختزال نتريت الفلز بالفلز ذاته:
6M + 2MNO2 → 4M2O + N2
عند تفاعل الفلزات القلوية مع الأوزون O3 فإنه تنتج أملاح الأوزينيدات MO3 و التي هي بارامغناطيسية.
التفاعل مع الماء
تتفاعل الفلزات القلوية بعنف مع الماء و ينتج عن ذلك تحرر كبير للحرارة.
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH +H2
التفاعل مع الهيدروجين
تتحد الفلزات القلوية مع الهيدروجين عند درجة حرارة 400 درجة سيليزية تقريبا ، ناتجا عن ذلك الهيدريدات الأيونية ذات درجات انصهار عالية.
2Na + H2 → 2NaH
2Li + H2 → 2LiH
وحيث أن الخاصية الكهرموجبية تزداد في المجموعة كلما انتقلنا فيها من أعلى لأسفل ، فإن سهولة تكوين الهيدريدات تقل كلما انتقلنا فيها من أعلى لأسفل. تتفاعل هيدريدات الفلزات القلوية بسهولة مع الماء ناتجا عن ذلك تحرير للهيدروجين .
NaH + H2O → NaOH + H2
التفاعل مع الهالوجينات
تتفاعل الفلزات القلوية بكل سهولة مع الهالوجينات (عناصر المجموعة 17) ناتجا عن ذلك هاليدات أيونية قابلة للذوبان بسهولة في الماء (ما عدا فلوريد الليثيوم LiF)، كما نلاحظ بأن أكثر العناصرميلا للتفاعل مع الهالوجينات هو السيزيوم و أقلها الليثيوم ، حيث أن الخاصية الكهرموجبية تزداد في المجموعة كلما انتقلنا فيها من أعلى لأسفل ، فإن سهولة تكوين الهاليدات تزداد كلما انتقلنا فيها من أعلى لأسفل. كما أن الفلزات القلوية تميل للتفاعل مع الهالوجينات حسب الترتيب التالي : الفلور ثم الكلور ثم البروم و أخيرا اليود .
2Na + Cl2 → 2NaCl
التفاعل مع النيتروجين
الليثيوم هو العنصر الوحيد من الفلزات القلوية الذي يتحد مع غاز النيتروجين حيث ينتج عن ذلك نيتريد الليثيوم و الذي من المفترض أن يكون مستقرا بسبب طاقة الشبكية العالية له بسبب الصغر الكبير لأنيونات الليثيوم +Li و كاتيونات النيتروجين–N3 . عند تميؤ نيتريد الليثيوم فإن الأمونيا تتشكل.
6Li + N2 → 2Li3N
Li3N + 3H2O → 3LiOH + NH3
عند تذويب الفلزات القلوية في سائل الأمونيا اللامائي فإنه تتشكل محاليل شديد الزرقة موصلة للتيار الكهربائي ، و هذه المحاليل تحتوي على كاتيونات فلزية أمونيائية مذابة و تعتبر عوامل اختزالية قوية .
الكربيدات
عند تسخين الليثيوم مع الكربون فهو يعطي كربيد الليثيوم Li2C2 و باقي عناصر المجموعة تُكون الكربيد بتفاعلها مع الأسيتيلين.
Na + C2H2 → NaHC2 → Na2C2
كما تتفاعل الفلزات القلوية بسهولة مع الإيثين (الأسيتيلين HC≡CH) و ينتج عن ذلك تكون الأثينيدات الفلزية. و عند تفاعلها مع الماء تعطي الأسيتيلين.
Na2C2 + H2O → 2 NaOH + C2H2
الطبيعة الإختزالية للفلزات القلوية
تعتبر جميع الفلزات القلوية عوامل اختزالية قوية ، فمن بين جميع الفلزات القلوية يعتبر الليثيوم الأكثر اختزالا بينما الصوديوم أضعفها . و على الرغم من أن الليثيوم يمتلك أعلى طاقة تأين ، ألا أنه يعتبر عامل مختزل قوي .
الأملاح الحمضية الأكسجينية
الكربونات و البيكربونات
نلاحظ في هذه المجموعة أن الإستقرارية الحرارية للكربونات و البيكربونات تزداد كلما انتقلنا في المجموعة من أعلى لأسفل . فنلاحظ هنا بأن كربونات الليثيوم غير مستقرة عند تعرضها للحرارة حيث تتفكك و ينتج عن ذلك CO2. بينما لا توجد مادة بيكربونات الليثيوم LiHCO3 في الحالة الصلبة أبدا .
Li2CO3 → Li2O + CO2
كما نلاحظ أيضا في هذه المجموعة بأن ذوبانية الكربونات و البيكربونات في الماء تزداد كلما انتقلنا في المجموعة من أعلى لأسفل ، و هي على النحو التالي :
Li2CO3< Na2CO3< K2CO3< Rb2CO3< Cs2CO3
و للبيكربونات على النحو التالي :
NaHCO3< KHCO3< RbHCO3< CsHCO3
النتراتات
عند تسخين نترات الليثيوم LiNO3 فإنه يتفكك ثنائي أكسيد النيتروجين NO2 و الأكسجين O2 .
4LiNO3 → 2LiO + 4NO2 + O2
بينما نتراتات العناصر الأخرى في نفس المجموعة تتفكك عند تعرضها للحرارة لتعطي الأكسجين فقط .
2NaNO3 → 2NaNO2 + O2
الكبريتات
مادة كبريتات الليثيوم Li2SO4 غير قابلة للذوبان في الماء ، بينما الكبريتات الأخرى مثل كبريتات الصوديوم Na2SO4 و K2SO4 قابلة للذوبان في الماء.
المركبات العضوية
تستبدل ذرة الهيدروجين في المركبات العضوية بأحد الفلزات القلوية مكونا أملاحا مثل خلات الصوديوم و بنزوات الصوديوم و غيرها.
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة