الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols : ملاحظة هامة: هذا المقال عبـــارة عن مختصر للفصل السابع من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الرابع: المركبات العطرية Aromatic Compounds
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
ما هي الكحولات؟ :
- تحتوي الكحولات على مجموعة الهيدروكسيل. في حالة الفينولات تكون مجموعة الهيدروكسيل متصلة مع الحلقة العطرية ، أما في حالة الثيولات فإن ذرة الأكسجين يتم استبدالها بذرة كبريت.

1 – تسمية الكحولات Nomenclature of Alcohols
- حسب نظام الأيوباك ، ينتهي اسم الكحولات باللاحقة -ول و الذي يشير إلى وجود مجموعة الهيدوكسيل فيها.
- أما في الأسماء الشائعة فإن كلمة الكحول تكون مفصولة و تأتي بعد اسم مجموعة الألكيل (في حالة اللغة الإنجليزية).

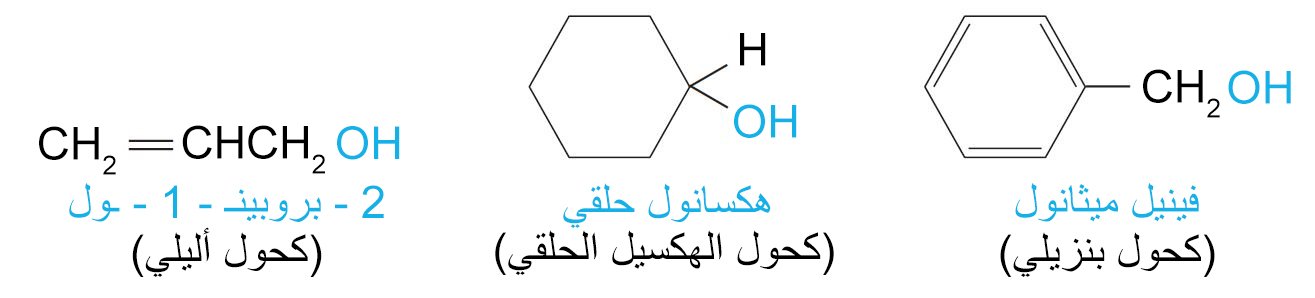
2 – تصنيف الكحولات Classification of Alcohols
- تصنف الكحولات إلى كحولات أولية أو ثانوية أو ثلاثية، وذلك اعتمادا ما إذا ارتبطت مجموعة أو مجموعتين أو ثلاث مجموعات عضوية بذرة الكربون المرتبط بها مجموعة الهيدروكسيل.

3 – تسمية الفينولات Nomenclature of Phenols
- تسمى الفينولات كمشتقات للمركبات الأم (الأصلية).
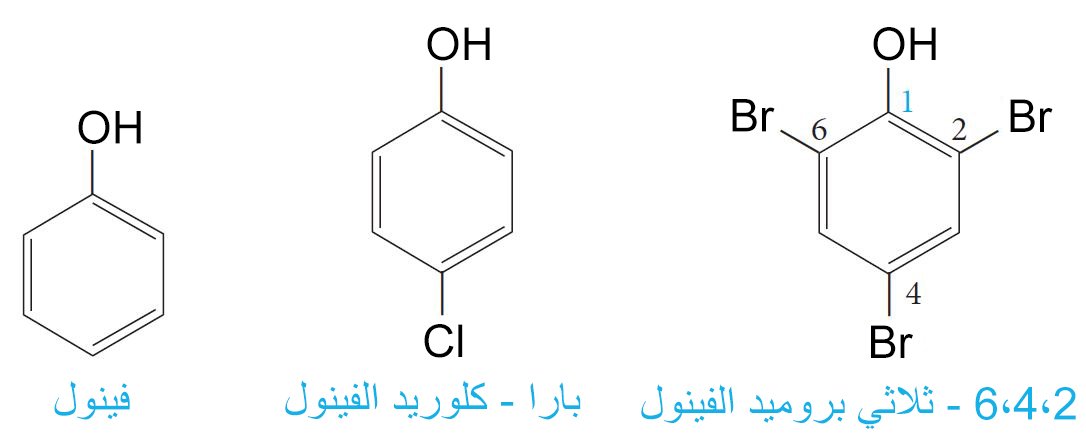
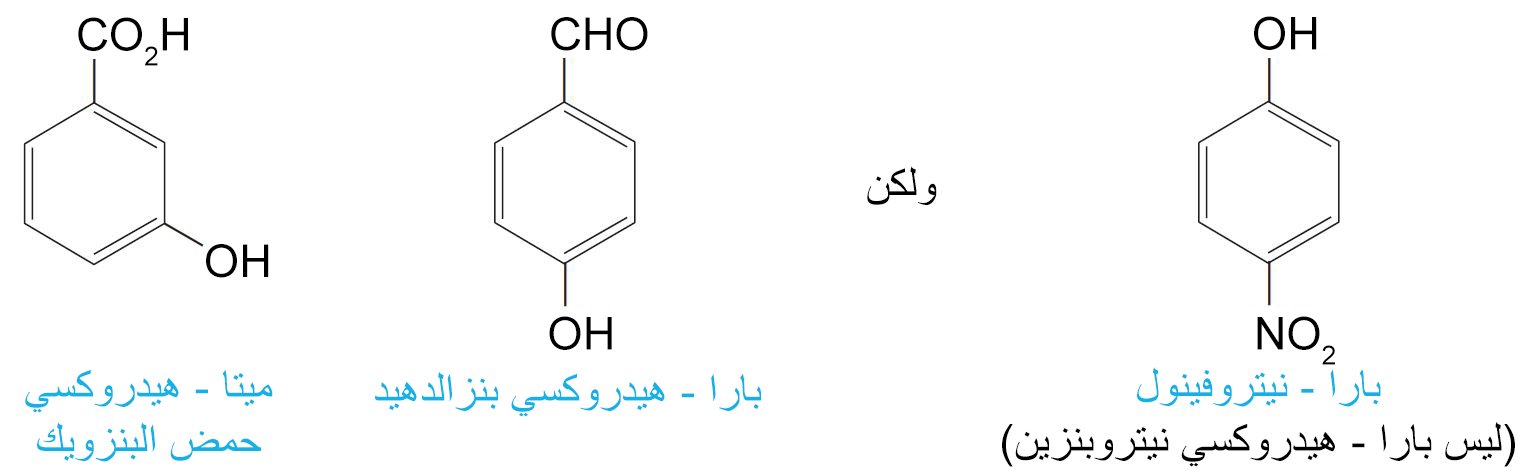
- إذا وجدت مجموعة الهيدروكسيل في نفس الجزيء الذي يحتوي على المجموعة الوظيفية لحمض كربوكسيلي أو الألدهيد أو كيتون ، فإنه سيتم تسمية مجموعة الهيدروكسيل كمجموعة بديلة.
4 – الرابطة الهيدرجينية في الكحولات والفينولات Hydrogen Bonding in
Alcohols and Phenols
- بسبب قدرة الكحولات على تكوين روابط هيدروجينية بين بعضها البعض فإن درجات غليان الكحولات تكون أعلى بكثير من تلك للإيثرات و الهيدروكربونات التي لها أوزان جزيئية مشابة لها.

- يمكن للكحولات ذات الوزن الجزيئي المنخفض أن تحل محل جزيئات الماء في شبكة الترابطة الهيدوجيني.
- كلما طالت سلسلة الكحول فإنه سوف يصبح يشبه في خصائصةه تقريبا شبه الهيدروكربونات، لذلك تقل ذائبيته في الماء.
5 – مراجعة لمفهومي الحمضية و القاعدية Acidity and Basicity Reviewed
- طبقا لتعريف برونستد و لوري فإن الحمض هو مادة تمنح البروتونات و القاعدة هي التي تستقبل البروتونات.

- في التفاعل السابق فإن الماء سلك سلوك القاعدة و كلوريد الهيدروجين سلك سلوك الحمض.
تسمى النواتج التي نتجت من تبادل البروتون بين الماء وكلوريد الهيدروجين بالحمض المرافق و القاعدة المرافقة.
تقاس قوة الحمض في الماء كميا عن طريق ثابت الحموضة أو ثابت التأين Ka الخاصة به.
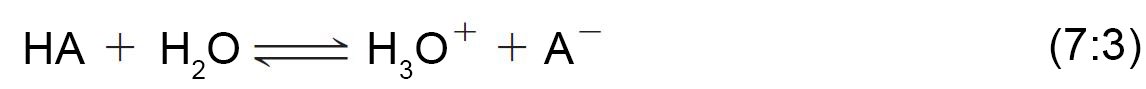

- كلما كان الحمض قويا إنزاح الإتزان جهة اليمين و بالتالي يزداد تركيز +H3O و أيضا قيمة Ka . فللماء مثلا فإن قيمة Ka يمكن حسابها كالآتي.


- غالبا ما نعبر عن الحمضية على شكل pKa ، و هو اللوغاريثم السالب لثابت الحموضة.

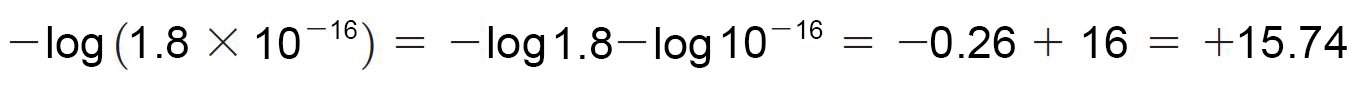
- كلما كانت قيمة Ka أقل أو قيمة pKa أكبر ، كان الحمض ضعيفا.
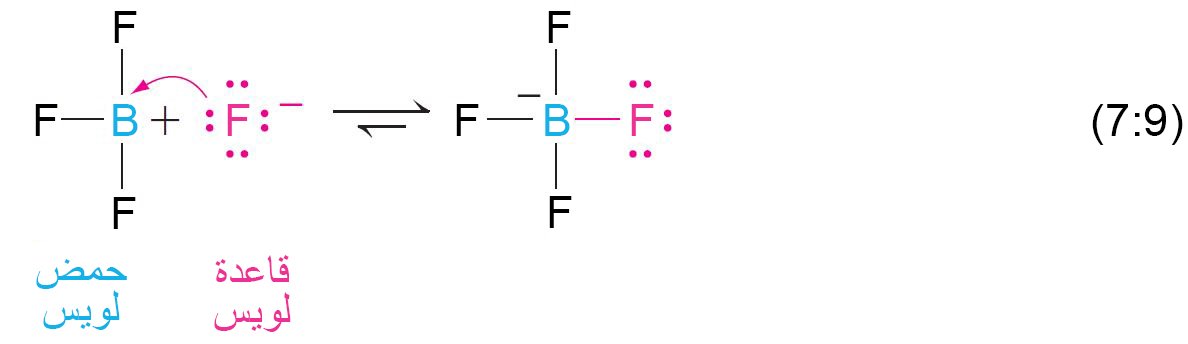
- طبقا لتعريف لويس فإن حمض لويس هو مادة التي يمكن أن تستقبل زوجا من الإلكتونات و قاعدة لويس هي المادة التي يمكن أن تمنح زوجا من الإلكترونات.

- أي ذرة تحتوي على زوجا من الإلكترونات غير الرابطة يمكن أن تعد قاعدة لويس.
- بعض المواد يمكن أن تسلك سلوك الحموض أو سلوك القواعد و ذلك حسب المادة التي تتقاعل معها و هذه المواد يطلق عليها مصطلح مترددة أو أمفوتيرية.

6 – حمضية الكحولات و الفينولات Acidity of Alcohols and
Phenols
- الكحولات و الفينولات حموض ضعيفة.
- يمكن أن تعمل مجموعة الهيدروكسيل في الكحولات والفينولات كمانحة للبروتونات.

- إن القاعدة المرافقة للكحول هي أيون ألكوكسيد (مثلا: أيون الميثوكسيد من الميثانول و أيون الإيثوكسيد من الإيثانول ، و هكذا).
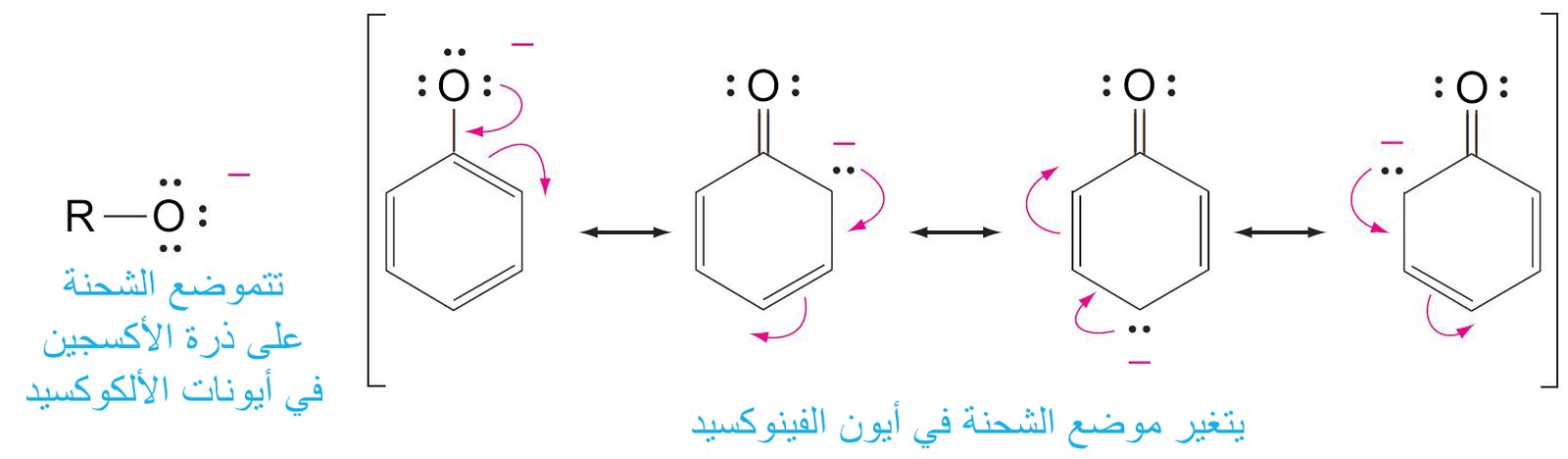
- الفينولات حموضا اقوى من الكحولات و ذلك بسبب كون أيونات الفينوكسيد المقابلة تكون أكثر استقرارا من خلال الرنين.
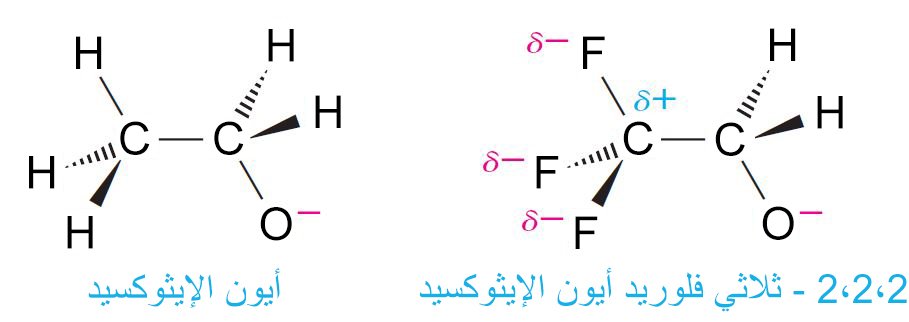
- إن 2،2،2 – ثلاثي فلوريد الإيثانول حمض قوي لأن الفلور عنصر ذو كهروسالبية عالية جدا و بالتلي تصبح كل رابطة C-F مستقطبة بحيث يحمل الفلور شحنة جزئية سالبة جزئية والكربون يحمل شحنة جزئية موجبة و التي تكون بالقرب من الشحنة السالبة التي على ذرة الكربون القريبة منها و بالتالي تتم معادلة شحنة الكربون بسبب التأثير الحثي.
- مثال آخر على التأثير الحثي يظهر في مركب بارا-نيتروفينول و الذي حمض قوي جدا مقارنة مع الفينول. و في هذه الحالة تعمل مجموعة النيترو بطرقتين لاستقرارية أيون البارانيتروفينوكسيد.

- كلما زاد عدد مجموعات النيترو على حلقة البنزين زادت الحمضية الفينولية. فحمض البكريك (6،4،2 – ثلاثي نيتروفينول حمض أقوى من بارا-نيتروفينول.
- إن معالجة الكحولات باستخدام هيدروكسيد الصوديوم لا يحولها إلى الألكوكسيدات الخاصة بها. وذلك لأن الألكوكسيدات هي قواعد أقوى من أيونات الهيدروكسيد.
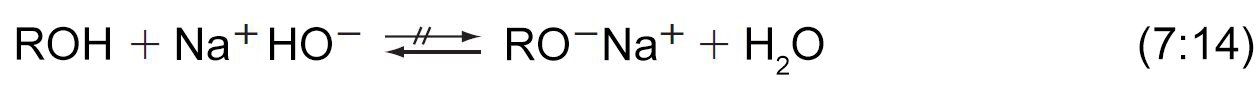

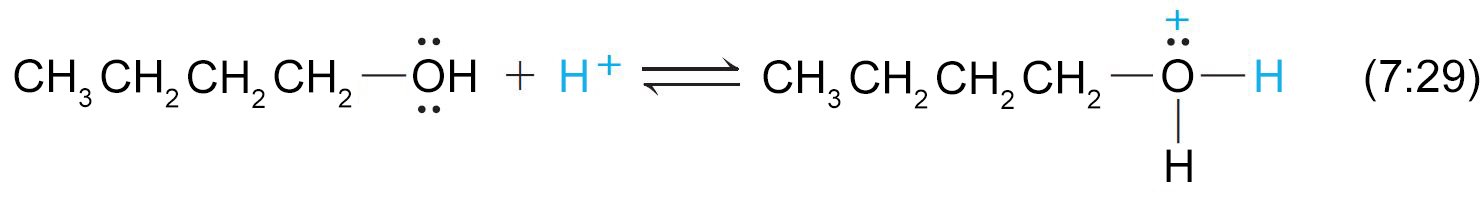
7 – قاعدية الكحولات و الفينولات The Basicity of Alcohols and Phenols
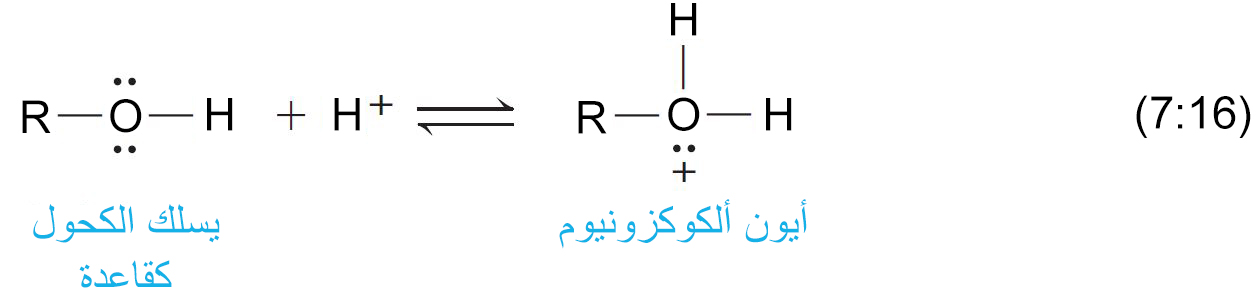
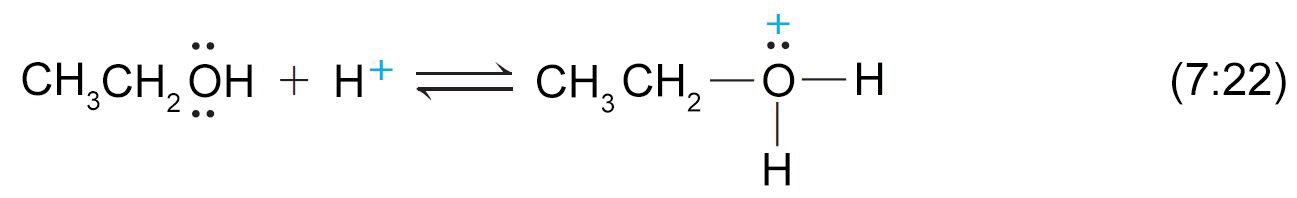
- يمكن للكحولات و للفينولات أيضا أن تسلك سلوك القواعد.
- فهي تمتلك زوجا من الالكترونات الحرة على ذرة الأكسجين و هي بذلك تعتبر قواعد لويس.
- و يمكن لها أن تستقبل أيون الهيدروجين من الحموض القوية و ينتج عن ذلك تكون أيون الألكيلوكسونيوم.
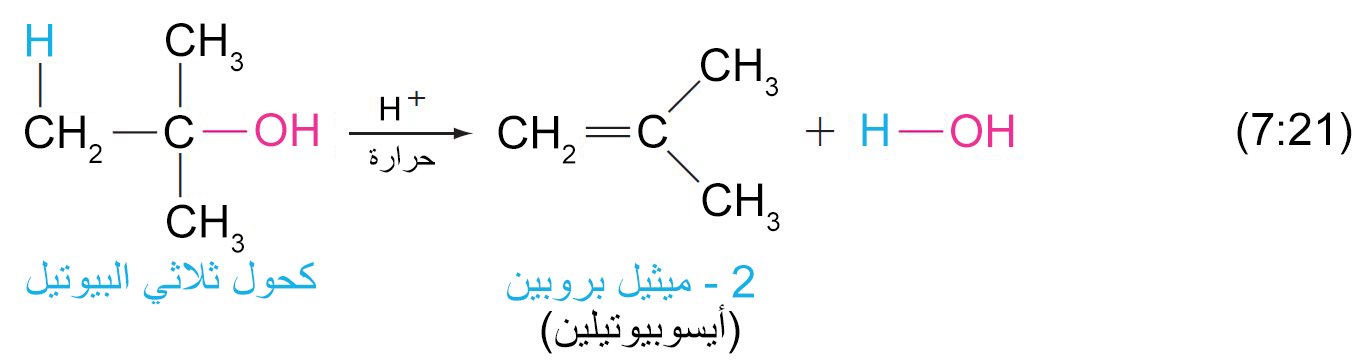
8 – نزع الماء من الكحولات (بلهمة الكحولات) لإنتاج الألكينات Dehydration of alcohols to Alkenes
- يمكن نزع الماء من الكحول (بلمهة الكحول) عن طريق تسخينها مع حمض قوي و يكون الناتج ألكين.
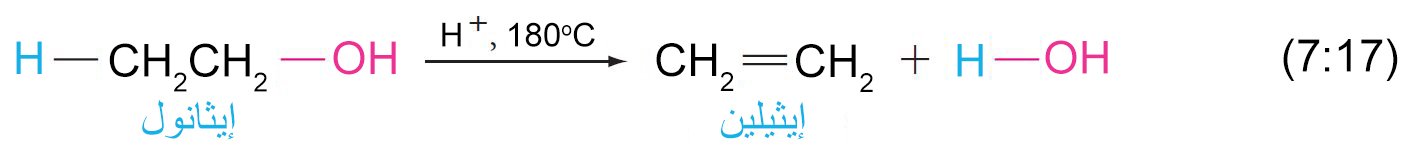
- هذا النوع من التفاعلات يعتبر تفاعل إزالة و يمكن أن يحدث إما بميكانيكية E1 أو E2 و ذلك اعتمادا على نوع الكحول.
- أما الكحولات الثالثية فإنها تسلك الميكانيكية E1 .
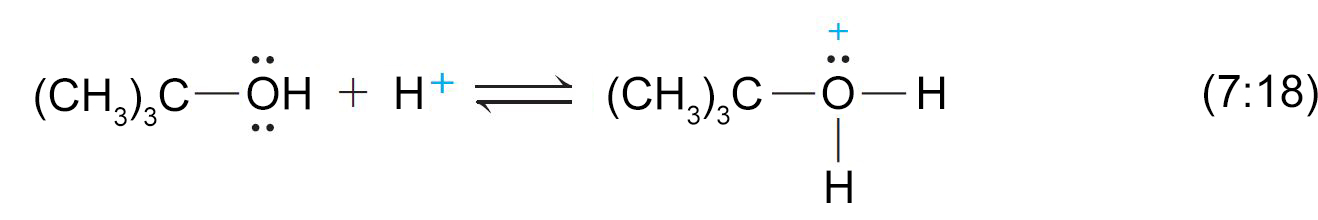
- تحدث عملية التأين سريعا لأن الكربوكاتيون الناتج يكون ثالثي.
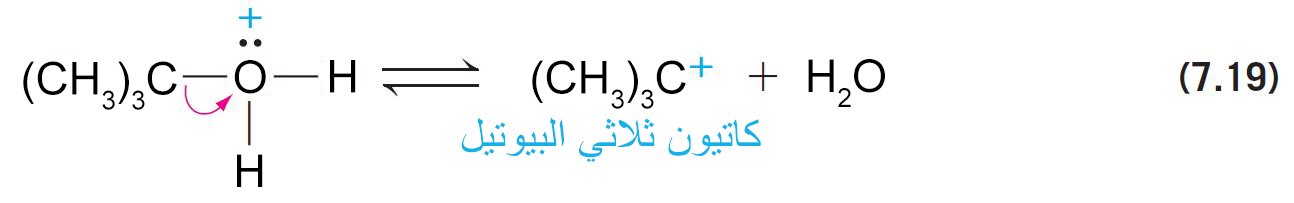
- كما أن فقدان بروتون (+H) من ذرة الكربون المجاورة إلى ذرة الكربون الموجبة يكمل التفاعل.
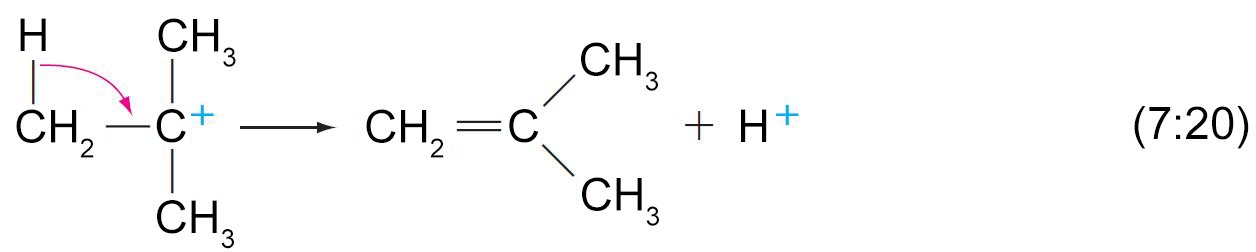
- في الكحولات الأولية، فقدان الماء و البروتون المجاور يحدث بالتزامن في ميكانيكية E2 .
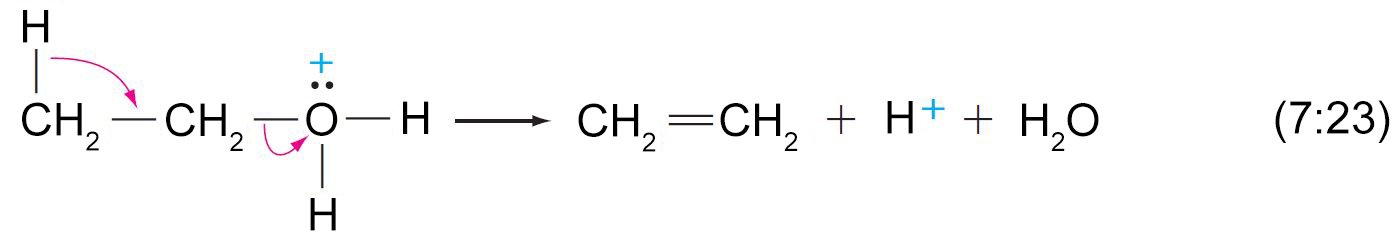
- تبدأ عملية إزالة الماء من الكحولات بإضافة البروتون (برتنة) إلى مجموعة الهيدروكسيل.
- سهولة إزالة الماء من الكحول على الترتيب الآتي: الثالثية ثم الثانوية ثم الأولية.
- أحيانا يمكن لكحول واحد أن يعطي ألكينين أو أكثر. فمثلا يمكن لإزالة الماء من مركب 2 -ميثيل- 2 – بيوتانول أن ينتج إلكينين.

- الألكين الذي يكون فيه الرابطة الثنائية مرتبطة أكبر عدد ممكن من مجموعات الألكيل هو الذي يسود. لذلك في المثال السابق نلاحظ أن المنتج السائد هو 2 – ميثيل- 2 – بيوتين.
9 – تفاعلات الكحولات مع هاليدات الهيدروجين The Reaction of Alcohols with Hydrogen Halides
- يمكن للكحولات أن تتفاعل مع هاليدات الهيدروجين (HCl و HBr و HI) و ينتج عن ذلك هاليدات الألكيل (الكلوريدات، و البروميدات و اليوديدات) .

- يعتمد معدل سرعة التفاعل و ميكانيكية التفاعل على نوع الكحول (ثالثي، ثانوي، أولي).
تتفاعل الكحولات الثلاثية بشكل أسرع.فمثلا يمكننا تحويل الكحول ثلاثي البيوتيل إلى كلوريد ثلاثي البيوتيل ببساطة عن طريق خضه جيدا مع حمض الهيدروكلوريك المركز لبضع دقائق عند درجة حرارة الغرفة (rt) . - يحدث التفاعل من خلال ميكانيكية SN1 .


- من ناحية أخرى ، يتفاعل 1 -بيوتانول ، وهو كحول أولي، ببطء ويجب تسخينه لعدة ساعات مع خليط مكون من حمض الهيدروكلوريك المركز و محفز مثل كلوريد الخارصين لتحقيق نفس النوع من التفاعل.
- يحدث التفاعل من خلال ميكانيكية SN2 .


10 – طرق أخرى لتحضير هاليدات الألكيل من الكحولات Other Ways to Prepare Alkyl Halides from Alcohols
- هناك طريقة أخرى لتحضير هاليدات الألكيل وهي عن طريق تفاعل الكحول مع كلوريد الثيونيل الذي يعطي هاليد الألكيل و ثاني أكسيد الكبريت و حمض الهيدروكلوريك كمنتجات غازية.
- ومن عيوب هذه الطريقة أنها غير مناسبة لإعداد كلوريد ألكيل منخفض الغليان (حيث يحتوي R على عدد قليل من ذرات الكربون) ، لأنها تغلي بسهولة و تتطاير من خليط التفاعل مع المنتجات الغازية.

- و أيضا لتحضير هاليدات الألكيل هو من خلال تفاعل الكحول مع هاليدات الفوسفور و الذي ينتج عن ذلك هاليد الألكيل و حمض الفوسفوروز.

- إن لحمض الفوسفوروز ، درجة غليان عالية إلى حد ما. وبالتالي ، فإنه يمكن استخلاص هاليد الألكيل ذو درجة غليان منخفضة من خليط التفاعل و عزله عن طريق التقطير.
11 – مقارنة بين الكحولات و الفينولات A Comparison of Alcohols and Phenols
- من السهل بمكان و عن طريق تحفيز حمضي أن يتم كسر الرابطة C-OH في الكحولات و لكن هذه الرابطة صعب جدا لأن تكسر في الفينولات.
- يمكن أن يتم إضافة أيون الهيدروجين (برتنة) مجموعة الهيدروكسيل الفينولية ، و لكن فقدان جزيء الماء ممكن أن يتسبب بتكوين كاتيون الفينيل
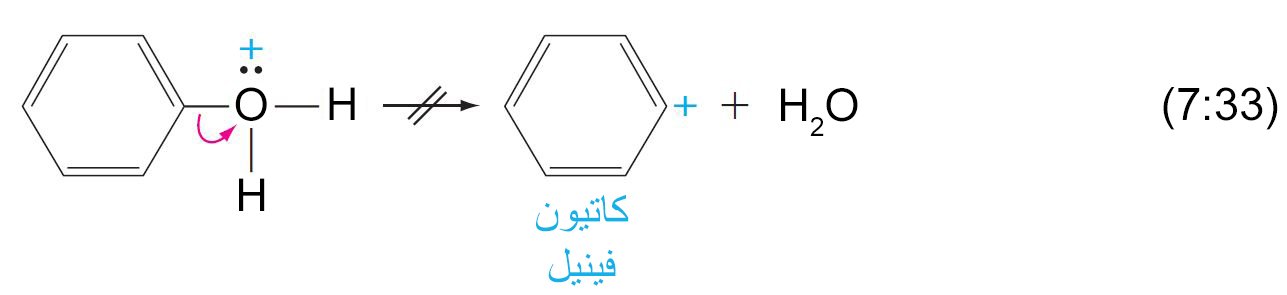
- إن كاتيونات الفينيل غير مستقرة من حيث الطاقة و بالتالي بصعوبة بمكان أن تتشكل.
- لا يمكن أن يحدث استبدال لمجموعة الهيدروكسيل في الفينولات من خلال ميكانيكية SN1 .
- لا يمكن أن تتسبب هاليدات الهيدروجين أو هاليدات الفوسفور أو هاليدات الثيونيل بحدوث استبدال لمجموعة الهيدروكسيل بالهالوجينات في الفينولات .
12 – أكسدة الكحولات إلى الألدهيدات و الكيتونات و الحموض الكربوكسيلية Oxidation of Alcohols to Aldehydes, Ketones, and Carboxylic Acids
- ينتج عن أكسدة الكحولات الأولية الألدهيدات ، و التي قد تتأكسد أيضًا إلى حموض كربوكسيلية.
- ينتج عن أكسدة الكحولات الثانوية الكيتونات.
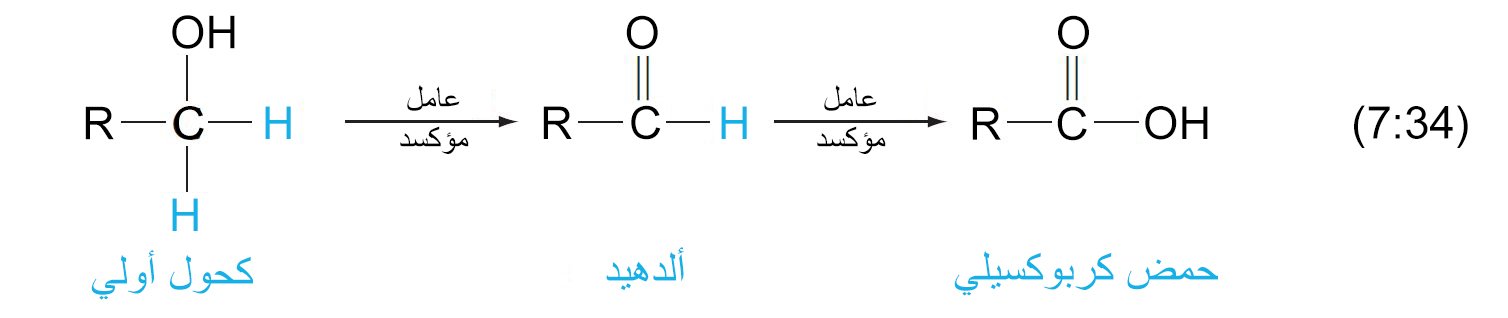
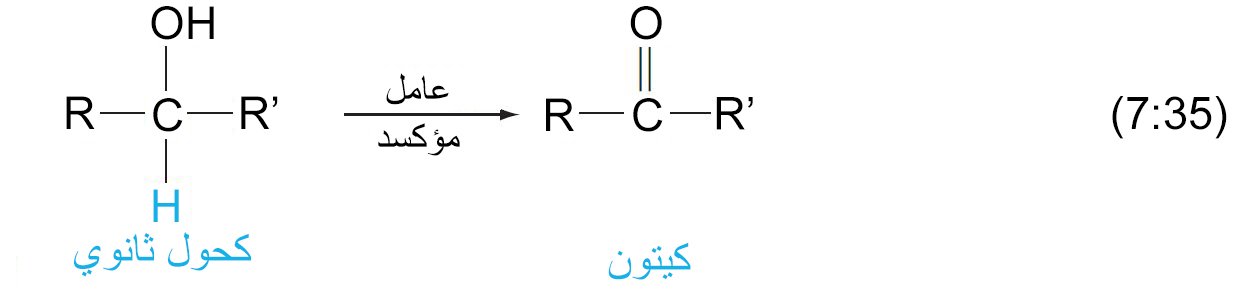
- لا تمتلك الكحولات الثالثية أي ذرة هيدروجين على ذرة الكربون المتصلة بها مجموعة الهيدروكسيل و بالتالي لا تتأثر بتفاعل الأكسدة.
- من عوامل الاكسدة للكحولات الشائعة في المختبر هو أنهيدريد الكروميك CrO3 مذابا في حمض الكبريتيك المخفف بالماء (كاشف جونز) ، كما يستعمل الأسيتون كمذيب في مثل هذه الحالات من الأكسدة.
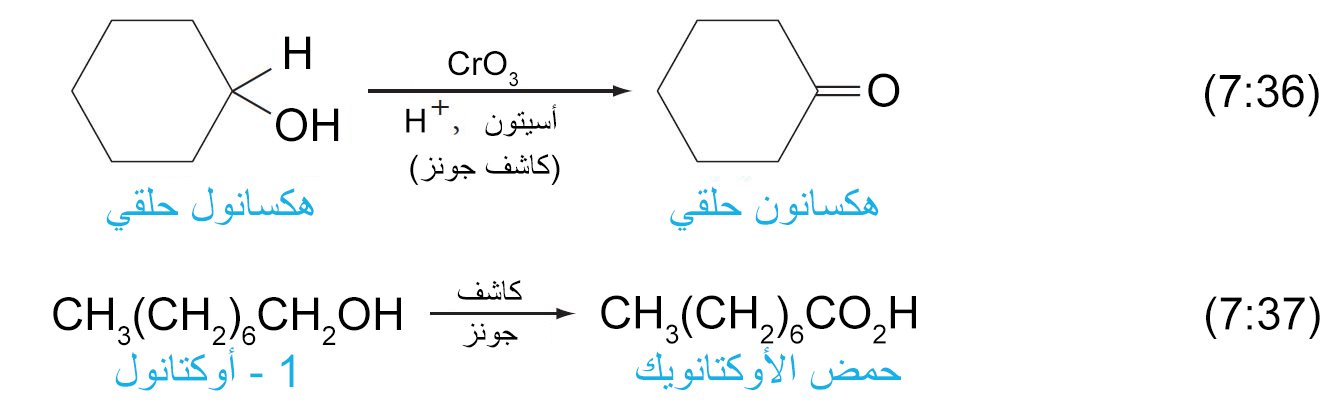
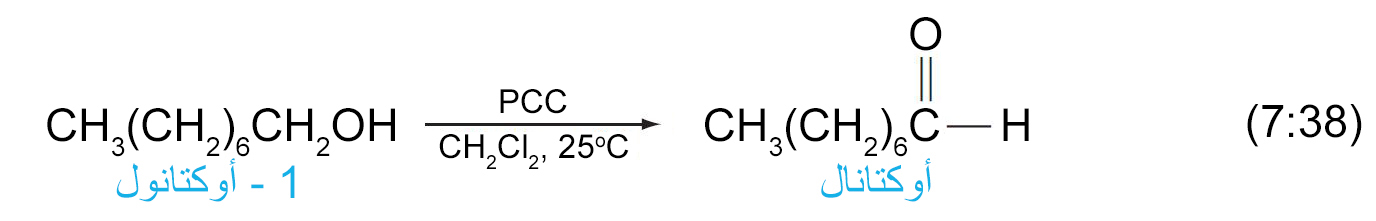
- في حالة الكحولات الأولية يمكن أيقاف علية الأكسدة إلى مرحلة تكون الألدهيد و ذلك عن طريق استخدام كواشف خاصة (عوامل مؤكسدة ضعيفة) مثل كلوروكرومات البيريدينيوم PCC .
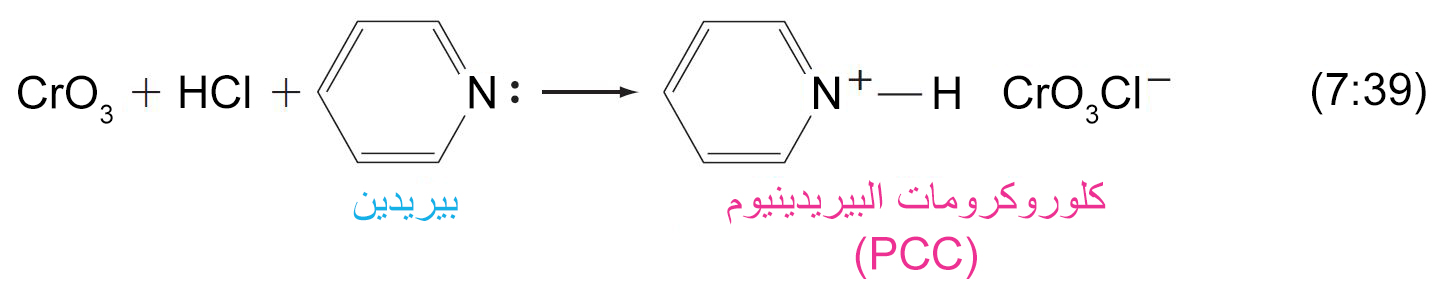
يمكن تحضير PCC عن طريق تذويب CrO3 في حمض الهيدروكلوريك و من ثم إضافة البيريدين .
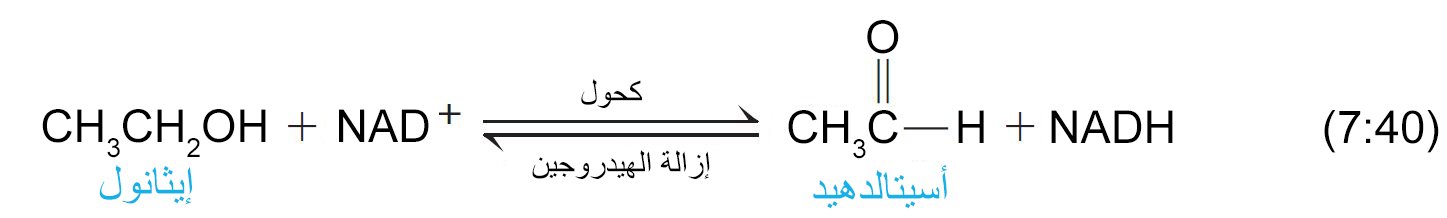
- يمكن أن يتأكسد الإيثانول في الكبد عن طريق NAD + (أدينين النيكوتيناميد ثنائي النوكليوتيد) إلى الأسيتالديهيد.
- يمكن للأسيتالدهيد يتأكسد في الجسم إلى حمض الخليك وفي النهاية إلى ثاني أكسيد الكربون والماء.
13- الكحولات التي فيها أكثر من مجموعة هيدروكسيل واحدة Alcohols with More Than One Hydroxyl Group
- تسمى المركبات التي تضم مجموعتي هيدروكسيل متجاورتين باسم الجلايكولات ، مثل جلايكول الإثيلين.
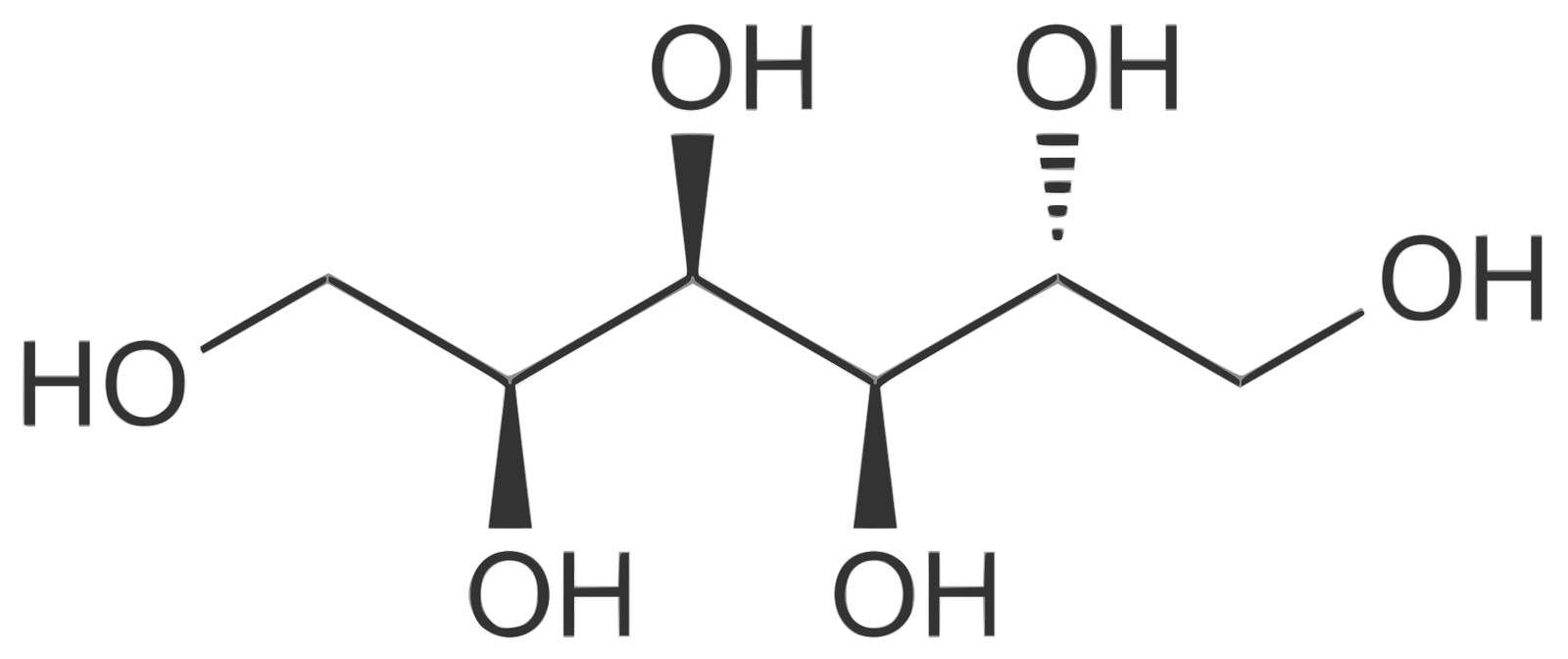
- المركبات التي توجد فيها أكثر من مجموعتي هيدروكسيل معروفة أيضًاو هي عديدة ، مثل الجليرول و السوربيتول ، و هي مواد كيميائية تجارية مهمة.

سوربيتول

جليسرين
- يستخدم جلايكول الإيثيلين كمادة مانعة للتجمد في مشعات السيارات و كمادة خام في صناعة الداكرون.
- الجلسرين هو سائل حلو ، عديم اللون ، قابل للذوبان في الماء، و ذو درجة غليان عالية وذو طعم حلو متميز. صفاته اللطيفة تجعله مفيدًا في صناعة صابون الحلاقة و صابون التواليت وفي العصائر.
- ينتج عن نترتة الجلسرين ثلاثي نترات الجليسرين (النتروجليسرين) ،و هي مادة متفجرة وحساسة للصدمات.

- يستخدم النتروجليسرين أيضًا في الطب باعتباره موسع للأوعية الدموية لمنع النوبات القلبية لدى المرضى الذين يعانون من الذبحة الصدرية.
- السوربيتول , والذي يحتوي على العديد من مجموعات الهيدروكسيل فهو قابل للذوبان في الماء. و هو تقريبا حلو مثل قصب السكر ويستخدم في صنع الحلوى وكبديل للسكر لمرضى السكر.
14 – الاستبدال العطري في الفينولات Aromatic Substitution in Phenols
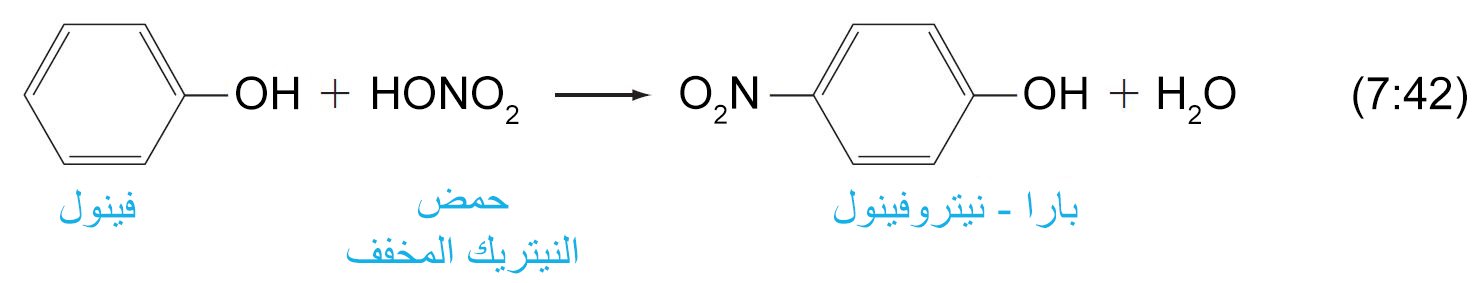
- يمكن أن تخضع الفينولات للاستبدال النيوكليوفيلي العطري تحت ظروف نعتدلة للغاية. فمثلا يمكن نترتة الفينول عن طريق حمض النتريك المخفف.
- كما يمكن برومة الفينول سريعا عن طريق ماء البروم لينتج 6،4،2 – ثلاثي بروميد الفينول.

15 – اكسدة الفينولات Oxidation of Phenols
- يمكن للفينولات أن تتأكسد بسهولة.
- فمثلا، يمكن للهيدروكينون (4،1 – ثنائي هيدروكسي بنزين) أن يتأكسد و ينتج عن تأكسده 4،1 – بنزوكينون (يعرف باسم كينون).
- يمكن لتفاعل أكسدة الهيدروكينونات إلى كينونات أن يكون عكوسا.

16 – الفينولات كمضادات للأكسدة Phenols as Antioxidants
- الفينولات هي مضادات للأكسدة حيث تمنع أكسدة المواد من خلال الهواء الجوي مثل الأطعمة و زيوت التشحيم.
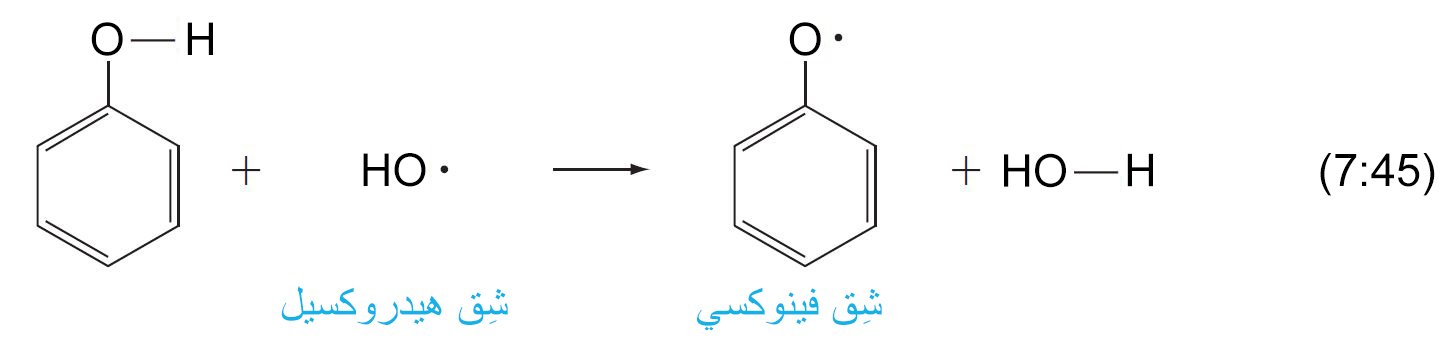
- تتفاعل الفينولات و تحطم شقوق البيروكسي (.ROO) و الهيدروكسي (.HO)
اثنان من مضادات الأكسدة الفينولية التجارية هما BHA (هيدروكسي أنيسول البوتيلي) والذي يستخدم كمضاد للأكسدة في الأطعمة ، وخاصة منتجات اللحوم. و BHT (هيدروكسي تولوين البيوتيلي) الذي يستخدم ليس فقط في الأغذية والأعلاف الحيوانية والزيوت النباتية ، ولكن أيضًا في زيوت التشحيم والمطاط الصناعي ومواد بلاستيكية مختلفة.
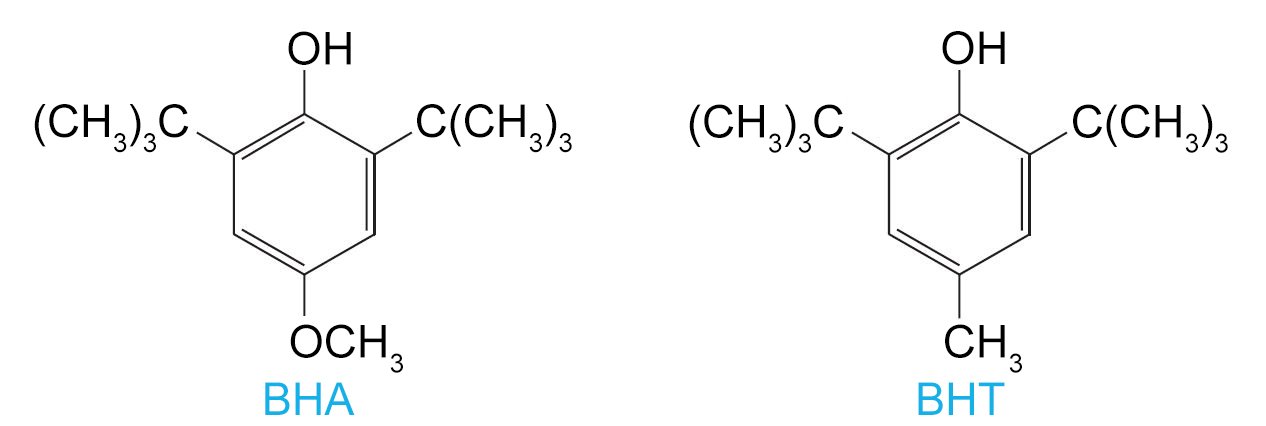
- يعتبر فيتامين (هـ) E مضاد أكسدة فينولي و الذي يعمل على حماية الجسم من الشقوق الحرة.
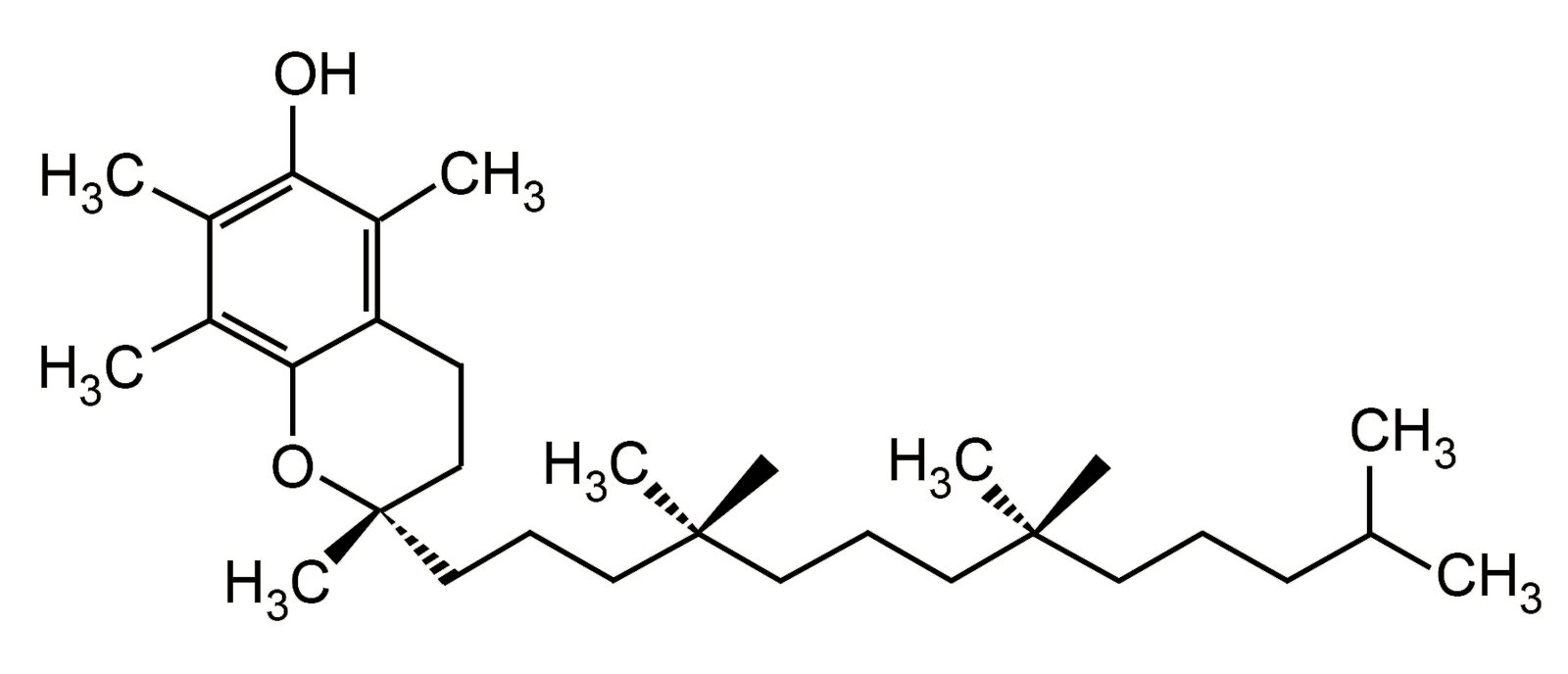
فيتامين هـ (E)
17 – الثيولات متماثلات الكبريت للكحولات و الفينولات Thiols, the Sulfur Analogs of Alcohols and Phenols
- الثيولات هي مركبات تحتوي على مجموعة SH- (مجموعة السلفيدريل) .
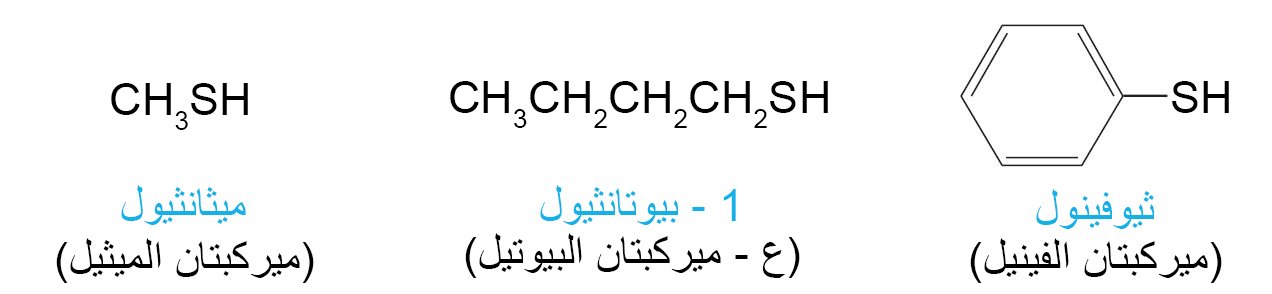
- تسمى الثيولات أحيانا باسم الميركبتانات و هو اسم يشير إلأى تفاعلها مع أيون الزئبقيك لتكوين أملاح الزئبق و التي تسمى الميركبتيدات.
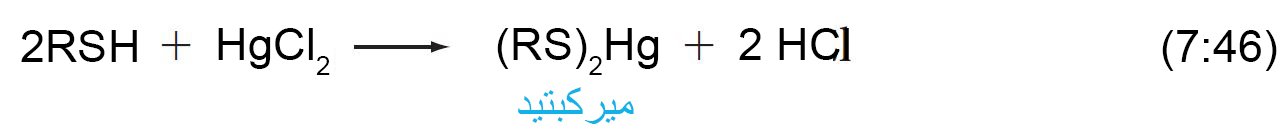
- يمكن تحضير ثيولات الألكيل عن طريق تفاعل هاليدات الالكيل مع أيون السلفيدريل.

- للثيولات رائحة كريه و مميزة. فمثلا الثيولات CH3CH=CHCH2SH و CH3)2CHCH2CH2SH) هي المسؤولة عن الرائحة الكريهة للظربان (إبن عرس).
- الثيولات أكثر حموضة من الكحولات.
- تتفاعل الثيولات مع القواعد المائية و ينتج عنها الثيولاتات.

- يمكن للثيولات أن تتأكسد بسهولة إلى ثنائي الكبريتيدات و هي مركبات تحتوي على رابطة S-S من خلال عامل مؤكسد معتدل مثل فوق أكسيد الهيدروجين و اليود.

بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
أشكركم جزيل الشكر والتقدير والاحترام
كل الشكر لتصفحكم الكريم للموقع