معلومات يمكن استخلاصها من المعادلة الكيميائية الموزونة
information conveyed by a chemical equation
يمكن للمعادلة الكيميائية ان توفر معلومات نوعية وكمية للمواد المتفاعلة والناتجة.
فمن المعلومات النوعية التي يمكن معرفتها من المعادلة الكيميائية: أسماء المواد المتفاعلة وأسماء المواد الناتجة الداخلة في التفاعل.
أما من ناحية المعلومات الكمية التي يمكن للتفاعل الكيميائية فهي:
1 – يمكن للتفاعل الكيميائي أن يخبرنا بالعدد الفعلي للمواد المتفاعلة والمواد الناتجة (سواء كانت ذرات أو جزيئات) الداخلة في التفاعل.
2 – يمكن للتفاعل الكيميائي أن يخبرنا بالكتل النسبية للمواد المتفاعلة والمواد الناتجة الداخلة في التفاعل.
3 – يمكن للمعادلة الكيميائية أن تخبرنا أيضا بعدد مولات المواد المتفاعلة والمواد الناتجة.
4 – ويمكن للتفاعل الكيميائي أن يخبرنا بحجوم الغازات المتفاعلة أو حجوم الغازات الناتجة إن وجدت.
مثال :
| CO2(g) ↑ | + | H2O(l) | + | CaCl2(s)↓ | → | 2HCl(aq) | + | CaCO3(s) | |
| ثاني أكسيد الكربون | ماء | كلوريد الكالسيوم | حمض الهيدروكلوريك | كربونات الكالسيوم | اسم المادة | ||||
| غاز | سائل | صلب | محلول مائي | صلب | الحالة الفيزيائية للمواد المتفاعلة و المواد الناتجة | ||||
| 1 | 1 | 1 | 2 | 1 | عدد المولات | ||||
| 1 | 1 | 1 | 2 | 1 | عدد الجزيئات | ||||
| (16×2)+12 (44)= | 16+(1×2) (18)= | (35.5×2)+40 (111)= | (35.5+1)2 (73)= | 48+12+40 (100)= | الوزن الجزيئي |
من خلال دراستنا للتفاعل السابق يمكننا أن نعرف أن:
1 – من خلال التفاعل السابق يمكن معرفة أن تفاعل كربونات الكالسيوم مع محلول حمض الهيدروكلوريك ينتج كلوريد الكالسيوم والماء و ثاني أكسيد الكربون.
2 – من خلال المعادلة الكيميائية يمكن معرفة التركيب الكيميائي للمواد المتفاعلة و للمواد الناتجة أيضا، ففي التفاعل السابق على سبيل المثال اصبحنا نعلم أن مادة كربونات الكالسيوم CaCO3 مكونة من ذرة كالسيوم و ذرة كربون و ثلاث ذرات أكسجين.
3 – تفاعل جزيء واحد من كربونات الكالسيوم مع جزيئين من حمض الهيدروكلوريك ينتج عنه جزيء واحد من كلوريد الكالسيوم وجزيء واحد من الماء و جزيء واحد من ثاني أكسيد الكربون.
4 – من خلال المعادلة الكيميائية يمكن حساب أو معرفة الأوزان الجزيئية لكل من المواد المتفاعلة و المواد الناتجة ، فمثلا الوزن الجزيئي لكربونات الكالسيوم هو 100 جرام/مول ، و الوزن الجزيئي لثاني أكسيد الكربون هو 44 جرام/مول .
5 – تفاعل 100 جزء بالوزن من كربونات الكالسيوم مع 73 جزء بالوزن من حمض الهيدروكلوريك ينتج عنه 111 جزء بالوزن من كلوريد الكالسيوم و 18 جزء بالوزن من الماء و 44 جزء بالوزن من ثاني أكسيد الكربون.
6 – تفاعل مول واحد من كربونات الكالسيوم مع مولين من حمض الهيدروكلوريك ينتج عنه مول واحد من كلوريد الكالسيوم و مول واحد من الماء و مول واحد من ثاني أكسيد الكربون.
7 – تفاعل مول واحد من كربونات الكالسيوم مع مولين من حمض الهيدروكلوريك ينتج عنه مول واحد من كلوريد الكالسيوم و مول واحد من الماء و 22.4 لترا من ثاني أكسيد الكربون عند درجة الحرارة و الضغط القياسيين. (نظرا لكون ثاني أكسيد الكربون مادة غازية فإن المول الواحد من أي غاز يشغل حجما مقداره 22.4 لتر).
8 – تخبرنا المعادلة الكيميائية الموزونة أيضا أن كمية المواد المتفاعلة يجب أن تتساوي مع كمية المواد الناتجة و العكس صحيح . فمن خلال التفاعل السابق نجد بأن أوزان المواد المتفاعلة ( 100 + 73 = 173 ) و هو مساوٍ لأوزان المواد الناتجة ( 111 + 18 + 44 = 173 ) و هنا إثبات لقانون حفظ المادة.
9 – الحالة الفيزيائية للمواد المتفاعلة و المواد الناتجة حيث تشير الرموز (s) : صلب ، (l) : سائل ، (g) : غاز ، (aq) : محلول مائي .
10 – يمكن من خلال المعادلة الكيميائية يمكن ان نعرف ما إذا تكونت مادة على شكل راسب (يشار بجانبها بالرمز ↓) أو تكونت مادة غازية (يشار بجانبها بالرمز↑ ).
معلومات أخرى يمكن أن تخبرنا بها المعادلة الكيميائية الموزونة
11 – في حالة وجود موادا متفاعلة أو ناتجة حموضا أو قواعد ، فإنه من خلال المعادلة الكيميائية يمكن معرفة ما إذا كانت المواد المتفاعلة أو الناتجة مركزة أو مخففة ، وذلك بإضافة الاختصار dil. أمام الصيغة الكيميائية إذا كانت المادة مخففة ،أو إضافة الاختصار con. قبل الصيغة الكيميائية إذا كانت المادة مركزة . مثال :
Zn(s) + dil. H2SO4(aq) → ZnSO4(aq) + H2(g)
12 – من خلال المعادلة الكيميائية يمكن معرف ظروف التفاعل من حيث درجة الحرارة أو الضغط أو ما إذا تم استخدام مادة محفزة لإتمام التفاعل ، مثال :

فالتفاعل السابق يخبرنا بأن تفاعل غاز النيتروجين N2 مع غاز الهيدروجين H2 لإنتاج الأمونيا NH3 قد تم عند درجة حرارة 723 كلفن و ضغط جوي 600 ضغط جوي و باستخدام الحديد كمادة محفزة للتفاعل .
13 – إذا وجد هذا الرمز ( Δ ) فوق السهو الفاصل بين المواد المتفاعلة و المواد الناتجة ذلك يعني أن التفاعل الكيميائي احتاج إلى حرارة لكي يتم . فمثلا عند تسخين كربونات الكالسيوم فإنه يتفكك و ينتج عن ذلك أكسيد الكالسيوم CaO و ثاني أكسيد الكربون CO2.
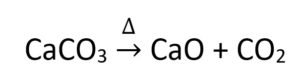
14 – يمكن من خلال المعادلة الكيميائية الإشارة إلى سرعة التفاعل الكيميائي بإضافة كلمة fast فوق السهم للإشارة إلى أن التفاعل سريعا أو إضافة الكلمة slow فوق السهم للإشارة إلى أن التفاعل بطيئا .
15 – من خلال المعادلة الكيميائية يمكن أن نعرف ما إذا كان هناك اطلاق للحرارة أو امتصاص للحرارة (التغير الحراري) خلال التفاعل الكيميائي .
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) + 393.5 kJ (تم تحرير أو إطلاق حرارة)
H2(g) + I2(g) → 2HI(g) – 393.5 kJ (تم امتصاص حرارة)
16 – من خلال المعادلة الكيميائية يمكن معرفة ما إذا كان التفاعل الكيميائي يسير باتجاه أمامي فقط أو باتجاه عكسي أيضا ، بمعني ما إذا كان تفاعل المواد الناتجة يتسبب في تكوين المواد الناتجة و في نفس الوقت تتفاعل المواد الناتجة مع بعضها البعض لتكوين المواد المتفاعلة ، وفي هذه الحالة يتم استبدال السهم ( → ) بسهمين متعاكسين ( ⇋).
H2(g) + Cl2(g) ⇋ 2HCl(g)
فالتفاعل السابق يشير إلى أن تفاعل غاز الهيدروجين H2 مع غاز الكلور Cl2 ينتج غاز كلوريد الهيدروجين HCl و الذي بدوره يمكن أن يتفكك في نفس الوقت و ينتج عن تفككه غاز الهيدروجين و غاز الكلور .

بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
2 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة