مقدمة في الكيمياء العضوية – الاساسيات من 6-1 إلى 6-6
(الكيمياء العامة المستوى الاول – الكلية الجامعية بالجموم)
للمزيد من المعلومات حول الكيمياء العضوية أرجو الضغط على الرابط الآتي :الترابط و التصاوغ Bonding and Isomerism
6 – 1 مقدمة في الكيمياء العضوية
1 – الكيمياء العضوية علم يختص بدراسة الخصائص الفريدة لذرة الكربون و مركباتها.
2 – تلعب المركبات العضوية دورا هاما في العديد من المجالات و العلوم الأخرى مثل الأحياء و البيئة و علوم الأرض، الفيزياء، الصناعة، الطب و بالطبع الكيمياء .
3 – أول من أشار إلى مفهوم الكيمياء العضوية الطبيب جونز جاكوب بيرزيليوس في العام 1807 عند دراسته للمركبات المشتقة من المصادر العضوية .
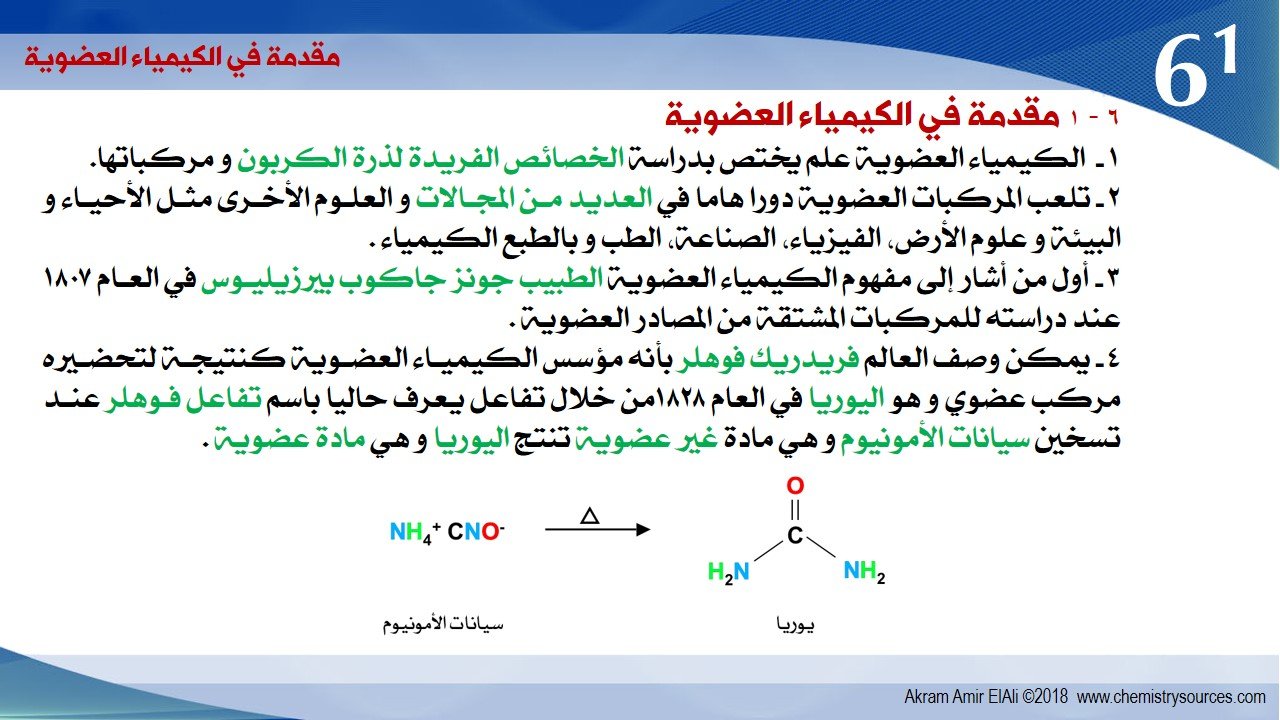
4 – يمكن وصف العالم فريدريك فوهلر بأنه مؤسس الكيمياء العضوية كنتيجة لتحضيره مركب عضوي و هو اليوريا في العام 1828من خلال تفاعل يعرف حاليا باسم تفاعل فوهلر عند تسخين سيانات الأمونيوم و هي مادة غير عضوية تنتج اليوريا و هي مادة عضوية.
6 – 2 الكيمياء العضوية مقارنة مع الكيمياء غير العضوية
1 – تعرف بأنها كيمياء مركبات الكربون حتى تلك المركبات ذات الأصل غير العضوي .
2 – هناك بعض مركبات الكربون لا يمكن اعتبارها عضوية مثل ثاني أكسيد الكربون و لكن مثل تلك المركبات تعتبر استثناء و ليس قاعدة يعتمد عليها.
3 – تركز الكيمياء العضوية على الكربون و على سير و انتقال الإلكترونات في سلاسل و حلقات الكربون و كذلك دراسة كيفية تشارك الإلكترونات بين ذرات الكربون فيما بينها و بين ذرات الكربون و الذرات غير الكربون الأخرى.
4 – تهتم الكيمياء العضوية كثيرا بخصائص الروابط التساهمية و كذلك العناصر اللافلزية، على الرغم من أن الأيونات و الفلزات تلعب دورا هاما في بعض التفاعلات العضوية .
5 – إن تطبيقات الكيمياء العضوية كثيرة و يصعب احصاؤها و تشمل جميع الصناعات مثل البلاستيك و الأصباغ و المنكهات و الأدوية و العطور و المنظفات و الوقود و المتفجرات و غيرها الكثير من المنتجات الأخرى .

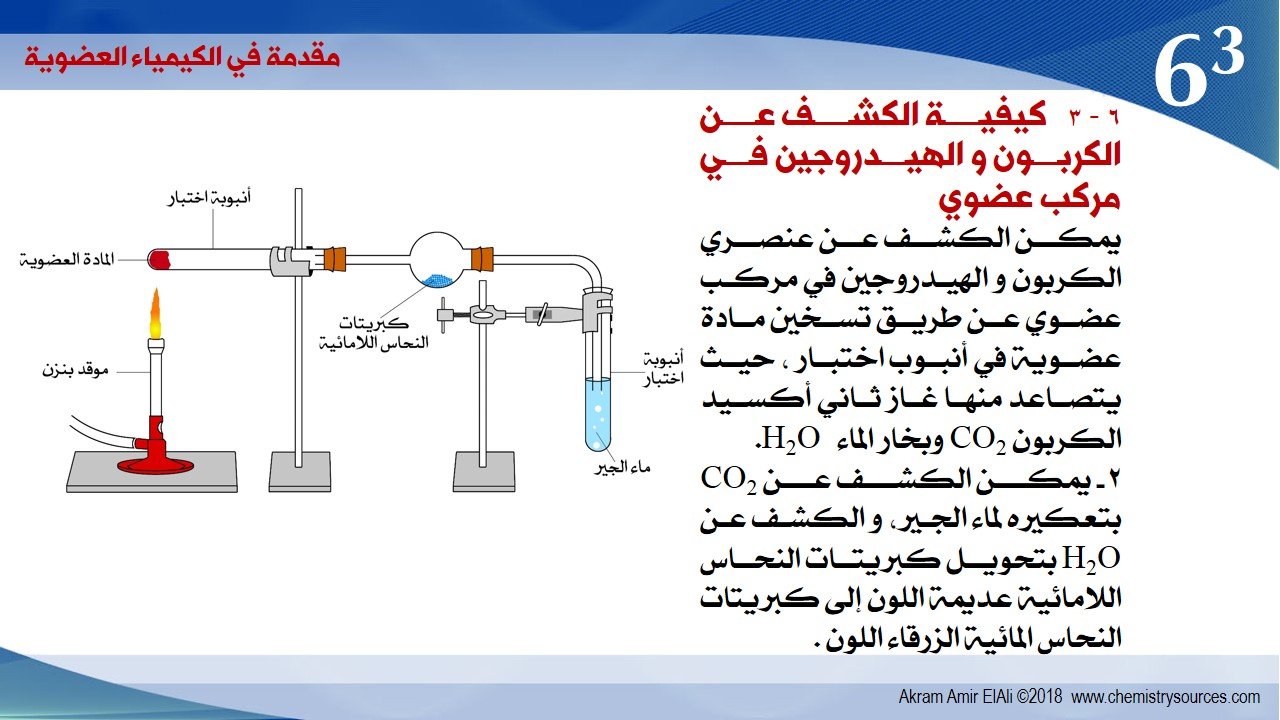
6 – 3 كيفية الكشف عن الكربون و الهيدروجين في مركب عضوي
يمكن الكشف عن عنصري الكربون و الهيدروجين في مركب عضوي عن طريق تسخين مادة عضوية في أنبوب اختبار ، حيث يتصاعد منها غاز ثاني أكسيد الكربون CO2 وبخار الماء H2O.
2 – يمكن الكشف عن CO2 بتعكيره لماء الجير، و الكشف عن H2O بتحويل كبريتات النحاس اللامائية عديمة اللون إلى كبريتات النحاس (II) المائي الزرقاء اللون .
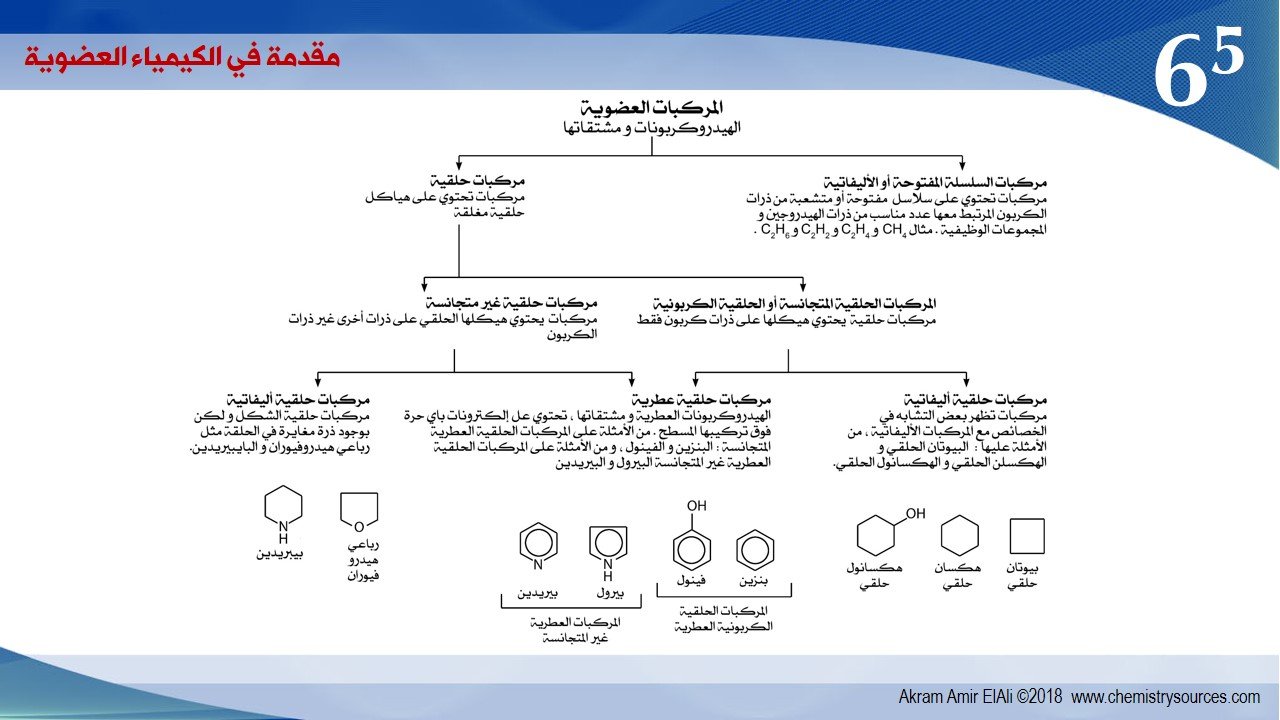
6 – 4 تصنيف المركبات العضوية
1 – التصنيف حسب نوع الروابط :
تقسم المركبات العضوية حسب نوع الروابط المشتركة (التساهمية ) إلى مركبات عضوية مشبعة حيث تكون جميع الروابط بين ذراتها أحادية ، و كذلك إلى غير المشبعة وهي المركبات التي تحتوي على روابط ثنائية أو ثلاثية بين بعض ذراتها .
2 – التصنيف حسب نوع العناصر الداخلة في المركب العضوي :
و يمكن تقسيم المركبات العضوية حسب نوع العناصر الداخلة في تركيبها إلى قسمين :
أ – الهيدروكربونات : و هي المركبات العضوية التي تحتوي على كربون و هيدروجين فقط.
ب – مشتقات الهيدروكربونات : و هي المركبات التي تحتوي على كربون و هيدروجين و عناصر أخرى مثل الأكسجين و النيتروجين و الهالوجينات.

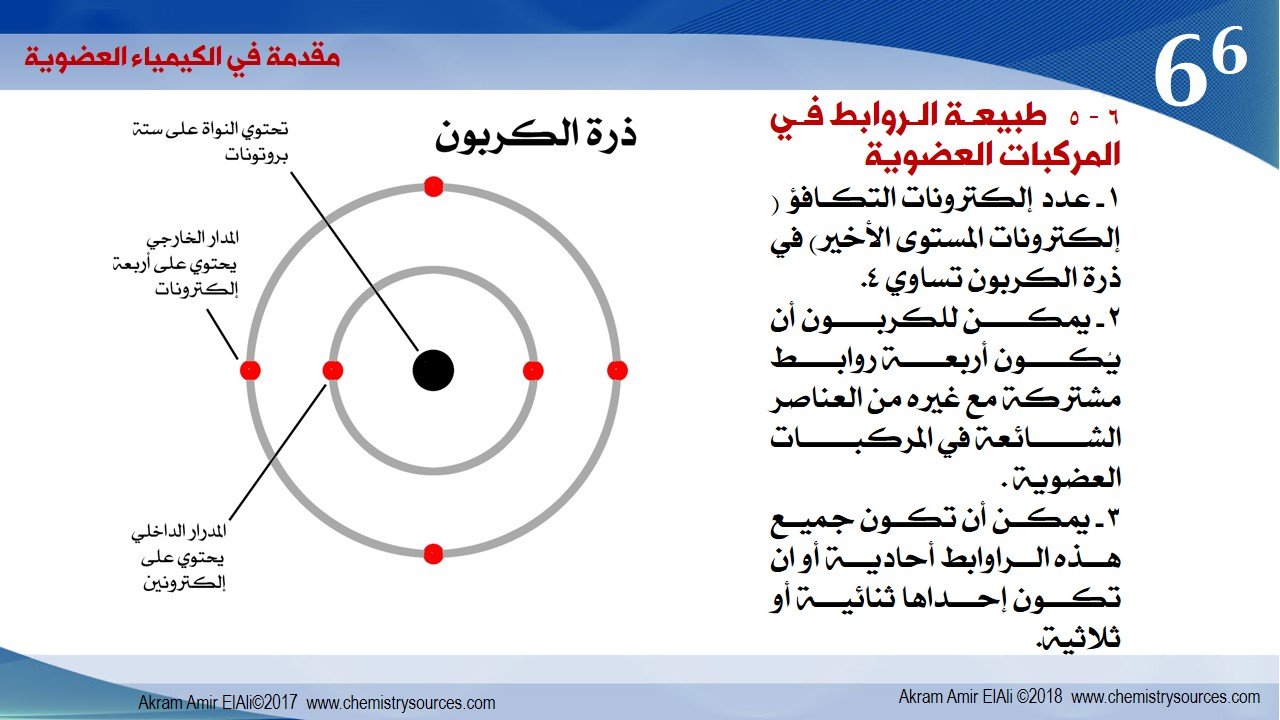
6 – 5 طبيعة الروابط في المركبات العضوية
1 – عدد إلكترونات التكافؤ ( إلكترونات المستوى الأخير) في ذرة الكربون تساوي 4.
2 – يمكن للكربون أن يُكون أربعة روابط مشتركة مع غيره من العناصر الشائعة في المركبات العضوية .
3 – يمكن أن تكون جميع هذه الراوابط أحادية أو ان تكون إحداها ثنائية أو ثلاثية.
4 – بسبب طبيعة الروابط في المركبات العضوية نجد بأن عدد المركبات العضوية بالملايين و ذلك يعود لسببين و هما :
أ – قدرة ذرة الكربون الفريدة على الارتباط بنفسها بروابط مشتركة أحادية و ثنائية و ثلاثية ، و كذلك الارتباط مع ذرات العناصر الأخرى كالأكسجين و النيتروجين .
ب – في الحالة العادية يكون عدد تكافؤ الكربون 2 و لكن عندما تثار ذرة الكربون فإنه يصبح رباعي التكافؤ و بالتالي فإن عدد الروابط التي يكونها الكربون 4 و هذا العدد من الروابط كبير نسبيا، مما يؤهل ذرة الكربون للارتباط بعدد كبير من الذرات و في أكثر من إتجاه.

انواع الروابط لذرة الكربون في المركبات العضوية :
أولا: رابطة تساهمية أحادية:
1 – في هذه الرابطة تساهم ذرة الكربون بإلكترون مع إلكترون الاخر من ذرة أخري ( ذرة كربون أو أي ذرة أخري ) .
2 – المثال على مركبات بها روابط أحادية : الميثان و الايثان ، حيث تتميز هذه المركبات بقلة نشاطها وانها غير متطايرة .
3 – في الميثان نلاحظ أن ذرة الكربون تكوِّن أربع روابط مشتركة من نوع سيجما σ مع أربع ذرات هيدروجين
4 – نوع التهجين الحاصل في ذرة الكربون في الميثان من نوع sp3 و بالتالي تنتج الرابطة C‒H من تداخل فلكs من ذرة الهيدروجين و أفلاك p من ذرة الكربون .
5 – في المركبات الأخرى ترتبط ذرات الكربون بعضها مع بعض بروابط مشتركة أحادية من نوع سيجما σ و يكون تهجين ذرات الكربون sp3 فمثلا في جزيء الإيثان C2H6 تنتج الرابطة بين ذرتي الكربون من تداخل فلكين مهجنين من نوع sp3 .


انواع الروابط لذرة الكربون في المركبات العضوية :
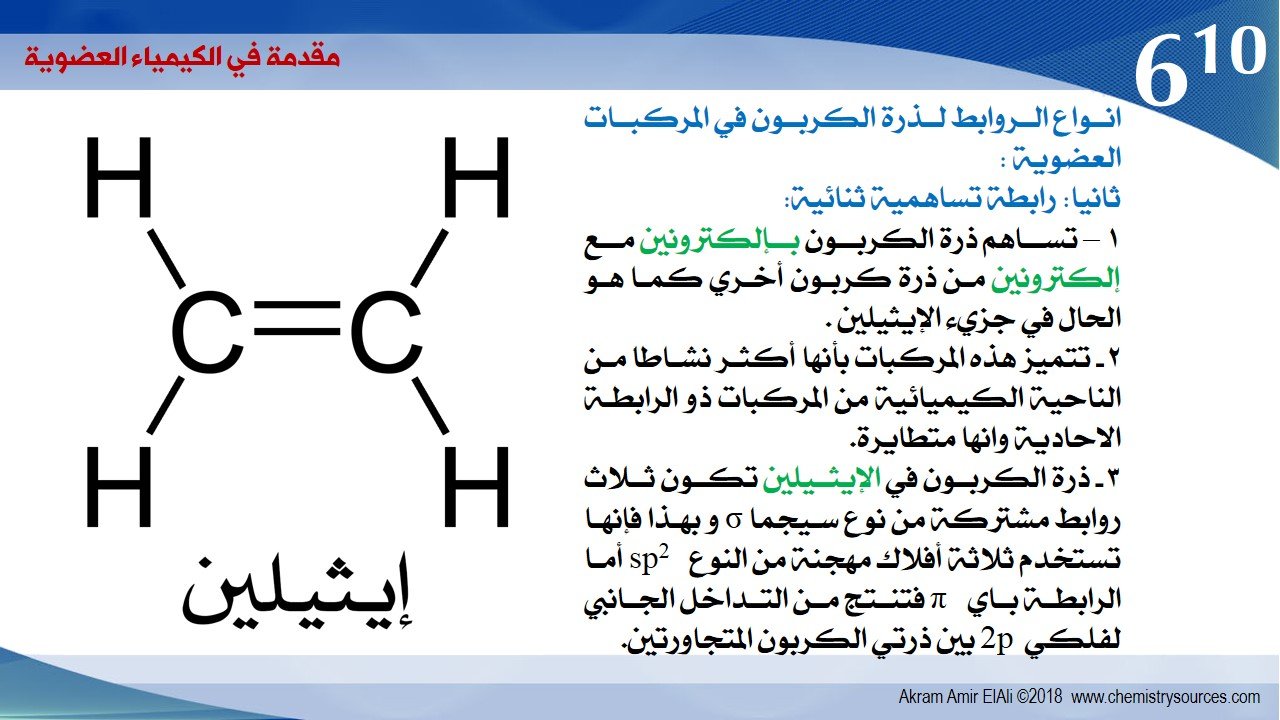
ثانيا: رابطة تساهمية ثنائية:
1 – تساهم ذرة الكربون بإلكترونين مع إلكترونين من ذرة كربون أخري كما هو الحال في جزيء الإيثيلين .
2 – تتميز هذه المركبات بأنها أكثر نشاطاً من الناحية الكيميائية من المركبات ذو الرابطة الاحادية وانها متطايرة.
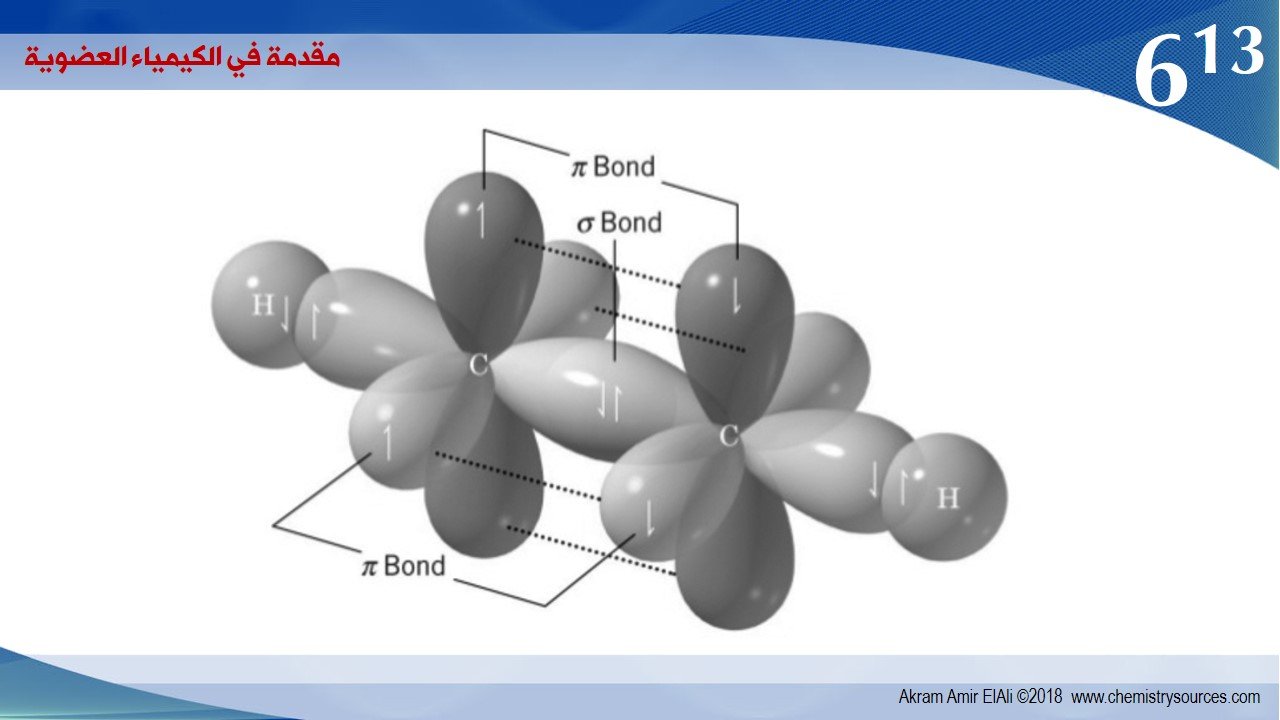
3 – ذرة الكربون في الإيثيلين تكون ثلاث روابط مشتركة من نوع سيجما σ و بهذا فإنها تستخدم ثلاثة أفلاك مهجنة من النوع sp2 أما الرابطة بايπ فتنتج من التداخل الجانبي لفلكي 2p بين ذرتي الكربون المتجاورتين.

انواع الروابط لذرة الكربون في المركبات العضوية :
ثالثا: رابطة تساهمية ثلاثية:
1 –تساهم ذرة الكربون بثلاثة إلكترونات مع ثلاثة إلكترونات أخرى من ذرة كربون اخري كما هو الحال في جزيء الأسيتيلين .
2 – تتميز المركبات ذو الرابطة الثلاثية بأنها أكثر نشاطاً وأكثر تطاير من المركبات ذو الرابطة.
3 – نلاحظ أن ذرتي الكربون في جزيء الأسيتيلين تكونان رابطتين من نوع سيجماσ و رابطتين من نوع باي π و يكون شكل الجزيء خطيا و بذلك فإن كل ذرة كربون قد استخدمت فلكين مهجنين من نوع sp بالاضافة إلى فلكي 2p .
و خلاصة القول أنه في حالة التهجين من نوع sp3 يكون لدينا فقط رابطة سيجما σ واحدة و لا وجود لرابطة باي ، و في التهجين من نوعsp2 يكون لدينا رابطة واحدة من نوع سيجما σ و رابطة واحدة من نوع باي π ، و في التهجين من نوع sp يكون لدينا رابطة من نوع سيجماσ و رابطتين من نوع باي π .

رابعا: رابطة تساهمية قطبية :
هذا النوع من ينشأ نتيجة رابطة تساهمية بين ذرة كربون ذرة أكسجين ونتيجة لأن الأكسجين أكثر في السالبية الكهربية لذلك تحدث ازاحة إلكترونات الرابطة ناحية الأكسجين وتظهر شحنة جزئية سالبة ‒ δ علي الأكسجين وشحنة جزئية موجبة + δ علي الكربون .

أنواع كسر الروابط في المركبات العضوية :
اثناء حدوث التفاعلات الكيميائية يحدث كسر الروابط الموجودة في المركب العضوي وهناك نوعان لكسر الروابط كالاتي :
1 – كسر متجانس: وفيه يحدث كسر الرابط إلى شقين متماثلين كل منهما عدد متساوي من إلكترونات التساهم مثال ذلك :

1 – كسر غير متجانس: وفيه يحدث اثناء التفاعل الكيميائي كسر الرابطة الي شقين غير متماثلين احدهما يحمل شحنة سالبة ويسمي كاربوأنيون والاخر يحمل شحنة موجبة ويسمي كاربونيوم.

6 – 6 الصيغ الجزيئية و الصيغ البنائية في المركبات العضوية
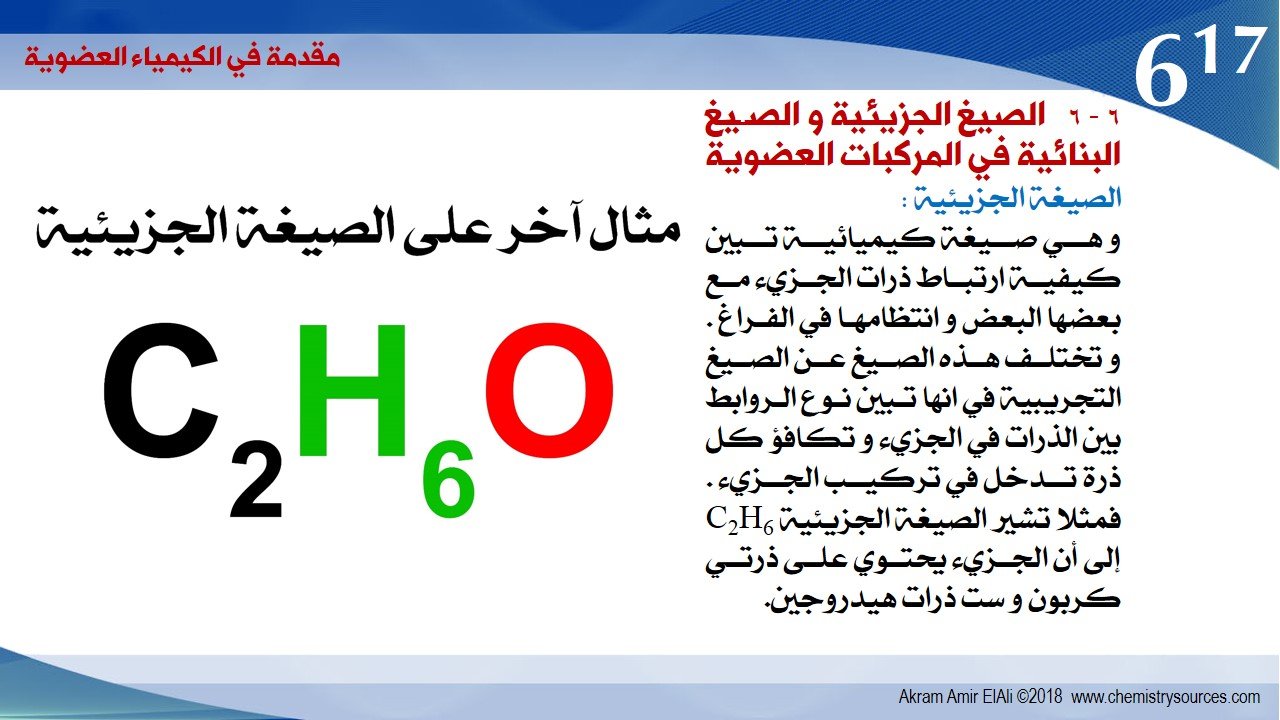
الصيغة الجزيئية :
و هي صيغة كيميائية تبين كيفية ارتباط ذرات الجزيء مع بعضها البعض و انتظامها في الفراغ . و تختلف هذه الصيغ عن الصيغ التجريبية في انها تبين نوع الروابط بين الذرات في الجزيء و تكافؤ كل ذرة تدخل في تركيب الجزيء . فمثلا تشير الصيغة الجزيئية C2H6 إلى أن الجزيء يحتوي على ذرتي كربون و ست ذرات هيدروجين.
الصيغة البنائية :
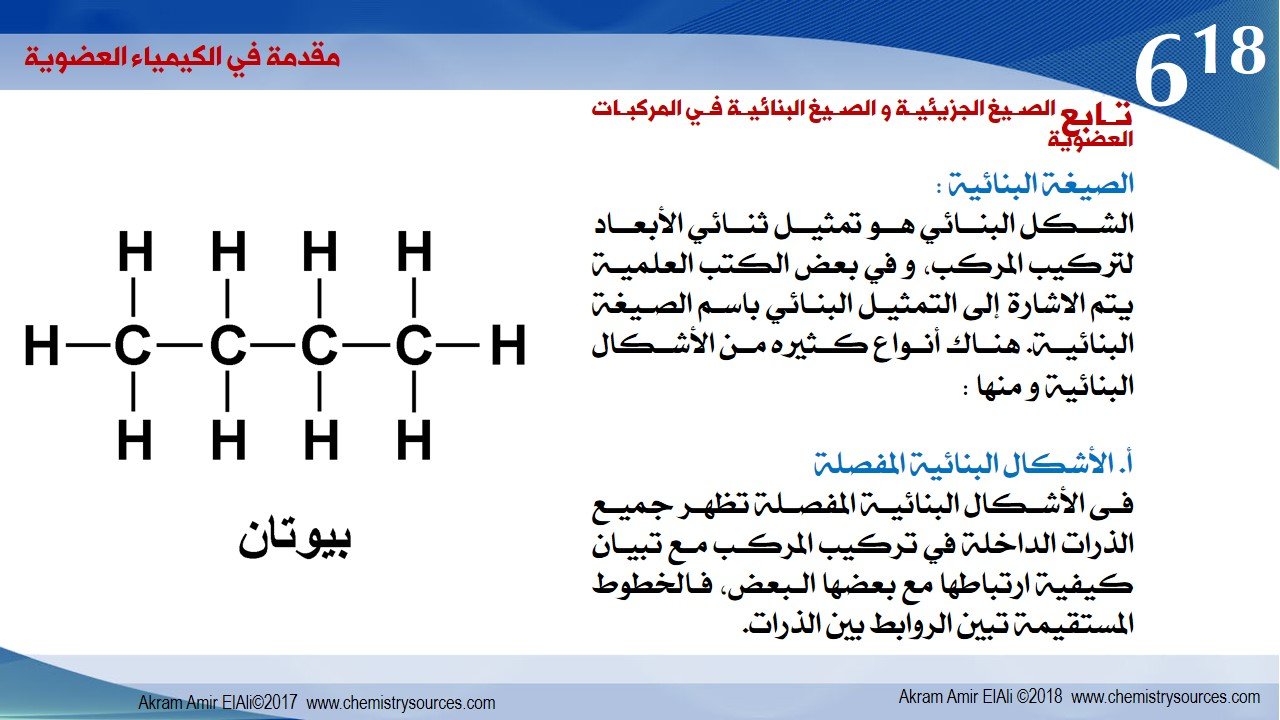
الشكل البنائي هو تمثيل ثنائي الأبعاد لتركيب المركب، و في بعض الكتب العلمية يتم الاشارة إلى التمثيل البنائي باسم الصيغة البنائية. هناك أنواع كثيره من الأشكال البنائية و منها :
أ. الأشكال البنائية المفصلة
فى الأشكال البنائية المفصلة تظهر جميع الذرات الداخلة في تركيب المركب مع تبيان كيفية ارتباطها مع بعضها البعض، فالخطوط المستقيمة تبين الروابط بين الذرات.
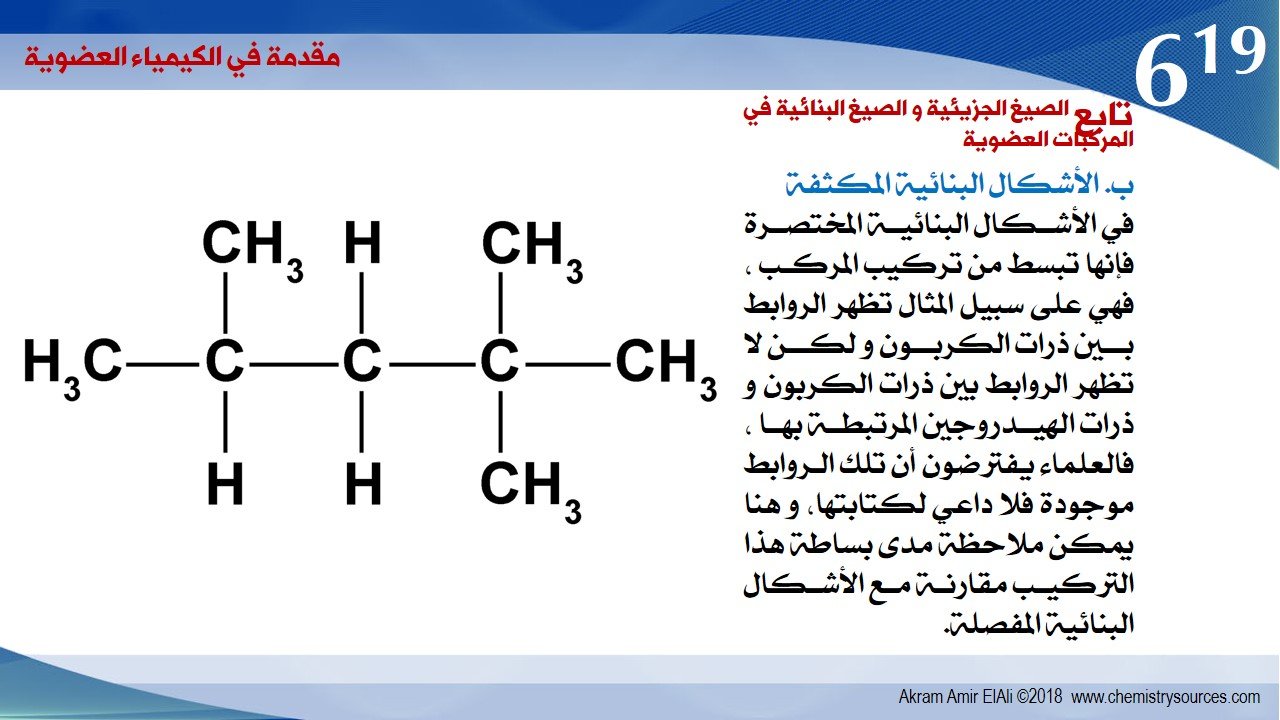
ب. الأشكال البنائية المكثفة
في الأشكال البنائية المختصرة فإنها تبسط من تركيب المركب ، فهي على سبيل المثال تظهر الروابط بين ذرات الكربون و لكن لا تظهر الروابط بين ذرات الكربون و ذرات الهيدروجين المرتبطة بها ، فالعلماء يفترضون أن تلك الروابط موجودة فلا داعي لكتابتها، و هنا يمكن ملاحظة مدى بساطة هذا التركيب مقارنة مع الأشكال البنائية المفصلة.
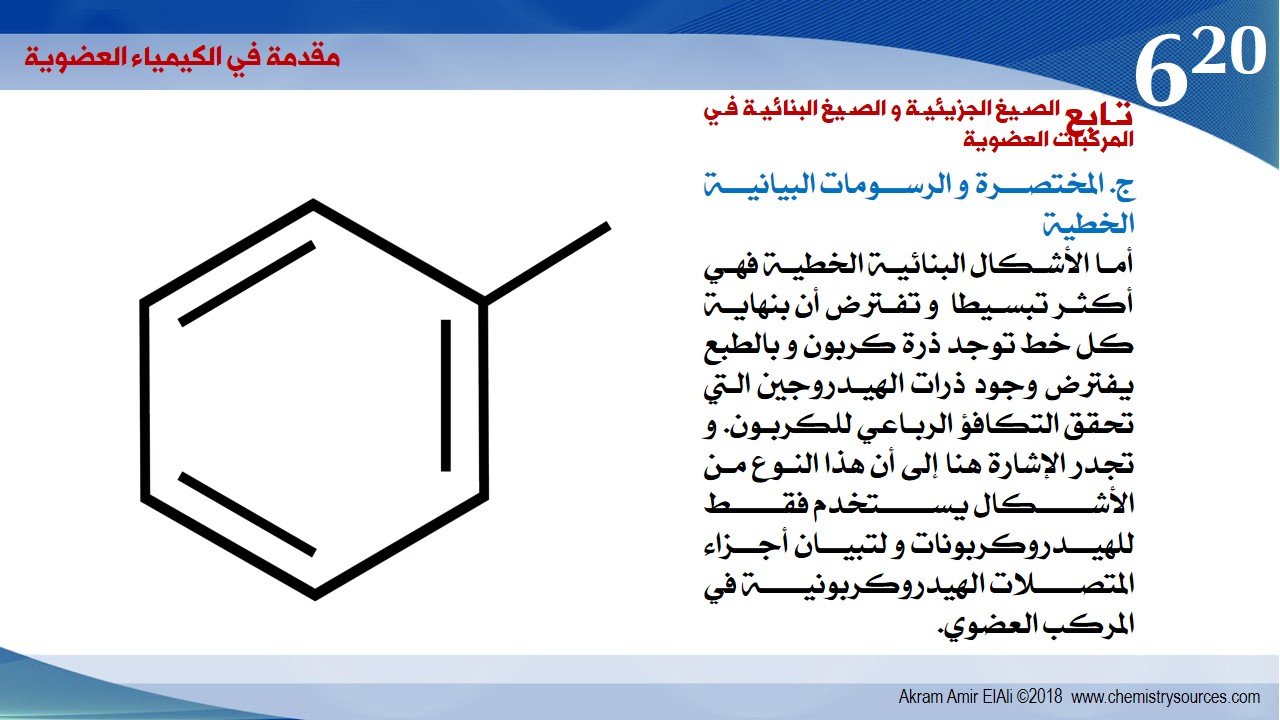
ج. المختصرة و الرسومات البيانية الخطية
أما الأشكال البنائية الخطية فهي أكثر تبسيطا و تفترض أن بنهاية كل خط توجد ذرة كربون و بالطبع يفترض وجود ذرات الهيدروجين التي تحقق التكافؤ الرباعي للكربون. و تجدر الإشارة هنا إلى أن هذا النوع من الأشكال يستخدم فقط للهيدروكربونات و لتبيان أجزاء المتصلات الهيدروكربونية في المركب العضوي.
د. أشكال ثلاثية الابعاد
و هي أشكال ثلاثية الأبعاد للجزيئات تبين الشكل الفراغي للذرات الداخلة في تركيب الجزيء. و عادة يتم استخدام برامج الحاسوب المتطورة مثل ChemDraw ، لرسم مثل تلك الأشكال الثلاثية الأبعاد.

بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
بعض التطبيقات الكيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
2 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
أناطالب أدرس في السنة الثانية ثانوي أريد طرح سؤال
وهو مامعنى المركبة الكيميائية للمركب العضوي ؟
ممكن توضح أكثر ؟
علاقة المركب العضوي بالمركبات التساهمية
للرد على استفسارك أرجو قراءة المقال الآتي
https://chemistrysources.com/2020/01/%d8%a7%d9%84%d8%aa%d8%b1%d8%a7%d8%a8%d8%b7-%d9%88-%d8%a7%d9%84%d8%aa%d8%b5%d8%a7%d9%88%d8%ba-bonding-and-isomerism/