كروماتوغرافيا السائل عالية الأداء – العملية الكروماتوغرافية
High Performance Liquid Chromatography – The Chromatographic Process
( Section 24.1, Quantitative Chemical Analysis by Daniel C. Harris, 8th Edition )
( التحليل الكيميائي النوعي – دانيال هاريس )
High Performance Liquid Chromatography (HPLC) is a form of column chromatography that pumps a sample mixture or analyte in a solvent (known as the mobile phase) at high pressure through a column with chromatographic packing material (stationary phase).
كروماتوغرافيا السائل عالية الأداء (HPLC) هي شكل من أشكال كروماتوغرافيا العمود و التي فيها يتم ضخ خليط عينة أو مادة مراد تحليلها في مذيب (يُعرف بالطور المتحرك) عند ضغط عالٍ من خلال عمود به مادة تعبئة كروماتوغرافية (الطور الثابت).
The sample is carried by a moving carrier gas stream of helium or nitrogen.
تُحمل العينة بواسطة تيار غاز ناقل متحرك من الهيليوم أو النيتروجين.
HPLC has the ability to separate, and identify compounds that are present in any sample that can be dissolved in a liquid in trace concentrations as low as parts per trillion.
لكروماتوغرافيا السائل عالية الأداء (HPLC) القدرة على فصل وتحديد المركبات الموجودة في أي عينة والتي يمكن إذابتها في سائل بتركيزات ضئيلة تصل إلى أجزاء لكل تريليون.
Because of this versatility, HPLC is used in a variety of industrial and scientific applications, such as pharmaceutical, environmental, forensics, and chemicals.
بسبب هذا التنوع ، يتم استخدام HPLC في مجموعة متنوعة من التطبيقات الصناعية والعلمية ، مثل الأدوية والبيئية والطب الشرعي والمواد الكيميائية.
Increasing the rate at which solute equilibrates between stationary and mobile phases increases the efficiency of chromatography. For gas chromatography with an open tubular column, rapid equilibration is accomplished by reducing the diameter of the column so that molecules can diffuse quickly between the channel and the stationary phase on the wall. Diffusion in liquids is 100 times slower than diffusion in gases. Therefore, in liquid chromatography, it is not generally feasible to use open tubular columns, because the diameter of the solvent channel is too great to be traversed by a solute molecule in a short time. Liquid chromatography is conducted with packed columns so that a solute molecule does not have to diffuse very far to encounter the stationary phase.
تؤدي زيادة معدل عملية اتزان المادة المذابة بين الطورين الثابت والمتحرك إلى زيادة كفاءة الكروماتوغرافيا. بالنسبة لكروماتوغرافيا الغاز بعمود اسطواني مجوف ، يتم تحقيق اتزان سريع عن طريق تقليل قطر العمود بحيث يمكن للجزيئات أن تنتشر بسرعة بين القناة و الطور الثابت على جدران الأنبوب. أما الانتشار في السوائل فهو أبطأ 100 مرة من الانتشار في الغازات. لذلك ، في كروماتوغرافيا السائل ، ليس من المجدي عمومًا استخدام أعمدة أسطوانية مجوفة، لأن قطر قناة المذيب أكبر من أن يجتازها جزيء مذاب في وقت قصير. و يتم إجراء كروماتوغرافيا السائل باستخدام أعمدة معبأة بحيث لا يضطر جزيء المذاب إلى الانتشار بعيدًا جدًا لمواجهة الطور الثابت.
الجسيمات الصغيرة تعطي كفاءة عالية ولكنها تتطلب ضغطًا عاليًا
Small Particles Give High Efficiency but Require High Pressure
The efficiency of a packed column increases as the size of the stationary phase particles decreases. Typical particle sizes in HPLC are 1.7 to 5 μm.
تزداد كفاءة العمود المعبأ مع انخفاض حجم جسيمات الطور الثابت و عادة ما تتراوح تتراوح أحجام الجسيمات النموذجية في HPLC من 1.7 إلى 5 ميكرومتر.
Decreasing particle size permits us to improve resolution or to maintain the same resolution while decreasing run time.
يسمح لنا تقليل حجم الجسيمات بتحسين الدقة أو الحفاظ على نفس الدقة مع تقليل وقت التشغيل.
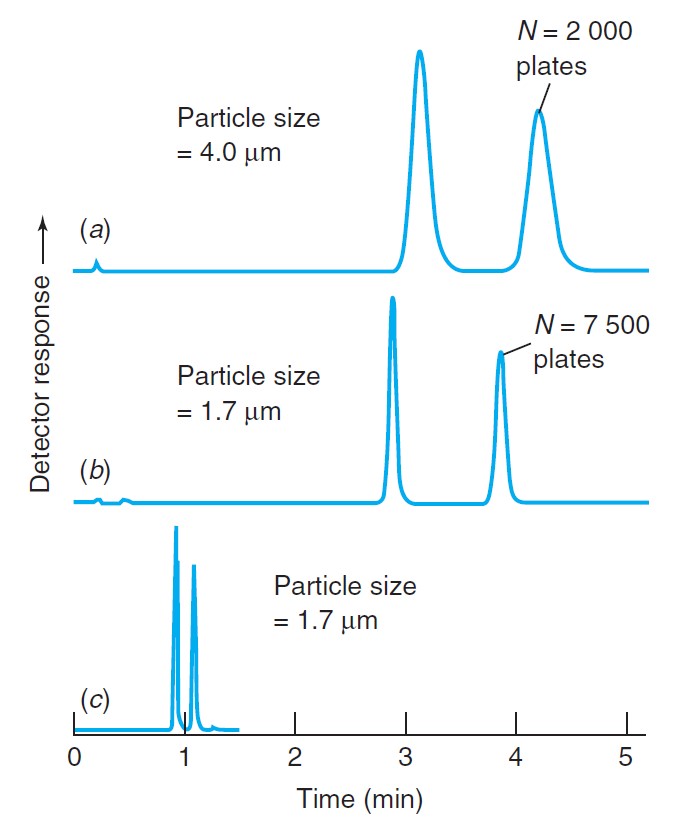
In the above figure (a and b) Chromatograms of the same sample run at the same linear velocity on 5.0-cm-long columns packed with C18-silica. (c) A stronger solvent was used to elute solutes more rapidly from the column in panel b.
في الشكل أعلاه فإن الكروماتوغرام (الرسم البياني للكروماتوغرافيا) a و b لنفس العينة تم تشغيلها بنفس الرسرعة التشغيلية في عمود طوله 5 سم مملوءه بالسيليكا C18 . في الشكل c تم استخدام مذيب قوي لتحريك المذاب بصورة أسرع من العمود مقارنة بالشكل b .
van Deemter plots of plate height versus linear flow rate shows that small particles reduce plate height and that plate height is not very sensitive to increased flow rate when the particles are small. At the optimum flow rate for each column, the number of theoretical plates in a column of length L (cm) is approximately:
ويظهر مخطط فان ديمتر لارتفاعل الشريحة (الطبقة) في مقابل معدل الجريان الخطي أن الجسيمات الصغيرة تقلل من ارتفاع الشريحة (الطبقة) وهذا الارتفاع ليس حساسًا جدًا لزيادة معدل التدفق عندما تكون الجزيئات صغيرة. فعند معدل التدفق الأمثل لكل عمود ، يكون عدد الشرائح (الطبقات) النظرية في عمود بطول L (سم) تقريبًا:
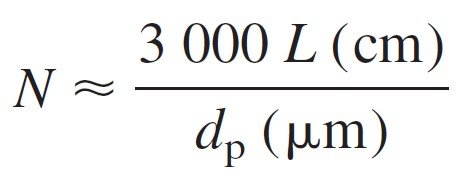
where dp is the particle diameter in μm. The 5.0-cm-long column with
4.0-μm-diameter particles is predicted to provide:
حيث dp قطر الجسيم بالميكرومتر. فمثلا عمود طوله 5 سم و بقطر 4 ميكرومتر يمكن أن يوفر عدد شرائح أو طبقات مساوٍ لـ :
N = (3000)(5.0)/4.0 = 3800 plates
One reason why small particles give better resolution is that they provide more uniform flow through the column. A second reason is that the distance through which solute must diffuse in the mobile and stationary phases is on the order of the particle size, the smaller the particles, the less distance solute must diffuse. Optimum flow rate for small particles is faster than for large particles because solutes diffuse through smaller distances.
أحد الأسباب التي تجعل الجسيمات الصغيرة تعطي دقة أفضل هو أنها توفر تدفقًا أكثر انتظامًا عبر العمود. والسبب الثاني هو أن المسافة التي يجب أن ينتشر من خلالها المذاب في الطورين الثابت و المتحرك هي حسب ترتيب حجم الجسيم ، فكلما كانت الجسيمات أصغر، فإن المسافة التي يقطعها المذاب تكون أقل. و عادة ما يكون معدل التدفق الأمثل للجسيمات الصغيرة أسرع منه للجزيئات الكبيرة لأن المواد الذائبة تنتشر عبر مسافات أصغر.
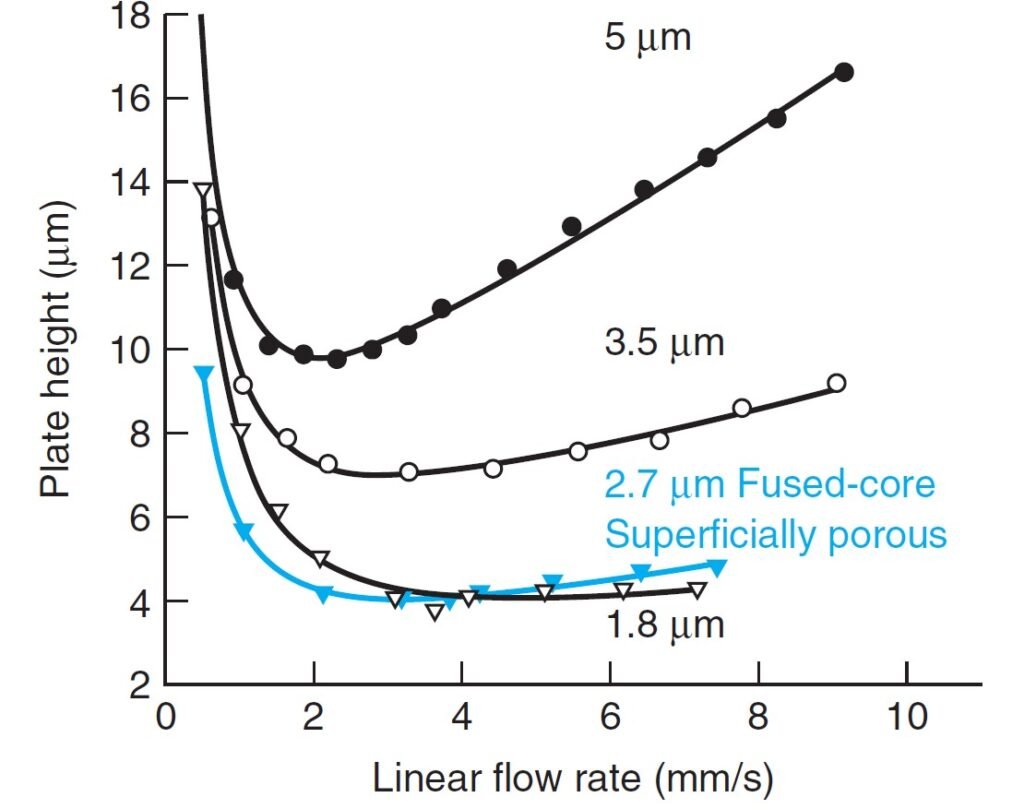
Above figure shows Van Deemter curves: Plate height as a function of linear flow rate (mm/s) for microporous stationary phase particle diameters of 5.0, 3.5, and 1.8 μm, as well as superficially porous particles with a diameter of 2.7 μm (0.5 μm porous layer thickness). Measurements for naphthalene eluted from C18-silica (50 mm long × 4.6 mm diameter) with 60 vol% acetonitrile/40 vol% H2O at 24°C.
يظهر الشكل أعلاه منحنيات فان ديمتر: ارتفاع الشريحة (الطبقة) كدالة لمعدل التدفق الخطي (مم/ثانية) لأقطار جسيمات الطور الثابت الصغيرة التي يسهل اختراقها والتي تبلغ 5.0 و 3.5 و 1.8 ميكرومتر، بالإضافة إلى الجسيمات المسامية السطحية التي يبلغ قطرها 2.7 ميكرومتر (0.5 ميكرون طبقة مسامية سماكة). قياسات النفثالين المزال من السيليكا C-18 (50 مم طول × 4.6 مم) مع 60 % حجما من الأسيتونيتريل و 40% حجما من الماء عند 24 درجة سيليزية.
An added benefit of small particle size, coupled with a narrow column and higher flow is that analyte is not diluted so much as it travels through the column.
من المزايا الإضافية لحجم الجسيمات الصغير، إلى جانب العمود الضيق و التدفق العالي، هو أن المادة المراد تحليلها لا يتم تخفيفها كثيرا أثناء انتقالها عبر العمود.
The penalty for small particle size is resistance to solvent flow. The pressure required to drive solvent through a column is
و لكن تكمن مشكلة حجم الجسيمات الصغيرة هي مقاومتها لتدفق المذيبات. و هنا يمكن حساب الضغط المطلوب لدفع المذيب خلال العمود و الذي يساوي:

where ux is linear flow rate, η is the viscosity of the solvent, L is the length of the column, r is column radius, and dp is the particle diameter. The factor f depends on particle shape and particle packing.
حيث ux هو معدل التدفق الخطي ، و η لزوجة المذيب ، و L طول العمود ، و r نصف قطر العمود ، و dp هو قطر الجسيم. كما يعتمد العامل f على شكل الجسيمات وتعبئة الجسيمات.
The physical significance of above Equation is that the pressure in HPLC is proportional to flow rate and column length and inversely proportional to the square of column radius (or diameter) and the square of particle size.
tالأهمية المادية للمعادلة أعلاه تكمن في أن الضغط في HPLC يتناسب طرديا مع معدل التدفق وطول العمود ويتناسب عكسياً مع مربع نصف قطر العمود (أو القطر) ومربع حجم الجسيمات.
Another penalty of small particle size is increased frictional heating as solvent is forced through the particle bed.
و هناك مشكلة أخرى سببها حجم الجسيمات الصغير و هي زيادة التسخين الاحتكاكي حيث يتم دفع المذيب من خلال طبقة الجسيمات .
The Column العمود
Columns are expensive and easily degraded by dust or particles in the sample or solvent and by irreversible adsorption of impurities from the sample or solvent. To avoid introducing particulate matter into the column, samples should be centrifuged and/or filtered through a 0.5-μm filter before they are loaded into vials for an autosampler or taken into a syringe for manual injection. An in-line 0.5-μm filter should be installed immediately downsteam of the autosampler.
إن الاعمدة المستخدمة في كروماتوغرافيا السائل عالية الأداء باهظة الثمن ويمكن أن تتحلل بسهولة بسبب الغبار أو الجزيئات الموجودة في العينة أو المذيب و كذلك بسبب الامتزاز غير اللاعكوس للشوائب من العينة أو المذيب. لتجنب إدخال الشوائب في العمود ، يجب فصل العينات بجهاز الطرد المركزي و / أو ترشيحها من خلال مرشح 0.5 ميكرومتر قبل تحميلها في قوارير لجهاز أخذ العينات الأوتوماتيكي أو أخذها في حقنة للحقن اليدوي. كما يجب تركيب مرشح خطي 0.5 ميكرومتر على الفور قبل جهاز أخذ العينات الأوتوماتيكي.
Also the entrance to the main column must be protected by a short guard column containing the same stationary phase as the main column.
كما يجب حماية مدخل العمود الرئيس بعمود حماية قصير يحتوي على نفس الطور الثابت المستخدم في العمود الرئيس.
Fine particles and strongly adsorbed solutes are retained in the guard column, which is periodically replaced when column pressure increases or after a set number of injections or time in service. While guard columns make sense with 10- to 30-cm-long chromatography columns, many people do not consider a guard column to be cost effective for a 5-cm column.
يتم احتجاز الجسيمات الدقيقة و المواد الذائية شديدة الامتزاز في عمود الحماية ، والذي يتم استبداله بشكل دوري عند زيادة ضغط العمود أو بعد عدد محدد من الحقن أو وقت الصيانة. و في حين أن أعمدة الحماية مقارنة مع أعمدة كروماتوغرافيا و التي بطول 10 إلى 30 سم قصيرة للغاية حيث يبلغ طولها 5 سم إلا أن هناك من يشكك في جودتها و في فعاليتها في الحماية ناهيك عن سعرها الغالي الثمن .
Heating a chromatography column usually decreases the viscosity of the solvent, thereby reducing the required pressure or permitting faster flow. Increased temperature decreases retention times and improves resolution by hastening diffusion of solutes. However, increased temperature can degrade the stationary phase and decrease column lifetime. When column temperature is not controlled, it fluctuates with the ambient temperature. Using a column heater set 10°C above room temperature improves the reproducibility of retention times and the precision of quantitative analysis. Some chromatographers routinely conduct all separations at 50° or 60°C. For a heated column, the mobile phase should be passed through a preheating metal coil between the injector and the column so that the solvent and column are at the same temperature. If their temperatures are different, peaks become distorted and retention times change.
عادةً ما يؤدي تسخين عمود الكروماتوغرافيا إلى تقليل لزوجة المذيب ، وبالتالي تقليل الضغط المطلوب أو السماح بتدفق أسرع. كما تقلل درجة الحرارة المتزايدة أوقات الاستبقاء وتحسن الدقة عن طريق تسريع انتشار المواد المذابة. ومع ذلك ، يمكن أن تؤدي زيادة درجة الحرارة إلى تدهور الطور الثابت وتقليل عمر العمود. و عندما لا يتم التحكم في درجة حرارة العمود ، فإنها تتأثر مع درجة الحرارة المحيطة. و يؤدي استخدام مجموعة سخان عمود 10 درجات سيليزية فوق درجة حرارة الغرفة إلى تحسين إمكانية تكرار أوقات الاستبقاء ودقة التحليل الكمي. و يقوم بعض الكروماتوجرافيين بإجراء جميع عمليات الفصل بشكل روتيني عند درجة حرارة تتراوح ما بين 50 درجة أو 60 درجة سيليزية. و بالنسبة للعمود المسخن ، يجب تمرير الطور المتحرك من خلال ملف معدني مسخن مسبقًا بين الحاقن والعمود بحيث يكون المذيب والعمود بنفس درجة الحرارة، فإذا كانت درجات الحرارة مختلفة ، فإن القمم تتشوه وتتغير أوقات الاستبقاء بها.
The narrow column is more compatible with mass spectrometry, which requires low solvent flow. The narrow column requires less sample and produces less waste. Instruments that used the 4.6-mm column also operate with the 2.1-mm column. Columns narrower than 2.1 mm require specially designed instruments to reduce band broadening outside the column. Capillary columns as narrow as 25 μm can be used.
إن العمود الضيق أكثر توافقًا مع مقياس طيف الكتلة ، والذي يتطلب تدفقًا منخفضًا للمذيبات. كما يتطلب العمود الضيق عينة أقل وينتج نفايات أقل. فالأدوات التي تستخدم العمود 4.6 ملم تعمل أيضًا مع العمود 2.1 ملم. و تتطلب الأعمدة الأضيق من 2.1 مم أدوات مصممة خصيصًا لتقليل اتساع النطاق خارج العمود، كما يمكن استخدام أعمدة شعيرية ضيقة تصل إلى 25 ميكرومتر.
The Stationary Phase الطور الثابت
The most common support is highly pure, spherical, microporous particles of silica that are permeable to solvent and have a surface area of several hundred square meters per gram. Most silica cannot be used above pH 8, because it dissolves in base.
إن المادة الداعمة و المستخدمة في عمود الكروماتوغرافيا و الأكثر شيوعًا هي جزيئات السيليكا الكروبة شديدة النقاء و الدقيقة جدا و التي يسهل نفاذها إلى المذيبات ، وتبلغ مساحة سطحها عدة مئات من الأمتار المربعة لكل جرام. و تجد الإشارة هنا إلى أنه لا يمكن استخدام معظم السيليكا عند درجة الرقم الهيدروجيني الأعلى من 8 ، لأنها تذوب في القاعدة.
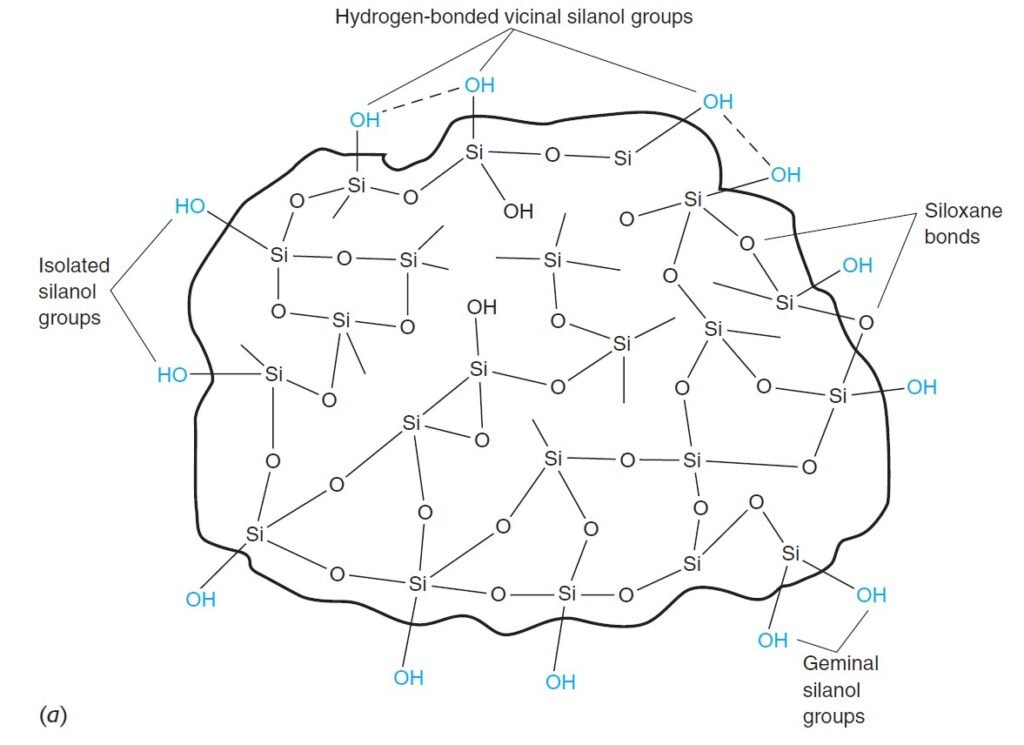
Bare silica can be used as the stationary phase for adsorption chromatography. Most commonly, liquid-liquid partition chromatography is conducted with a bonded stationary phase covalently attached to the silica surface by reactions such as
يمكن استخدام السيليكا الحرة -غير المرتبطة- ( سيليكا لا تكون مرتبطة تساهميًا بالجسيمات الداعمة في العمود من الداخل) كطور ثابت لكروماتوغرافيا الامتزاز. و عادة ما يتم إجراء كروماتوجرافيا السائل-السائل مع طور ثابت يكون مرتبطا تساهميًا بسطح السيليكا من خلال تفاعلات مثل:
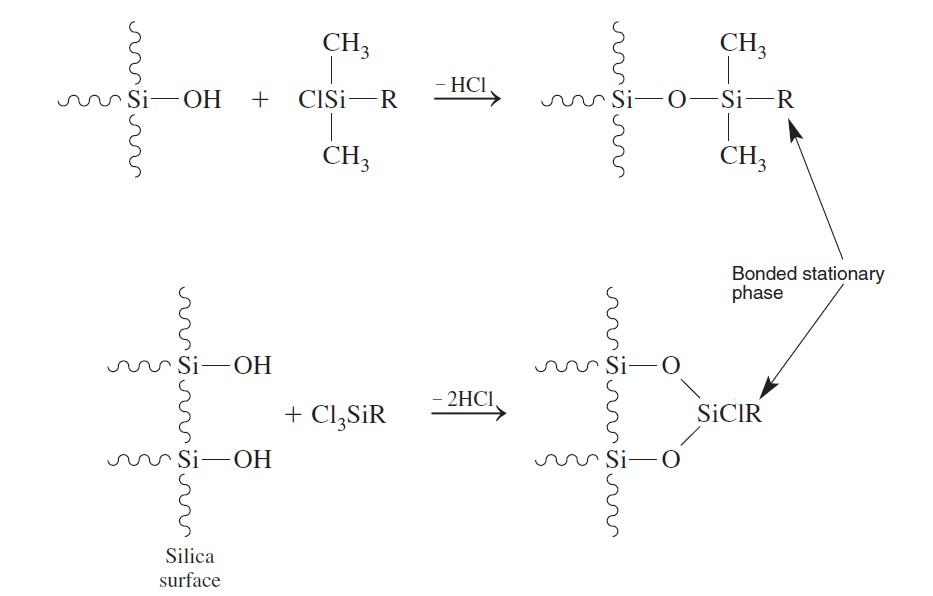
The octadecyl (C18) stationary phase (R=(CH2)17CH3, often abbreviated ODS) is by far the most common in HPLC.
يُعد الطور الثابت أوكتاديسيل (C18) [(R=(CH2)17CH3 و غالبا ما يتم الإشارة إليه اختصارا بـ ODS] هو الطور الثابت الأكثر شيوعًا في HPLC.
The siloxane (SiOOOSiR) bond hydrolyzes below pH 2, so HPLC with a bonded phase on a silica support is generally limited to the pH range 2–8.
و تعمل السيلوكسان (SiOOOSiR) على ربط الجسيمات المتأينة عند درجة حموضة أقل من 2 ، و عليه فإن HPLC ذات الطور المرتبط على داعمة من السيليكا يكون مجالها محدد بين درجة pH تتراوح ما بين 2-8.
If bulky isobutyl groups are attached to the silicon atom of the bonded phase, the stationary phase is protected from attack by H3O+ and is stable for long periods at low pH, even at elevated temperature.
و إذا ما تم ارتباط مجموعات الأيسوبيوتيل الضخمة مع ذرة السيليكون في الطور المرتبط، فغن الطور الثابت سوف يُحمى من الهجوم بواسطة +H3O و بالتالي يصبح مستقرا لمدة أكبر عند درحات الـ pH القليلة.
Another type of nonpolar stationary phase has a polar embedded group. The example consists of a long hydrocarbon chain with a polar amide group near its base. Embedded polar groups provide alternate selectivities from C18 stationary phases, improved peak shapes for bases, and compatibility with 100% aqueous phase.
Other nonpolar stationary phases should not be exposed to 100% aqueous phase because they become very difficult to re-equilibrate with organic phase.
نوع آخر من الطور الثابت غير القطبي له مجموعة قطبية ضمنية.و المثال على ذلك سلسلة هيدروكربونية طويلة مع مجموعة أميد قطبية بالقرب من قاعدتها. توفر المجموعات القطبية الضمنية انتقائية بديلة من الأطوار الثابتة C18، و تحسن القمم الناتجة عن القواعد و تتوافق مع الطور المائي بنسبة 100 ٪.
فلا ينبغي تعريض الأطوار الثابتة غير القطبية الأخرى إلى طور مائي 100٪ لأنه يصبح من الصعب جدًا إعادة معايرتها مع الطور العضوي.
Superficially porous particles are especially suitable for separation of macromolecules such as proteins, which diffuse more slowly than small molecules.
الجسيمات المسامية السطحية مناسبة بشكل خاص لفصل الجزيئات الكبيرة مثل البروتينات و التي تنتشر بشكل أبطأ من الجزيئات الصغيرة.
The superficially porous particles (also called fused-core particles), consist of a 0.25-μm-thick porous silica layer on a 5-μm diameter nonporous silica core. A stationary phase such as C18 is bonded throughout the thin, porous outer layer. Mass transfer of solute into a 0.25-μm-thick layer is 10 times faster than mass transfer into fully porous particles with a radius of 2.5 μm, thus enabling high efficiency at high flow rate.
الجسيمات المسامية السطحية (وتسمى أيضًا جسيمات النواة المنصهرة) ، تتكون من طبقة سيليكا مسامية بسمك 0.25 ميكرومتر تُحيط “قلب” سيليكا غير مسامي بحيث يصبح القطر الاجمالي لها 5 ميكرومتر. و يتم ربط الطور الثابت مثل C18 في جميع أنحاء الطبقة الخارجية الرقيقة المسامية. فنقل كتلة المذاب إلى طبقة بسمك 0.25 ميكرومتر أسرع 10 مرات من نقل الكتلة إلى جزيئات مسامية بالكامل بنصف قطر 2.5 ميكرومتر ، مما يتيح كفاءة عالية بمعدل تدفق مرتفع.
Porous graphitic carbon deposited on silica is a stationary phase that exhibits increased retention of nonpolar compounds relative to retention by C18. Graphite has high affinity for polar compounds and separates isomers that cannot be separated on C18.
ويُعد كربون الجرافيت المسامي المترسب على السيليكا هو طور ثابت يُظهر استبقاءٍ عاليا للمركبات غير القطبية مقارنة مع الاستبقاء الذي يوفره C18. فالجرافيت يظهر ميلا للمركبات القطبية و يعمل على فصل المتصاوغات (الأيزوميرات) التي لا يمكن فصلها من خلال C18.
The Elution Process عملية الشطف
In adsorption chromatography, solvent molecules compete with solute molecules for sites on the stationary phase.
في كروماتوغرافيا الامتزاز ، تتنافس جزيئات المذيب مع جزيئات المذاب للمواقع الموجودة في الطور الثابت.
Elution occurs when solvent displaces solute from the stationary phase.
و تحدث عملية الشطف عندما يزيح المذيبُ المذابَ من الطور الثابت.
An eluotropic series ranks solvents by their relative abilities to displace solutes from a given adsorbent. The eluent strength, ε°, is a measure of the solvent adsorption energy, with the value for pentane defined as 0 for adsorption on bare silica. The more polar the solvent, the greater is its eluent strength for adsorption chromatography with bare silica. The greater the eluent strength, the more rapidly will solutes be eluted from the column.
تصنف سلسلة فصل المذيبات من خلال قدرتها النسبية على إزاحة المواد الذائبة من مادة ماصة معينة. و تعرف قوة الشطف °ε، بأنها مقياس لطاقة امتصاص المذيبات ، مقارن مع قيمة قدرة البنتان و التي تساوي 0 للإمتزاز على السيليكا الحرة -غير المرتبطة-. فكلما زادت قطبية المذيب، زادت قوته في الشطف في كروماتوغرافيا الامتزاز بالسيليكا الحرة -غير المرتبطة-. و كلما زادت قوة الشطف، زادت سرعة إزالة المواد الذائبة من العمود.
Adsorption chromatography on bare silica is an example of normal-phase chromatography, in which we use a polar stationary phase and a less polar solvent.
كروماتوغرافيا الامتزاز على السيليكا الحرة-غير المرتبطة- هي مثال على كروماتوغرافيا الطور الطبيعي ، حيث نستخدم طورًا ثابتًا قطبيًا ومذيبًا أقل قطبية.
A more polar solvent has a higher eluent strength.
فالمذيب الأكثر قطبية يكون لديه قوة شطف أعلى.
Reversed-phase chromatography is the more common scheme in which the stationary phase is nonpolar or weakly polar and the solvent is more polar.
كروماتوغرافيا الطور المعكوس هو الأكثر شيوعًا حيث يكون الطور الثابت غير قطبي أو ضعيف القطبية ويكون المذيب أكثر قطبية.
A less polar solvent has a higher eluent strength.
و في هذا النوع من الكروماتوغرافيا يمككنا القول بأن المذيب الأقل قطبية يكون لديه قوة شطف أعلى.
In general, eluent strength is increased by making the mobile phase more like the stationary phase.
بشكل عام ، تزداد قوة الشطف بجعل الطور المتحرك أشبه بالطور الثابت.
Reversed-phase chromatography eliminates peak tailing because the stationary phase has few sites that can strongly adsorb a solute to cause tailing.
كما يلغي كروماتوغرافيا الطور المعكوس “تذييل” القمة لأن الطور الثابت يحتوي على عدد قليل من المواقع التي يمكن أن تمتص المادة المذابة بقوة لتسبب التذييل.
Normal-phase chromatography is sensitive to small amounts of water in the eluent, but reversed–phase chromatography is not.
و أيضا كروماتوغرافيا الطور الطبيعي حساس لكميات صغيرة من الماء الموجودة في المواد المراد شطفها، لكن كروماتوغرافيا الطور العكسي ليست كذلك.
Isocratic and Gradient Elution الشطف المتساوي و المتدرج
Isocratic elution is performed with a single solvent (or constant solvent mixture). If one solvent does not provide sufficiently rapid elution of all components, then gradient elution can be used. In this case, increasing amounts of solvent B are added to solvent A to create a continuous gradient.
يتم إجراء الشطف المتساوي عن طريق مذيب واحد (أو خليط مذيب لا يتغير). إذا لم يوفر أحد المذيبات عملية شطف سريعة بما فيه الكفاية لجميع المكونات ، فيمكن استخدام الفصل المتدرج. في هذه الحالة ، يتم إضافة كميات متزايدة من المذيب B إلى المذيب A لإنشاء تدرج مستمر.
In a reversed-phase separation, eluent strength decreases as the solvent becomes more polar. The first chromatogram (upper left) was obtained with a solvent consisting of 90 vol% acetonitrile and 10 vol% aqueous buffer. Acetonitrile has a high eluent strength, and all compounds are eluted rapidly.
في فصل الطور المعكوس ، تقل قوة الشطف حيث يصبح المذيب أكثر قطبية. تم الحصول على أول مخطط كروماتوجرافي (أعلى اليسار) باستخدام مذيب يتكون من 90٪ بالحجم الأسيتونيتريل و 10٪ بالحجم المحلول المنظم المائي. يتمتع الأسيتونتريل بقوة شطف عالية ، ويتم التخلص من جميع المركبات بسرعة.
Hydrophilic Interaction Chromatography (HILIC)
كروماتوغرافيا التأثير الهيدروفيلي
Hydrophilic substances are soluble in water or attract water to their surfaces. Polar organic molecules have hydrophilic regions. Hydrophilic interaction chromatography is most useful for small molecules that are too polar to be retained by reversed-phase columns. Stationary phases for hydrophilic interaction chromatography are strongly polar. The mobile phase typically contains (25–97 vol%) CH3CN or other polar organic solvent mixed with aqueous buffer. Solutes equilibrate between the mobile phase and a layer of aqueous phase on the surface of the stationary phase. In biochemistry, HILIC is useful for separating peptides and saccharides (sugars).
المواد الهيدروفيلية أو المحبة للماء قابلة للذوبان في الماء أو تجذب الماء إلى سطحها. كما تحتوي الجزيئات العضوية القطبية على مناطق محبة للماء. و تعد كروماتوغرافيا التأثير الهيدروفيلي HILIC أكثر فائدة للجزيئات الصغيرة القطبية جدًا بحيث لا يمكن استبقائها بواسطة أعمدة الطور المعكوس. فالأطوار الثابتة لكروماتوغرافيا التأثير الهيدروفيلي تُعدّ قطبية للغاية. و يحتوي الطور المتحرك المثالي على (25-97 % حجما من CH3CN أو أي مذيب عضوي قطبي آخر ممزوج مع محلول منظم مائي. يتوازن المذاب بين الطور المتحرك وطبقة الطور المائي على سطح الطور الثابت. و في الكيمياء الحيوية تعد تقنية HILIC مفيدة لفصل الببتيدات والسكريدات (السكريات).
In HILIC, eluent strength is increased by increasing the fraction of water in the mobile phase. Gradient elution goes from low aqueous content to high aqueous content. In normal phase chromatography, the solvent is non aqueous. To increase eluent strength, we increase the polarity of the non aqueous solvent. In reversed-phase chromatography, the solvent is usually aqueous, and eluent strength is increased by decreasing the fraction of water in the mobile phase to increase the solubility of solutes in the mobile phase.
في HILIC ، تزداد قوة المادة الشاطفة عن طريق زيادة جزء الماء في الطور المتحرك. و ينتقل شطف المتدرج من المحتوى المائي المنخفض إلى المحتوى المائي العالي. أما في كروماتوغرافيا الطور العادي فإن المذيب يكون غير مائي. ولزيادة قوة الشطف ، نقوم بزيادة قطبية المذيب غير المائي. و في كروماتوغرافيا الطور العكوس، في العادة يكون المذيب مائيا ، وتزداد قوة المادة الشاطفة عن طريق تقليل جزء الماء في الطور المتحرك لزيادة قابلية ذوبان المذاب في الطور المتحرك.
Solvents المذيبات
Pure HPLC-grade solvents are expensive and must be free of all types of impurities and contaminants to prevent degradation of costly columns and to minimize detector background signals from contaminants.
تُعد المذيبات النقية الخاصة بكروماتوغرافيا السائل عالية الأداء باهظة الثمن ويجب أن تكون خالية من جميع أنواع الشوائب والملوثات لمنع تدهور الأعمدة المكلفة وتقليل الإشارات خلفية الصادرة عن المكشاف بسبب الملوثات.
Before use, solvents are purged with He or evacuated to remove dissolved air. Air bubbles create difficulties for pumps, columns, and detectors.
قبل الاستخدام ، يتم تنظيف المذيبات بالهيليوم أو تفريغها لإزالة الهواء الذائب.ففقاعات الهواء تتسبب بحدوث صعوبات للمضخات والأعمدة وأجهزة الكشف.
Dissolved O2 absorbs ultraviolet radiation in the 250- to 200-nm wavelength range, interfering with ultraviolet detection.
يمتص الأكسجين المذاب الأشعة فوق البنفسجية في نطاق الطول الموجي 250 إلى 200 نانومتر ، مما يتداخل مع الكشف عن الأشعة فوق البنفسجية.
Sample and solvent are passed through a short, expendable guard column that has the same stationary phase as the analytical column and retains strongly adsorbed species.
يتم تمرير العينة والمذيب عبر عمود حماية قصير قابل للاستهلاك لديه طور ثابت مشابه للطور الثابت للعمود التحليلي و يستبقي بالأنواع شديدة الامتزاز.
At the end of a reversed-phase separation, the column should be washed with 10–20 mobile phase volumes (Vm) of strong eluent to remove strongly retained solutes.
في نهاية فصل الطور المعكوس ، يجب غسل العمود بـ 10-20 حجوم من الطور المتحرك (Vm) من شاطف قوي لإزالة المواد المذابة المستبقية بشدة.
To clean the column after a series of runs, first replace aqueous buffer by water. Then wash the column with 10–20 mobile phase volumes of strong solvent such as acetonitrile-water (95:5 vol/vol) and store the column with this solvent. This procedure is suitable for alkyl, aryl, cyano, and embedded polar-phase columns. A different procedure is recommended for normal-phase columns.
لتنظيف العمود بعد سلسلة من الفحوصات و التشغيل، استبدل المحلول المنظم المائي أولاً بالماء. ثم اغسل العمود بـ 10-20 حجوم من طور متحرك لمذيب قوي مثل الماء-الأسيتونيتريل (5: 95 حجما/ حجما) وقم بتخزين العمود مع هذا المذيب. وهذا الإجراء المذكور هنا مناسب لأعمدة الألكيل ، والأريل ، والسيانو ، وأعمدة الطور القطبي المضمنة. و بالتالي يوصى بإجراءات مختلفة لأعمدة الطور العادي .
Normal-phase separations are sensitive to water in the solvent. To speed the equilibration of stationary phase with changing eluents, organic solvents for normal-phase chromatography should be 50% saturated with water. Saturation can be achieved by adding a few milliliters of water to dry solvent and stirring. Then the wet solvent is separated from the excess water and mixed with an equal volume of dry solvent.
تكون عمليات الفصل في الطور الطبيعي حساسة للماء الموجود في المذيب. و لتسريع موازنة الطور الثابت مع تغيير المواد الشاطفة، يجب أن تكون المذيبات العضوية للكروماتوغرافيا في الطور العادي مشبعة بالماء بنسبة 50٪. ويمكن تحقيق التشبع بإضافة بضعة مليلتر من الماء إلى المذيب الجاف والتقليب. ثم يتم فصل المذيب الرطب عن الماء الزائد وخلطه مع حجم مساوٍ من المذيب الجاف.
For gradient elution in reversed-phase separations, 10–20 volumes (Vm) of initial solvent should be passed through the column after a run to equilibrate the stationary phase with solvent for the next run. Equilibration can take as long as the separation.
أما لغايات الشطف المتدرج في عمليات الفصل ذات الطور العكوس، يجب تمرير 10-20 حجوما (Vm) من المذيب الأولي عبر العمود بعد تشغيل لمعايرة الطور الثابت مع المذيب للتشغيل التالي. و يمكن أن تستغرق المعايرة من الوقت ما يصل إلى مدة الفصل بحد ذاتها.
المصادر:
- Quantitative Chemical Analysis by Daniel C. Harris, 8th Edition
- الموسوعة العلمية الكيميائية للأستاذ أكرم العلي
لتجارب كيميائية سهلة و شيقة و ممتعة يرجى الضغط على الرابط الآتي: تجارب كيميائية سهلة و شيقة و ممتعة (10) Amazing Chemistry Experiments
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة