مركبات الصوديوم
أشهر مركبات الصوديوم
هيدروكسيد الصوديوم :
مركب صلب أبيض اللون إسترطابي يوجد على شكل حبيبات صغيرة أو كتل. صيغته الكيميائية NaOH ، وزنه الجزيئي 40 جرام/مول، كثافته 2.13 جرام /سم3، درجة انصهاره 318 درجة سيليزية ، درجة غليانه 1390 درجة سيليزية.
يمكن تحضيره في المعمل عن طريق تفاعل هيدروكسيد الكالسيوم مع كربونات الصوديوم .
يعمل هيدروكسيد الصوديوم على امتصاص ثاني أكسيد الكربون والماء من الهواء الجوي بسرعة و هي مادة كاوية جدا للأنسجة الحيوانية و النباتية و أيضا لفلز الألومنيوم في وجود الرطوبة . قابل للذوبان في الماء و الكحول المطلق و الميثانول و الجليسرين .عندما يذوب في الماء يولد حرارة عالية أو عند خلطه مع الحموض . تُستخدم هيدروكسيد الصوديوم في معادلة الحموض و صناعة بعض المنتجات مثل الورق و الصابون والمنسوجات، وتدخل أيضًا في تكوين بعض المواد للاستخدامات المنزلية كمنظفات الفضلات التي تَعْلَق بالأنابيب أو تسُدُّها ، كما تستخدم في صناعة المواد العضوية الملوِّنة. يجب الاحتفاظ بالعلبة الحاوية على هيدروكسيد الصوديوم محكمة الإغلاق وبعيدة عن الرطوبة و الحرارة و كذلك يجب عدم التعامل معها و اليدين عارية .
تحضير هيدروكسيد الصوديوم
1 – طريقة جوساك : يتم تسخين محلول كربونات الصوديوم تركيز 10% مع زيادة من محلول هيدروكسيد الكالسيوم .
Na2CO3 + Ca(OH)2 → CaCO3 ↓ + 2NaOH
2 – التحليل الكهربائي : يتم التحضير عن طريق التحليل الكهربائي لمحلول كلوريد الصوديوم المركز.
3 – طريقة كلنر و سولفاي : طريقة لصنع هيدروكسيد الصوديوم و الكلور من كلوريد الصوديوم . محلول كلوريد الصوديوم يتم تحليله كهربائيا من خلال اقطاب كربون تعمل كمصعد و قطب زئبق كمهبط . فغاز الكلور يسحب من الخلية عن طريق انابيب خاصة أما الكاثود فإنه يكون مملغم مع الصوديوم و الذي يتم ازالته ونقله على وعاء آخر حيث يتكون هيدروكسيد الصوديوم و يتصاعد الهيدروجين .
التفاعلات الكيميائية :
1 – التفاعل مع الأملاح : يتفاعل هيدروكسيد الصوديوم مع الأملاح الفلزية مكونا الهيدروكسيدات التي يمكن أن تكون قابلة أو غير قابلة للذوبان في زيادة من هيدروكسيد الصوديوم . بعض تلك الهيدروكسيدات غير مستقرة و قابلة للتفكك إلي أكاسيد غير قابلة للذوبان . من الأمثلة على الهيدروكسيدات غير القابلة للذوبان هيدروكسيد الحديديك .
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
و من الهيدروكسيدات غير المستقرة
HgCl2 + 2NaOH → 2NaCl + Hg(OH)2
Hg(OH)2 → HgO ↓ + H2O
2AgNO3 + 2NaOH → 2NaNO3 + 2AgOH
2AgOH → Ag2O ↓ + H2O
2 – التفاعل مع اللافلزات
3NaOH + P4 + 3H2O → 3NaH2PO2 + PH3
6NaOH + 4S → Na2S2O3 + 2Na2S + H2O
3 – التفاعل مع الهالوجينات
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
3 – التفاعل مع الفلزات
الفلزات ذات الكهروموجبية الضعيفة مثل الخارصين و الألومنيوم و القصدير قابلة للذوبان في هيدروكسيد الصوديوم مما يتصاعد غاز الهيدروجين.
Zn + 2NaOH → Na2ZnO2 + H2
نترات الصوديوم :
مادة صلب بيضاء اللون صيغته الكيميائية NaNO3 وزنها الجزيئ 84.99، و كثافتها 2.26 جرام/سم3، و درجة انصهارها 308 درجة سيليزية ، وتصبح مسترطبة في الهواء الرطب وهي قابلة للذوبان في الماء وفي الإيثانول. يمكن تحضيرها عن طريق تفاعل حمض النيتريك مع هيدروكسيد الصوديوم أو كربونات الصوديوم. في السابق كانت تستخدم لتحضير حمض النيتريك عن طريق تسخينها مع حمض الكبريتيك المركز . تستخدم في صناعة الأسمدة الزراعية . يجب حفظها في عبوة محكمة الإغلاق .
نتريت الصوديوم :
مادة صلبة بلورية صفراء اللون و استرطابية تتأكسد ببطء في الهواء إلى النترات، صيغتها الكيميائية NaNO2 و وزنها الجزيئي 69، و كثافتها 2.17 جرام/سم3 ، و درجة انصهارها 271 درجة سيليزية، و هي قابلة للذوبان في الماء و شحيحة الذوبان في الإيثر و الإيثانول. يمكن تحضيرها عن طريق التفكك الحراري لنترات الصوديوم و تستخدم في تحضير حمض النيتروز . تدخل في صناعة الأصباغ و كمادة حافظة للأطعمة و المركبات العضوية و ككاشف في الكيمياء التحليلية و أيضا كمادة مختزلة أو مؤكسدة.
5NaNO2 + 4H2SO4 + 2KMnO4 → K2SO4 + 2MnSO4 + 3H2O + 5NaNO3
2NaNO2 + 2NaI + 4HCl → 4NaCl + 2NO + H2O + I2
كربونات الصوديوم :
و تعرف أيضا باسم كربونات الصوديوم اللامائية أو ملح الصودا ، و هي مادة صلبة بيضاء اللون صيغته الكيميائية Na2CO3 و وزنها الجزيئي 105.99 وكثافتها 2.53 ، و درجة انصهارها 851 درجة سيليزية . يوجد لكربونات الصوديوم شكلين متميئين و هما أحادي الماء Na2CO3.H2O و هي عبارة عن مادة بلورية بيضاء اللون قابلة للذوبان في الماء و غير قابلة للذوبان في الكحول و كثافتها 1.55 جرام/سم3 ، و تفقد ماءها عند درجة حرارة 109 درجة سيليزية، و هناك نوع آخر عشاري الماء و يعرف باسم صودا الغسيل و صيغتها الكيميائية Na2CO3.10H2O و هي عبارة عن مركب بلوري شفاف كثافتها 1.44 جرام/سم3 و تفقد مائها عند درجة حرارة تتراوح ما بين 32-34 درجة سيليزية .
يمكن تحضير كربونات الصوديوم عن طريق تفاعل سولفاي .تدخل كربونات الصوديوم في صناعة الزجاج و السيرميك و الورق و الصابون و غيرها .
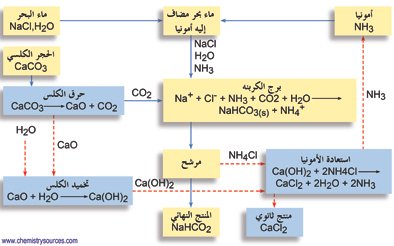
تحضير كربونات الصوديوم
طريقة سولفاي : هي طريقة صناعية لصناعة كربونات الصوديوم من كربونات الكالسيوم و كلوريد الصوديوم و الأمونيا . تسخن أولا كربونات الكالسيوم لتعطي أكسيد الكالسيوم و ثاني أكسيد الكربون و الذي يتم ضخه في محلول كلوريد الصوديوم في الأمونيا و من ثم يتم ترسيب بيكربونات الصوديوم . و من ثم تسخن بيكربونات الصوديوم لتعطي كربونات الصوديوم و ثاني أكسيد الكربون .
NH3 + H2O + CO2 → NH4HCO3
NaCl + NH4HCO3 → NaHCO3 + NH4Cl
NaHCO3 → Na2CO3 + H2O + CO2
طريقة ليبلانك : طريقة قديمة كانت تستعمل في الماضي لصناعة كربونات الصوديوم .المواد الأولية لهذه الطريقة كانت كلوريد الصوديوم ، حمض الكبريتيك ، فحم الكوك ، الحجر الكلسي ( كربونات الكالسيوم ) ، و قد كانت تتطلب هذه الطريقة خطوتان . الاولى يتم فيها تسخين كلوريد الصوديوم مع حمض الكبريتيك فينتج كبريتات الصوديوم :
2NaCl + H2SO4 → Na2SO4 + 2HCl
و الخطوة الثانية يتم فيها تفاعل كبريتات الصوديوم مع فحم الكوك و الحجر الكلسي :
Na2SO4 + 2C + CaCO3 →Na2CO3 + CaS + 2CO2
حيث يستخلص كربونات الصوديوم من خلال طريقة التبلور . قام باختراع هذه الطريقة العالم الفرنسي نيكولاس ليبلانك . في نهاية القرن التاسع عشر تم استبدال هذه الطريقة بطريقة سولفاي .
بيكربونات الصوديوم :
و تعرف أيضا بمسحوق التخمير و بـكربونات الصوديوم الهيدروجينية ، وهي مادة بلورية توجد على شكل مسحوق أو حبيبات ، صيغتها الكيميائية NaHCO3 وزنها الجزيئي 84.01 درجة ، تبدأ بفقد ثاني أكسيد الكربون عند 50 درجة سيليزية و تتحول إلى كربونات الصوديوم Na2CO3 عند 100 درجة سيليزية .
تتفكك بسهولة مع الحموض الضعيفة . و في المحاليل المائية و عند درجة حرارة 20 درجة سيليزية تتفكك إلى ثاني أكسيد الكربون و كربونات الصوديوم و تتفكك بالكامل عند الغليان . تذوب بسهولة في الماء و لكنها لا تذوب في الكحول . محاليلها المائية تحضر بالماء البارد و تأثيرها على دليل تباع الشمس ودليل الفينولفثالين قاعدي.
عند زيادة درجة الحرارة تزداد القلوية . قيمة الرقم الهيدروجيني للمحلول المحضر حديثا من هذه المادة تركيزه 0.1 مول/لتر عند درجة حرارة 25 درجة سيليزية يساوي 8.3 . تدخل بيكربونات الصوديوم في العديد الصناعات مثل صناعة الأغذية و الطفايات الحرائق و المنظفات .
تحضير بيكربونات الصوديوم
تحضر بيكربونات الصوديوم عن طريق إمرار غاز ثاني أكسيد الكربون CO2 في محلول مركز من كربونات الصوديوم Na2CO3 .
Na2CO3 + H2O + CO2 → 2NaHCO3
كلوريد الصوديوم :
تعرف أيضا باسم ملح الطعام وهي مادة صلبة بلورية بيضاء اللون صيغتها NaCl و وزنها الجزيئي 58.35. و هي قابلة للذوبان في الماء الساخن أو البارد و قليلة الذوبان في الكحول ولكنها عديمة الذوبان حمض الهيدروكلوريك المركز. توجد مادة كلوريد الصوديوم على نحو واسع في الطبيعة. فهي توجد كمحلول في مياه المحيطات بنسبة 30 جرام/ لتر (حوالي 4.08 أونس / غالونات) من الماء ، أي أن يشكل الملح حوالي 3 ٪ من ماء المحيط وزنيا. كذلك توجد أيضا في العديد من الأنهار و البحيرات و البحار الداخلية ، بنسب تتفاوت ما بين 0.002 ٪ في نهر ميسيسيبي إلى 12 ٪ في بحيرة الملح العظيمة. درجة انصهار كلوريد الصوديوم 804 درجة سيليزية، و كثافتها 2.17 جرام/سم3 . تدخل كلوريد الصوديوم في المنزل كأحد أهم التوابل التي تستعمل في أعداد الأطعمة باسم ملح الطعام و بالطبع يضاف إليها كمية من اليود خوفا من الإصابة بمرض الغدة الدرقية. تدخل كلوريد الصوديوم في صناعة الكلور و مركباته و بصناعة الصوديوم و مركباته. يستخدم ملح كلوريد الصوديوم كمادة حافظة للأطعمة وللتبريد و في صناعة الزجاج و الصابون و كذلك صناعة العدسات والمنشورات المستخدمة في دراسات الأشعة تحت الحمراء .
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :