نموذج نظرية تنافر أزواج إلكترونات مستوى التكافؤ (VSEPR )
Valence Shell Electron Pair Repulsion
و تعرف أيضا باسم نموذج التنافر بين أزواج إلكترونات التكافؤ
(الكيمياء العامة المستوى الاول – الكلية الجامعية بالجموم)
تعمل أزواج الإلكترونات الرابطة و غير الرابطة في المركب على أن تترتب بالنسبة إلى بعضها البعض بحيث يتخذ الجزيء شكلا فراغيا يكون فيه التنافر بين أزواج الإلكترونات أقل ما يمكن ما يجعل الجزيء أكثر ثباتا واستقرارا.
نظرية تنافر أزواج إلكترونات مستوى التكافؤ VSEPR: نظرية يمكنُ من خلالها التنبُّؤُ بأشكال الجزيئات؛ فهي تفترضُ أنّ أزواج إلكترونات التكافؤ تترتّبُ حولَ كلّ ذرّة بحيث تكونُ أبعدَ ما يمكن ليكونَ التنافرُ فيما بينها أقلَّ ما يمكن، وبهذا يمكنُ تحديدُ مقدار الزاوية بين الروابط في الجزيء، وتوقُّعُ شكلِهِ الفراغيّ.

أهم افتراضات نظرية تنافر أزواج إلكترونات مستوى التكافؤ VSEPR
- نظرية تستخدم لاستنتاج الشكل الفراغي للجزيء أو الأيون.
- تفترض هذه النظرية على أن الذرات تتخذ ترتيبا فراغيا حول الذرة المركزية اعتمادا على التنافر بين أزواج الإلكترونات الرابطة و غير الرابطة في غلاف التكافؤ للذرة ، بحيث تصل لأقل طاقة و بالتالي أكثر استقرارا.
- تعتمد هذه النظرية على أن الشكل الهندسي للجزيء أو الأيون هو الذي يؤدي إلى أقل تنافر بين إلكترونات التكافؤ في ذرات الجزيء أو الأيون ، حيث تتوزع الذرات بالنسبة لبعضها البعض في الجزيء بطريقة تصل من خلالها إلى أقصى حالة من الاستقرار و الثبات و بالتالي تصل إلى الحالة الطاقة الأدنى.
- عند وجود زوجين إلكترونين حرين حول الذرة المركزية فإنهما يتباعدان عن بعضهما البعض ليصبحا على جانبي النواة و بزاوية مقدارها 180 درجة و هنا يوصف الجزيء بأنه خطي مثل CO2 و BeCl2 .
- عند وجود ثلاثة ازواج إلكترونية حرة أو أربعة ازواج إلكترونية حرة حول الذرة المركزية فإن الامر يختلف حيث يأخذ لجزيء أشكالا مختلفة يحددها عدد الازواج الإلكترونية المحيطة بالذرة المركزية.
- من عيوب نظرية تنافر أزواج إلكترونات غلاف التكافؤ أنها لم تفسر كيفية توزيع إلكترونات الرابطة بين أغلفة التكافؤ للذرتين المكونتين للرابطة.
- لتفسير كيفية توزيع إلكترونات الرابطة بين أغلفة التكافؤ للذرتين المكونتين للرابطة ظهرت نظرية رابطة التكافؤ.
- حسب نظرية رابطة التكافؤ فإنه عند تشكيل الرابطة المشتركة تقترب الذرتين من بعضهما البعض بحيث تتداخل الأفلاك الذرية لغلافي تكافؤ الذرتين فتزداد الكثافة الإلكترونية في منطقة تداخل الافلاك بين الذرتين فتقترب النواتين من بعضهما و يزداد انجذابهما نحو منطقة تداخل الفلكين و بذلك تتكون الرابطة المشتركة بينهما.
- و يمكن استخدام نظرية التكافؤ لتفسير بعض الجزيئات البسيطة مثل H2 و HCl .

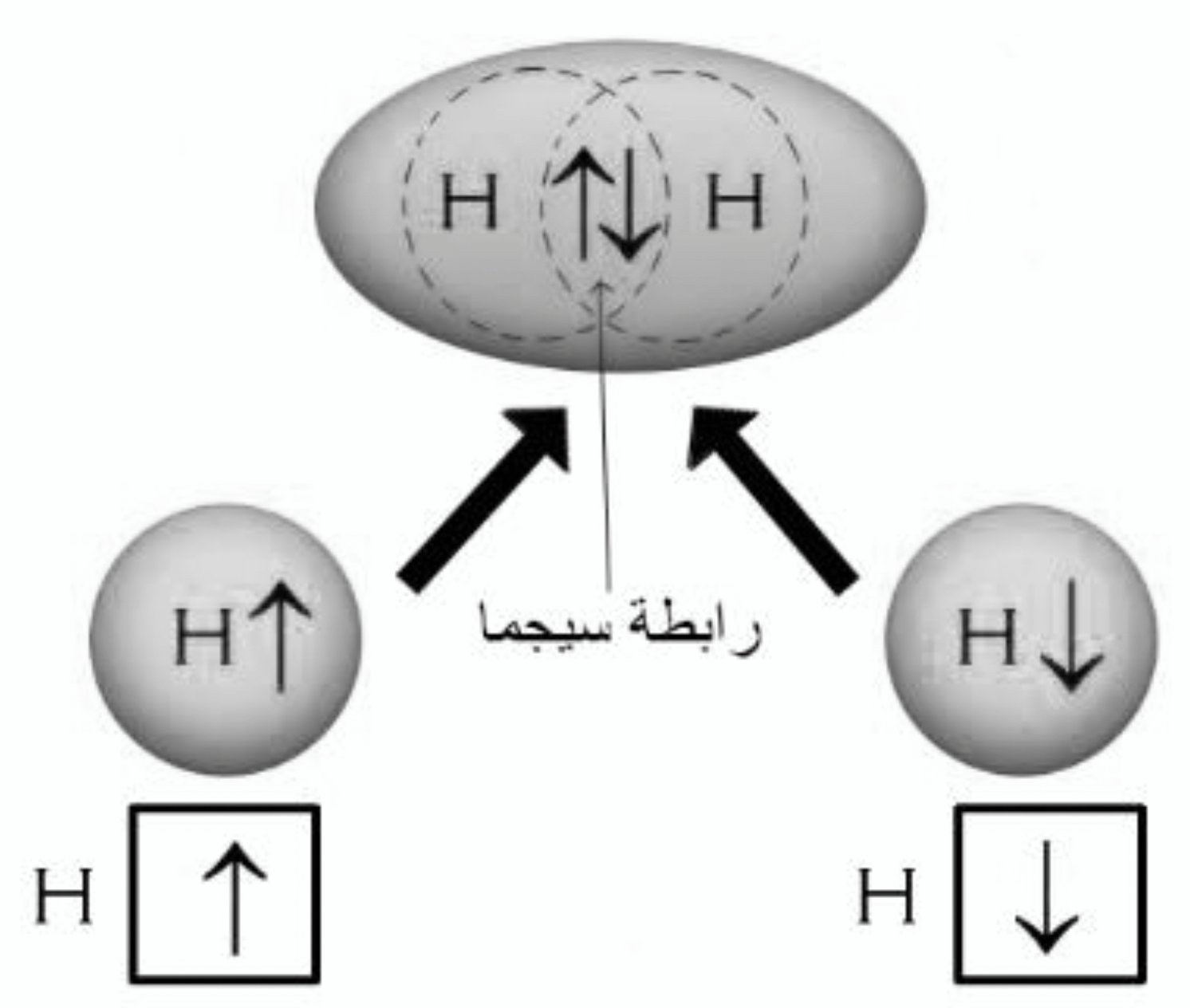
جزيء الهيدروجين
- عند اقتراب ذرتي هيدروجين من بعضهما البعض فإن فلكيهما نصف الممتلئين من نوع 1s يتداخلان مع بعضهما البعض .
- تتركز إلكترونات الرابطة بين نواتي الذرتين حيث تزداد الكثافة الإلكترونية في منطقة التداخل حول المحور الواصل بين النواتين و تأخذ شكلا متماثلا يقرب من الشكل البيضوي على طول المحور الواصل بين نواتي الذرتين .
- تعرف هذه الرابطة الناتجة عن تداخل فلكي s باسم رابطة سيجما σ .
جزيء كلوريد الهيدروجين
- عند اقتراب ذرة هيدروجين من ذرة كلور فإن فلك الهيدروجين من نوع 1sيتداخل مع فلك الكلور من نوع 3p و بذلك تتركز إلكترونات الرابطة بين نواتي الذرتين حيث تزداد الكثافة الإلكترونية في منطقة التداخل حول المحور الواصل بين النواتين و تأخذ شكلا متماثلا يقرب من الشكل البيضوي على طول المحور الواصل بين نواتي الذرتين ، و تعرف هذه الرابطة الناتجة عن تداخل فلكي sباسم رابطة سيجما σ .

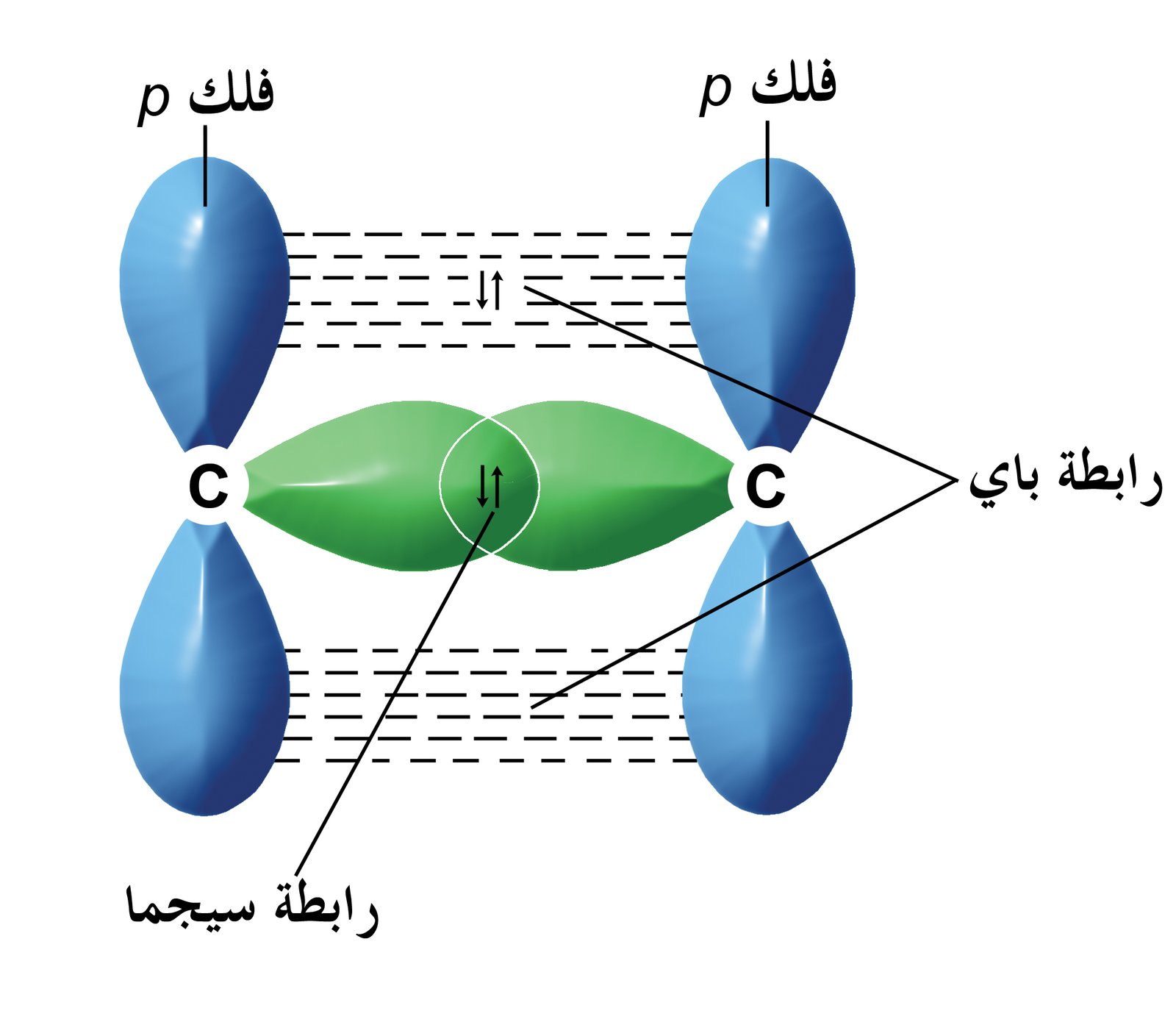
- أما إذا تداخل فلكp من الذرة الأولى مع فلك p من الذرة الثانية فإن ذلك يحدث بطريقتين مختلفتين و هما :
- أولا: تداخل الفلك p مع الفلك p في نفس المحور : حيث تقترب الذرتين من بعضهما البعض بمسافة كافية و يحدث تداخل لفلكيp من الذرتين على نفس المحور و بذلك تتركز إلكترونات الرابطة بين نواتي الذرتين حيث تزداد الكثافة الإلكترونية في منطقة التداخل حول المحور الواصل بين النواتين و تسمى الرابطة المشتركة الناتجة بالرابطة سيجما σ .
- ثانيا– تداخل الفلك p مع الفلك p جانبيا : حيث يزداد الترابط بين الذرتين بتداخل الأفلاك على المحاور المتقابلة جانبيا و عليه تتوزع الكثافة الإلكترونية بشكل متماثل على جانبي المحور الواصل بين نواتي الذرتين و تسمى الرابطة في هذه الحالة بالرابطة باي π .
عيوب نظرية التنافر بين إلكترونات التكافؤ VSEPR
- من عيوب نظرية التكافؤ أنها:
1 – لم تفسر مقدار اختلاف الزاوية بين الروابط في بعض الجزيئات .
2 – لم تفسر قدرة ذرة الكربون على تكوين أربعة روابط في جزيء الميثان CH4 .
3 – و لم تفسر مقدار الزاوية بين الرابط الأربعة في نفس الجزيء و البالغة 109.5 درجة.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة