ملخص الفصل الأول 1 من كتاب مبادئ الكيمياء العضوية ماكموري Organic Chemistry John McMurry Structure and Bonding Acids and Bases
Posted in :
ملخص الفصل الأول 1 من كتاب مبادئ الكيمياء العضوية ماكموري
Organic Chemistry John McMurry Structure and Bonding Acids and Bases
إذا كنت تبحث عن ملخصات باقي الفصول فسوف تجدها في الروابط الآتية
Introduction to organic chemistry
Organic compounds contain carbon atoms bonded hydrogen and other atoms. Organic chemistry studies the properties and reactions of organic compounds.
مقدمة للكيمياء العضوية
تحتوي المركبات العضوية على ذرات كربون مرتبطة مع ذرات هيدروجين وذرات أخرى. فالكيمياء العضوية هي فرع من الكيمياء تدرس خصائص وتفاعلات المركبات العضوية.
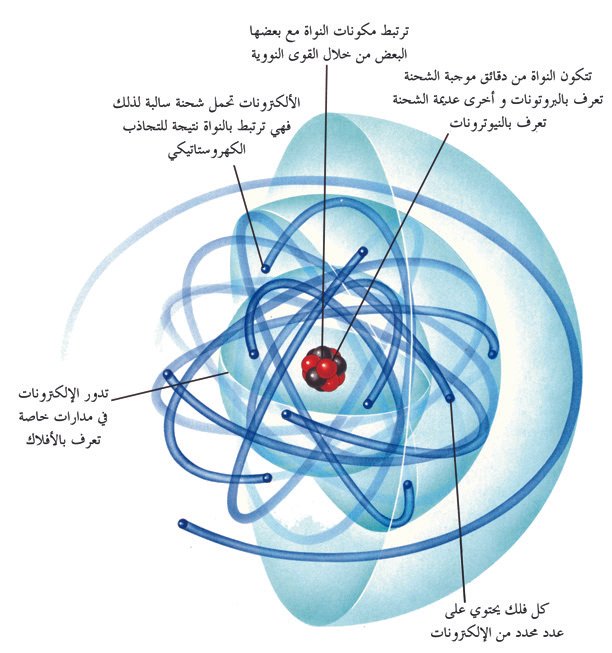
1.1: Atomic Structure – The Nucleus
Atoms are comprised of protons, neutrons and electrons. Protons and neutrons are found in the nucleus of the atom, while electrons are found in the electron cloud around the nucleus. The relative electrical charge of a proton is +1, a neutron has no charge, and an electron’s relative charge is -1. The number of protons in an atom’s nucleus is called the atomic number, Z. The mass number, A, is the sum of the number of protons and the number of neutrons in a nucleus.
An atomic orbital is the probability description of where an electron can be found. The four basic types of orbitals are designated as s, p, d, and f.
1.1 التركيب الذري-النواة
تتكون الذرات من البروتونات والنيوترونات والإلكترونات، حيث توجد البروتونات والنيوترونات في نواة الذرة ، بينما توجد الإلكترونات في السحابة الإلكترونية حول النواة. أن الشحنة الكهربائية النسبية للبروتون هي +1 ، و النيوترون ليس له شحنة ، بينما الشحنة النسبية للإلكترون هي -1. يُطلق على عدد البروتونات في نواة الذرة العدد الذري و يرمز له بالرمز Z. أما العدد الكتلي و الذي يرمز له بالرمز A ، هو مجموع عدد البروتونات وعدد النيوترونات في النواة.
الفلك الذري هو وصف الاحتمال لمكان العثور على الإلكترون. يتم ترميز الأنواع الأربعة الأساسية من الأفلاك على أنها s و p و d و f.
1.2 Atomic Structure: Electron Configurations
The order in which electrons are placed in atomic orbitals is called the electron configuration and is governed by the aufbau principle. Electrons in the outermost shell of an atom are called valence electrons. The number of valence electrons in any atom is related to its position in the periodic table. Elements in the same periodic group have the same number of valence electrons.
2.1 التركيب الذري: توزيع الإلكترونات
يُطلق على التوزيع (الترتيب) الذي يتم فيه وضع الإلكترونات في الأفلاك الذرية اسم “التوزيع الإلكتروني” ويحكمه مبدأ أوفباو aufbau. و تسمى الإلكترونات الموجودة في الغلاف الخارجي للذرة بـ إلكترونات التكافؤ. و يرتبط عدد إلكترونات التكافؤ في أي ذرة بموقعها في الجدول الدوري. فالعناصر في نفس المجموعة لها نفس عدد إلكترونات التكافؤ.
1.3 Development of Chemical Bonding Theory
Lewis Dot Symbols are a way of indicating the number of valence electrons in an atom. They are useful for predicting the number and types of covalent bonds within organic molecules. The molecular shape of molecules is predicted by Valence Shell Electron Pair Repulsion (VSEPR) theory. The shapes of common organic molecules are based on tetrahedral, trigonal planar or linear arrangements of electron groups.
3.1 تطور نظرية الترابط الكيميائي
تعد رموز لويس النقطية طريقةً للإشارة إلى عدد إلكترونات التكافؤ في الذرة، فهي مفيدة للتنبؤ بعدد وأنواع الروابط التساهمية داخل الجزيئات العضوية. كما يتم التنبؤ بالشكل الجزيئي للجزيئات من خلال نظرية تنافر أزواج إلكترونات مستوى التكافؤ Valence Shell Electrons Pair Repulsion Theory (VSEPR). و تعتمد أشكال الجزيئات العضوية الشائعة على الترتيبات الرباعية السطوح أو المستوية المثلثية أو الخطية على مجموعات الإلكترون.
1.4 The Nature of Chemical Bonds
Covalent bonds form as valence electrons are shared between two atoms. Lewis Structures and structural formulas are common ways of showing the covalent bonding in organic molecules. Formal charge describes the changes in the number of valence electrons as an atom becomes bonded into a molecule. If the atom has a net loss of valence electrons it will have a positive formal charge. If the atom has a net gain of valence electrons it will have a negative formal charge.
4.1 طبيعة الروابط الكيميائية
تتشكل الروابط التساهمية عندما يتم تقاسم إلكترونات التكافؤ بين ذرتين. و تعتبر هياكل (بُنيات) لويس والصيغ الهيكلية طرقًا شائعة لإظهار الترابط التساهمي في الجزيئات العضوية. و تصف الشحنة الشكلية التغيرات في عدد إلكترونات التكافؤ عندما تصبح الذرة مرتبطة بجزيء. فإذا كان للذرة خسارة في إلكترونات التكافؤ ، فستكون لها شحنة شكلية موجبة. أما إذا كان للذرة إكتساب لإلكترونات التكافؤ ، فستكون لها شحنة شكلية سالبة.
1.5 sp³ Hybrid Orbitals and the Structure of Methane
The four identical C-H single bonds in methane form as the result of sigma bond overlap between the sp3 hybrid orbitals of carbon and the s orbital of each hydrogen.
5.1 تهيجين الأفلاك من نوع sp3 و تركيب الميثان
إن الروابط الأحادية الأربعة ( C-H ) في جزيء الميثان هي نتيجة لرابطة سيجما المتداخلة بين الأفلاك المهجنة sp3 للكربون و الفلك s لكل ذرة هيدروجين.
1.6 sp3 Hybrid Orbitals and the Structure of Ethane
The C-C bond in ethane forms as the result of sigma bond overlap between a sp³ hybrid orbital on each carbon and the s orbital of each hydrogen. The six identical C-H single bonds in form as the result of sigma bond overlap between the sp³ hybrid orbitals of carbon and the s orbital of each hydrogen.
6.1 تهيجين الأفلاك من نوع sp3 و تركيب الإيثان
تنتج رابطة C-C في الإيثان نتيجة لتداخل رابطة سيجما بين فلك sp³ المهجن على كل كربون و الفلك s لكل هيدروجين. تتداخل الروابط الستة المتماثلة C-H المفردة في الشكل كنتيجة لرابطة سيجما بين الأفلاك المهجنة من نوع sp³ للكربون و الفلك s لكل ذرة هيدروجين.
1.7 Other Kinds of Hybrid Orbitals: sp2 and sp
The C=C bond in ethylene forms as the result of both a sigma bond overlap between a sp2 hybrid orbital on each carbon and a pi bond overlap of a p orbital on each carbon. The carbon-carbon triple bond in acetylene forms as the result of one sigma bond overlap between a sp hybrid orbital on each carbon and two pi bond overlaps of p orbitals on each carbon.
7.1 أنواع أخرى من الأفلاك المهجنة : sp2 و sp
تنتج الرابطة C = C في الإيثيلين كنتيجة لتداخل كل من رابطة سيجما بين فلك sp2 المهجن على كل كربون وتداخل رابطة pi لمدار p على كل كربون.
أما الرابطة الثلاثية للكربون والكربون في أشكال الأسيتيلين نتيجة تداخل رابطة سيجما واحدة بين فلك sp المهجن على كل كربون و تداخلين لرابطة pi لمدارات p على كل كربون.
1.8 Polar Covalent Bonds: Electronegativity
Covalent bonds can have ionic character These are polar covalent bonds Bonding electrons attracted more strongly by one atom than by the other Electron distribution between atoms is not symmetrical. 2.1 Polar Covalent Bonds: Electronegativity. Bond Polarity and Electronegativity.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
2 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
One thought on “ملخص الفصل الأول 1 من كتاب مبادئ الكيمياء العضوية ماكموري Organic Chemistry John McMurry Structure and Bonding Acids and Bases”
Leave a Reply Cancel reply
This site uses Akismet to reduce spam. Learn how your comment data is processed.



جزاكم الله خيرا